
01、circSV2b 在MPTP诱导的PD小鼠中下调
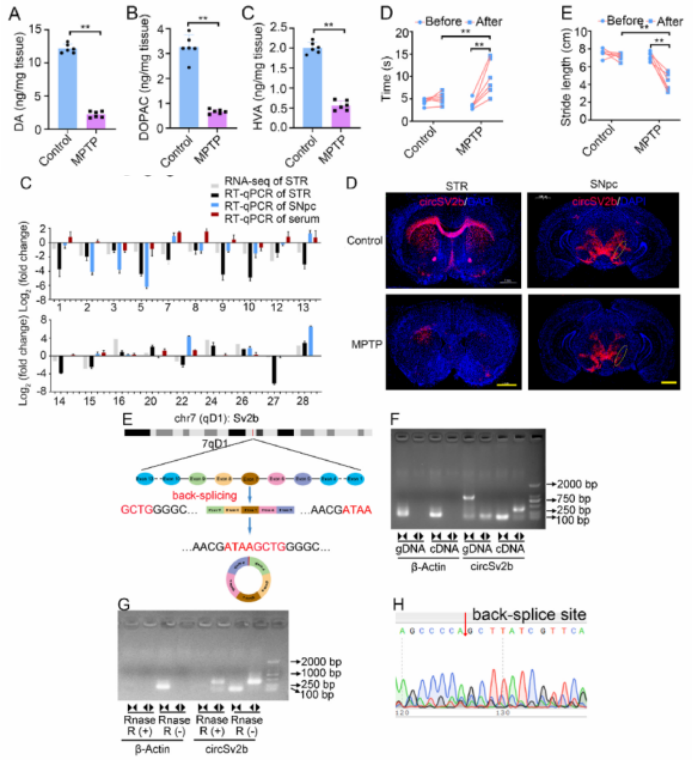
图1. circSV2b 在MPTP诱导的PD小鼠中下调
02、circSV2b的过表达改善了PD小鼠的症状
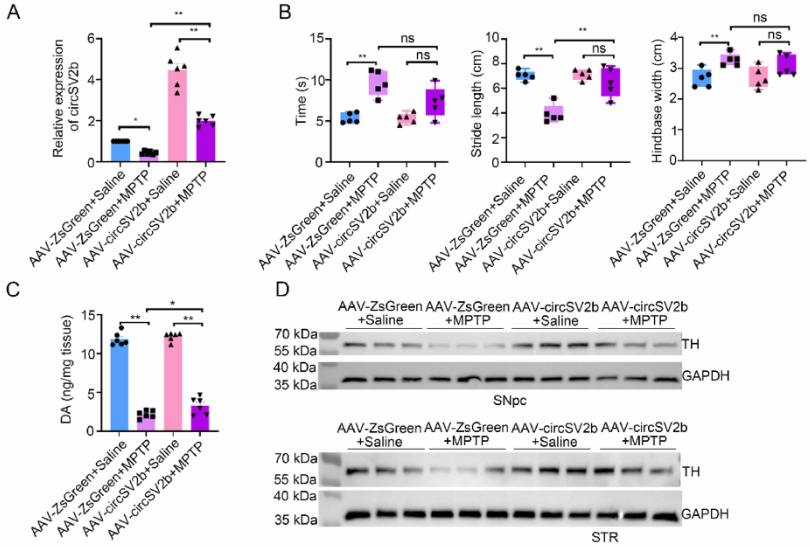
图2.circSV2b的过表达改善了PD小鼠的症状
03、CircSV2b发挥ceRNA机制

图3.CircSV2b发挥ceRNA机制
04、Foxk1是Akt1的转录因子
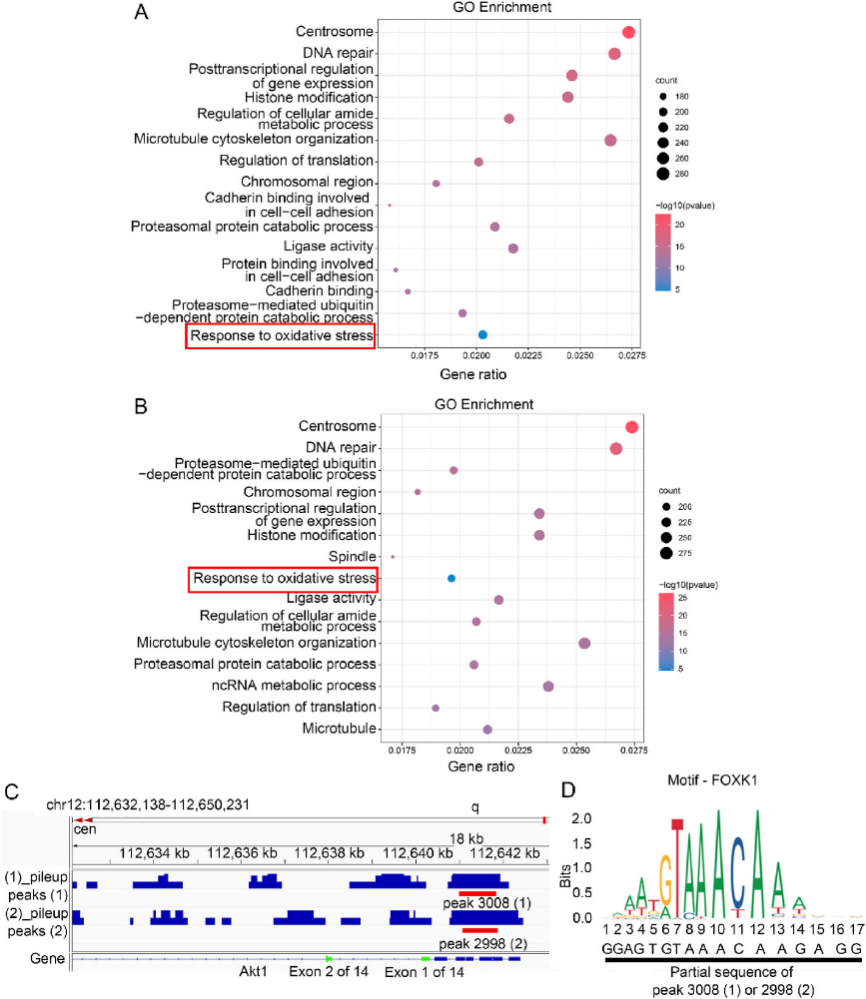
图4.Foxk1是Akt1的转录因子
05、CircSV2b调控miR-5107-5p的表达,miR-5107-5p影响Foxk1的表达,Foxk1影响Akt1的表达
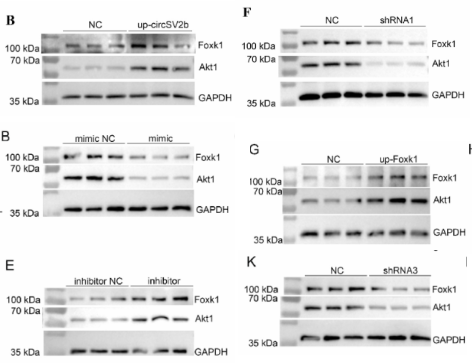
图5.circSV2b与miR-5107-5p/Foxk1/Akt1轴互作
06、过表达circSV2b通过ceRNA-Akt1途径抵抗PD中的氧化应激损伤
为了探索circSV2b过表达导致PD耐药的机制,作者在注射AAV 21天后使用MPTP创建了PD小鼠模型。评估ceRNA-Akt1通路中各分子和氧化应激分子的表达变化。结果表明,circSV2b过表达逆转了MPTP引起的miR-5107-5p的升高,缓解了Foxk1和Akt mRNA和蛋白表达的降低。并且circSV2b过表达降低了MPTP引起的氧化产物MDA的升高,并增强了抗氧化酶(SOD和GSH-PX)的活性。
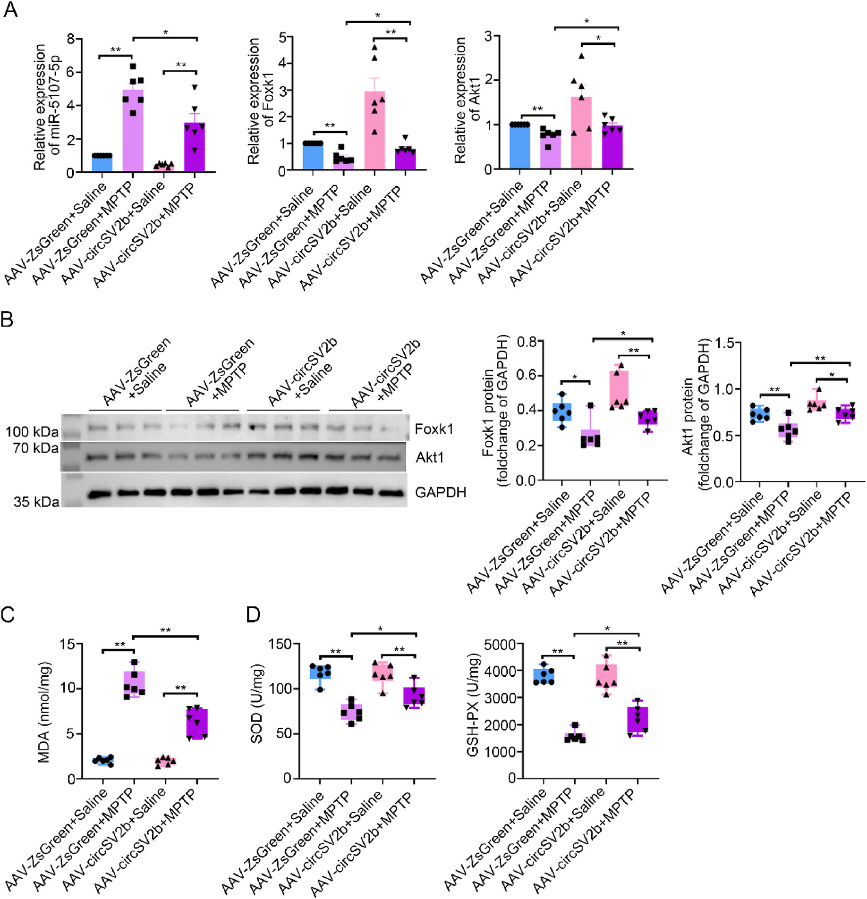
图6.过表达circSV2b通过ceRNA-Akt1途径抵抗PD中的氧化应激损伤
小结
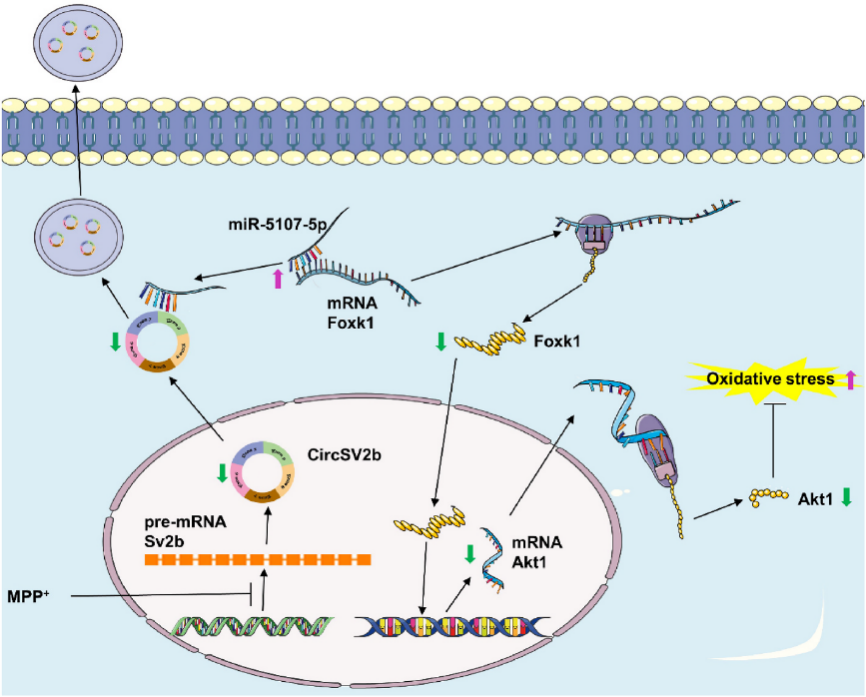
图7.circSV2b在MPTP诱导的PD中的机制
https://doi.org/10.1038/s12276-022-00806-z
参考文献:
[1] M.T. Hayes, Parkinson’s disease and parkinsonism, Am. J. Med. 132 (7) (2019)802–807, https://doi.org/10.1016/j.amjmed.2019.03.001.
[2] X. You, I. Vlatkovic, A. Babic, et al., Neural circular RNAs are derived from synaptic genes and regulated by development and plasticity, Nat. Neurosci. 18 (4) (2015)603–610, https://doi.org/10.1038/nn.3975.
转载请联系邮箱授权:circRNA@163.com
.png)