
数据库预测,获得目的circRNA
circRNA表达研究
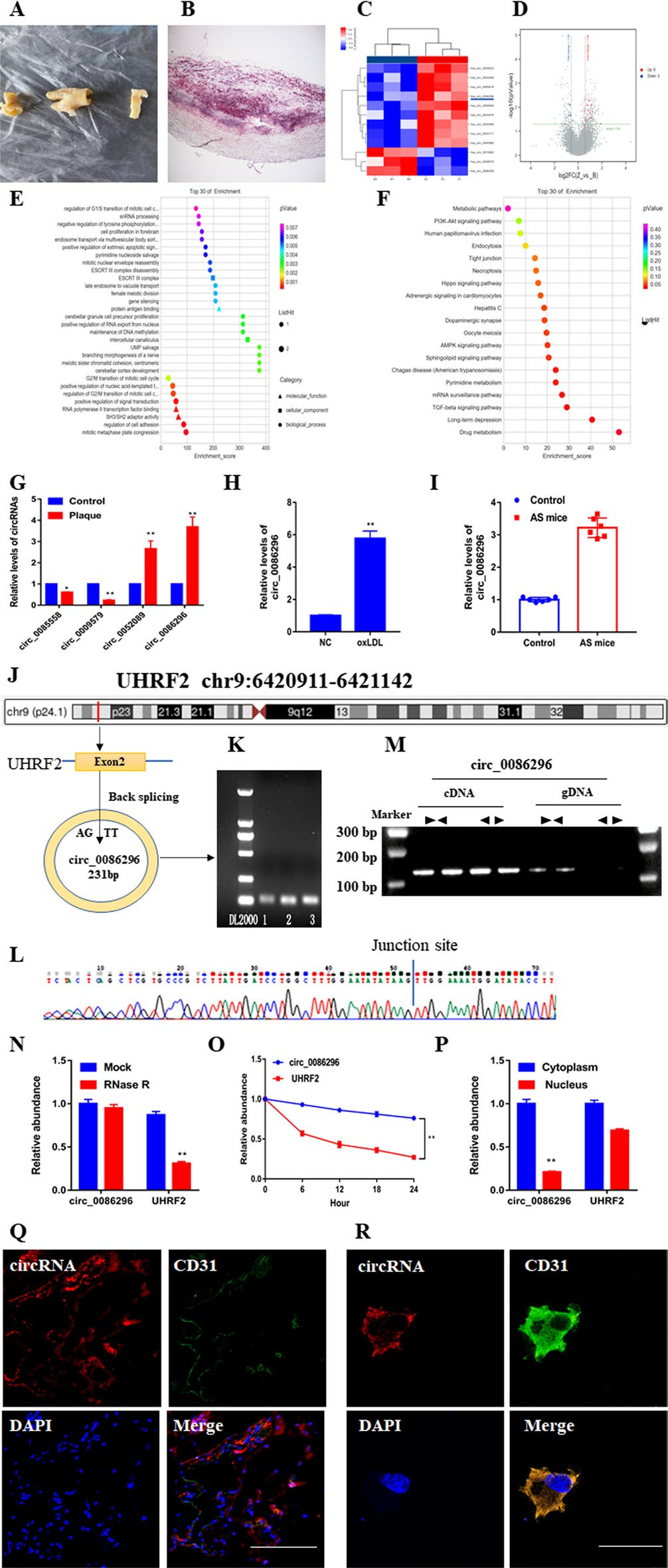
图1.circ_0086296的验证与表征
circRNA表型研究
下游miRNA研究
作者通过生物信息学分析预测了circ_0086296的ceRNA网络。通过重叠数据集,共筛选出65个miRNAs和11个基因。值得注意的是,miR-576-3p的结果特别令人感兴趣,荧光素酶检测实验表明,circ_0086296野生型报告和miR-576-3P模拟降低了荧光素酶活性,而circ_0086296突变型没有这种作用。RIP实验还表明,用抗AGO2抗体富集了miR-576-3p和circ_0086296。FISH结果表明,circ_0086296与miR-576-3P共存于人脐静脉内皮细胞的细胞质中。实验结果证实了circ_0086296是miR-576-3p的分子海绵。
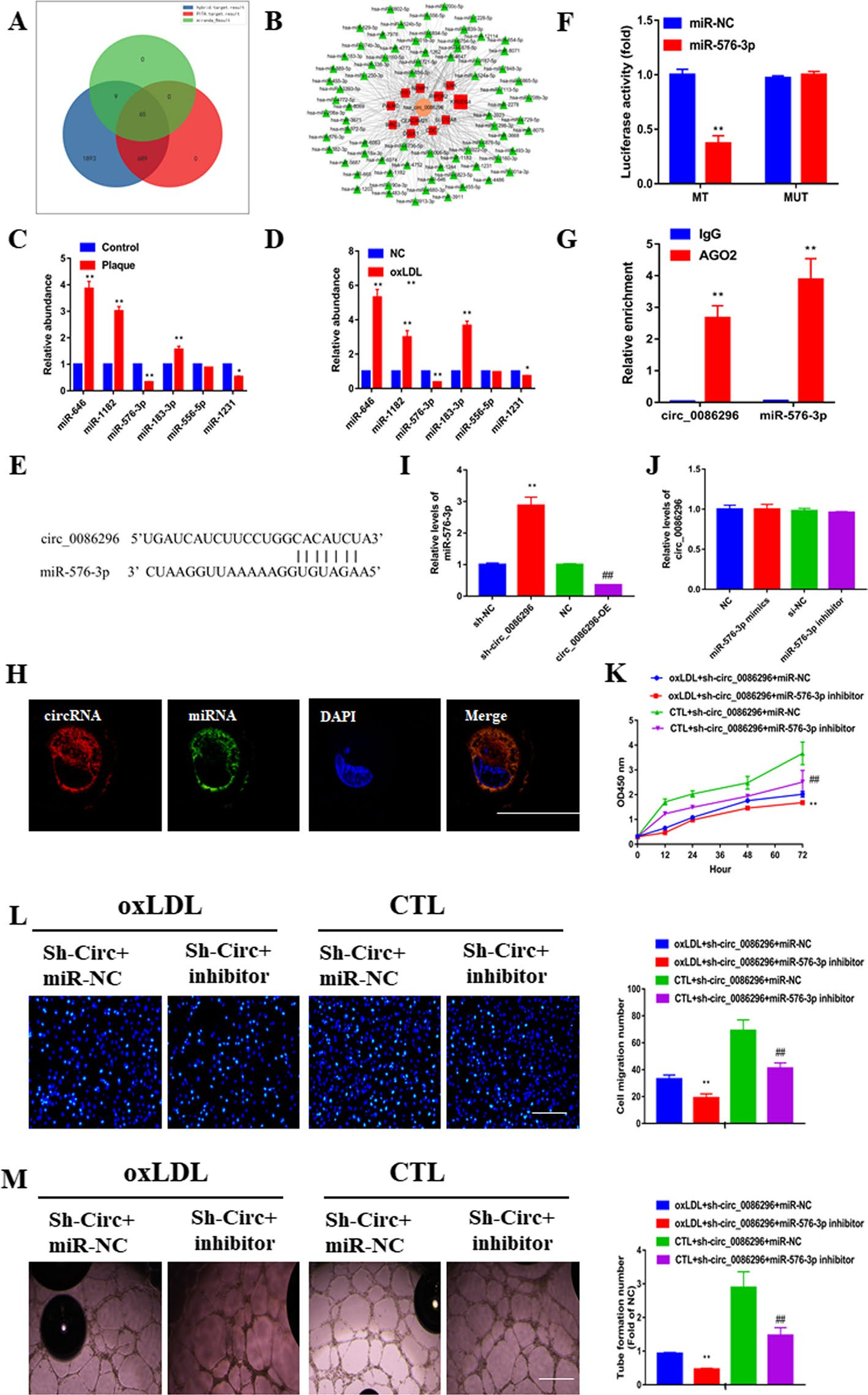
图2.circ_0086296作为miR-576-3P的海绵
miRNA下游基因研究
circRNA-miRNA-基因轴上表达与表型
外泌体研究
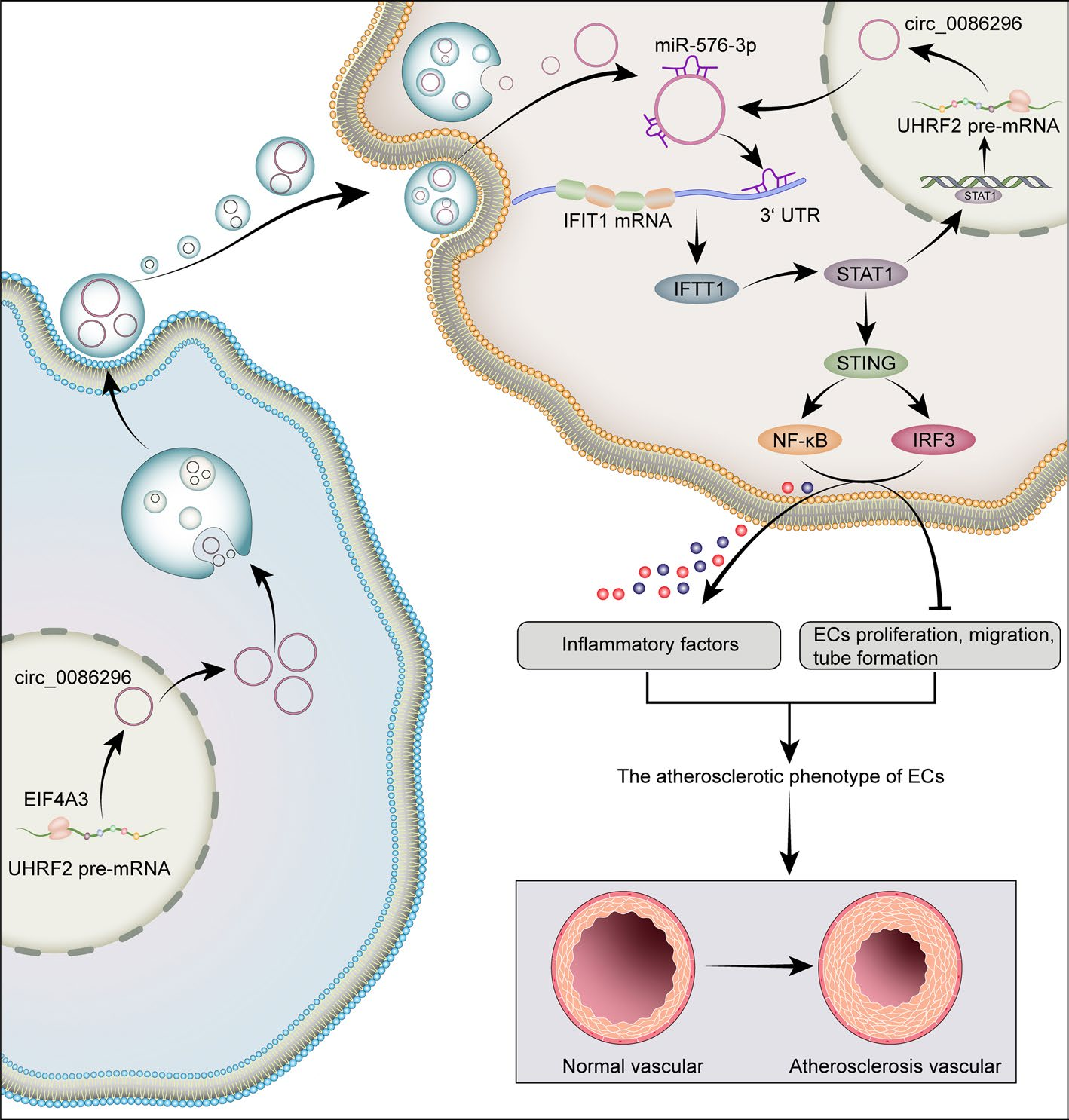
图3.circ_0086296通过miR-576-3P/IFIT1/STAT1诱导的动脉粥样硬化病变示意图
转载请联系邮箱授权:circRNA@163.com
.png)