2020年7月21日,广州医科大学的蒋义国教授在Environ Int(IF=7.577)杂志上发表了一篇题为“Circular RNA circBbs9 promotes PM2.5-induced lung inflammation in mice via NLRP3 inflammasome activation”的文章,阐述circBbs9通过miR-30e-5p-Adar轴激活NLRP3炎症小体,进而参与PM2.5诱导的细胞炎症反应并加重慢性阻塞性肺疾病([1])。

PM2.5是直径小于2.5μm的细颗粒物,其表面可以吸附其他有害物质,进而促进大脑、呼吸和心血管等各种系统中与炎症相关的疾病发生。过量暴露于含有PM2.5的空气中是慢性阻塞性肺疾病(COPD)的主要病因,也是加重COPD的关键因素。非编码RNA(ncRNA)在COPD的发病机制中起着重要作用,被认为是一种很有前途的诊断生物标志物和治疗靶点。然而,ncRNA在PM2.5引起的COPD加重中的作用研究很少,尤其是与炎症相关的分子途径。本篇文章中,作者主要探索circRNA,作为一种新型单链共价闭合环状非编码RNA,在PM2.5暴露诱导的肺部炎症和COPD恶化中的作用。
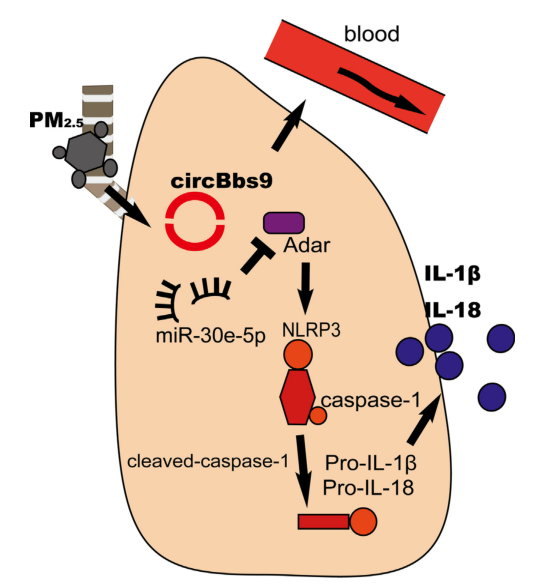
图1 circBbs9-miR-30e-5p-Adar途径调节PM2.5诱导的肺部炎症模式图
1、可吸入颗粒物PM2.5的表征
在PM2.5暴露期间,不断监测周围空气和暴露室中PM2.5的质量浓度。室内PM2.5的日平均质量浓度为0.1 mg/m3至1.7 mg/m3,约为环境空气中PM2.5浓度的5倍。经扫描电镜观察,PM2.5颗粒直径<2.5μm,呈不规则形状,并很好地分散在上清液中。为了表征分散体系的稳定性,作者测定了ZETA电位,它表示颗粒之间的排斥或吸引强度。PM2.5在DMEM介质中稳定,ZETA电位为-33.6 mV。此外,还对PM2.5的水溶性组分和有机组分的化学成分进行了分析。作者测定了水溶性组分中31种金属和元素及多环芳烃中16种化学组分的浓度。金属组分中钙和钾的浓度最高,多环芳烃中荧蒽和芘的浓度最高,这为探索PM2.5功能效应中的主要污染物提供了线索。此外,透射电镜图像显示,比较于0μg/ mL PM2.5的对照细胞,用100μg/ mL PM2.5处理24小时的RAW264.7细胞会吞噬PM2.5颗粒形成囊泡,这一结果表明RAW264.7细胞可以吞噬PM2.5,并可能产生相应的生物学效应。
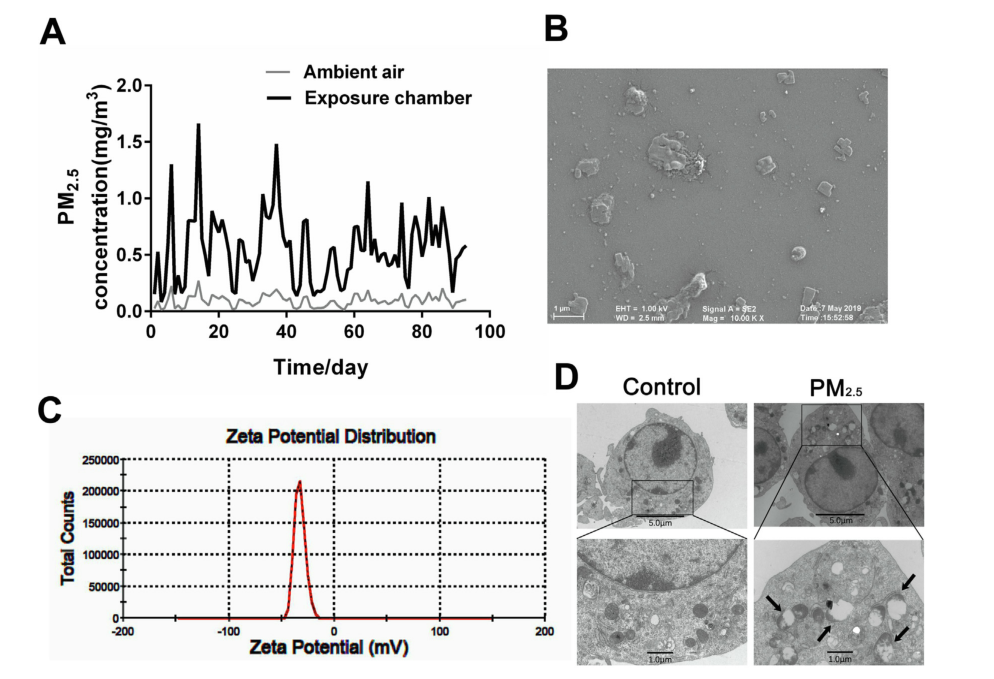
图2 PM2.5的浓度和表征
2、PM2.5暴露诱导体内外炎症,并加重COPD小鼠的肺损伤
作者将正常小鼠和COPD模型小鼠分别暴露于PM2.5的空气中3个月,来确定COPD小鼠对PM2.5是否敏感。为探讨PM2.5是否会引起潜在的肺损伤,作者采用HE染色来检测FA组、PM2.5组、COPD+FA组和COPD+PM2.5组肺组织中的炎性损伤,FA组为过滤空气(无PM2.5)处理的对照组。结果显示,在PM2.5暴露过程中,肺泡壁增厚,中性粒细胞广泛浸润,血管周围出现大量炎性细胞灶。COPD模型小鼠在暴露PM2.5空气中3个月后肺组织炎症程度加重。RT-PCR分析表明,与FA组小鼠相比,正常小鼠和COPD模型小鼠在PM2.5暴露后IL-1β、IL-18和TNF-ɑ的mRNA水平均升高。ELISA分析显示,在小鼠支气管肺泡灌洗液中,PM2.5暴露后IL-1β和IL-18的表达水平增加,且COPD小鼠对PM2.5诱导的炎症更敏感。
体外实验结果显示,IL-1β、IL-18和TNF-ɑ在PM2.5处理的RAW 264.7细胞中表达明显增加,48h后其上调更为显著,分别增加了3.14±0.35倍、2.51±0.27倍和1.94±0.4 1倍,这表明长时间暴露于PM2.5中可能会导致细胞炎症加剧。综上所述,PM2.5暴露可引起体内和体外的炎症反应,并加重COPD模型小鼠的肺部炎性损伤。
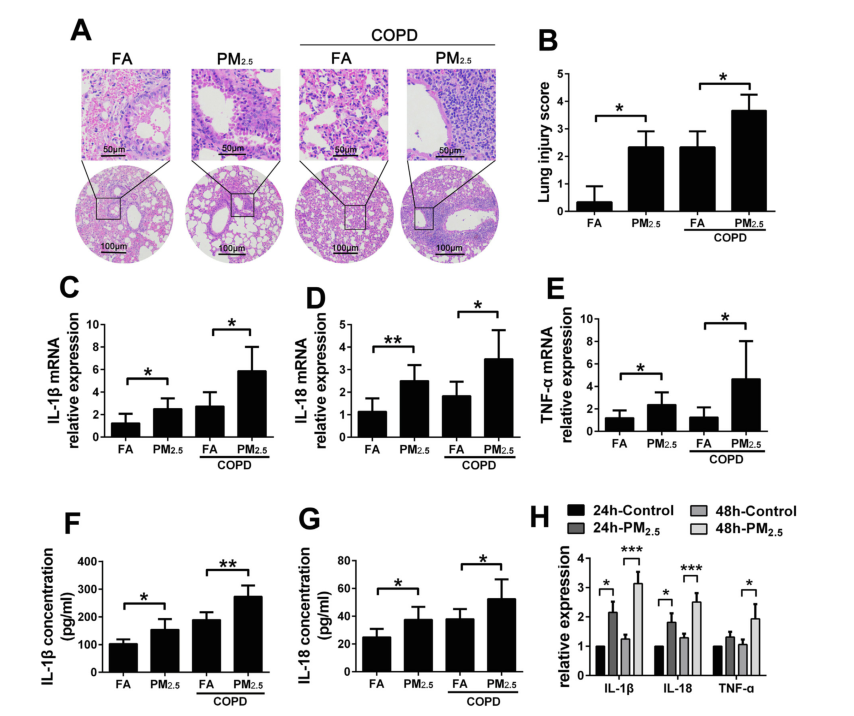
图3 PM2.5暴露诱导体内外炎症,并加重COPD小鼠肺损伤
3、PM2.5通过NLRP3炎症小体激活来诱导炎症
作为激活IL-1β和IL-18的途径之一,NLRP3炎症小体在化学诱导的炎症过程中起着重要的调节作用。接下来,作者检测NLRP3炎症小体的表达水平,它可以激活IL-1β和IL-18促炎细胞因子的成熟。RT-PCR结果显示,暴露于PM2.5空气中3个月后,小鼠NLRP3 mRNA表达显著上调,且COPD模型小鼠的炎症加剧。在细胞水平上,100μg/mL的PM2.5可引起RAW264.7细胞内NLRP3 mRNA表达水平的升高,且48h的作用比24h更为明显。免疫组织化学方法检测小鼠肺组织中NLRP3蛋白的表达水平,显示PM2.5暴露组小鼠肺组织中NLRP3蛋白的染色强度为对照组的1.61倍以上。这些结果均显示PM2.5可促进NLRP3的表达。
cleaved-caspase-1,是caspase-1蛋白被切割生成的小分子,它可以被NLRP3炎症小体组装体激活,从而促进炎性因子成熟,所以cleaved-caspase-1在炎症小体功能中起着关键作用。因此,作者通过western blot检测PM2.5暴露后炎症小体相关基因的表达情况,来探索PM2.5诱导的炎症反应是否依赖于炎症小体,结果显示,PM2.5暴露后NLRP3炎症小体相关基因(包括NLRP3、cleaved-caspase-1、IL-1β和IL-18 )的蛋白表达水平升高,且炎症作用在COPD模型小鼠中更为明显。在体外,这些NLRP3炎症小体相关蛋白在经PM2.5处理24小时和48小时的RAW264.7细胞中也存在上调。因此,作者认为炎症反应是PM2.5通过调控NLRP3炎症小体途径所引起的。
基于PM2.5暴露后NLRP3和促炎细胞因子的表达趋势相同,有必要进一步研究NLRP3在PM2.5诱导的炎症反应中的作用。作者使用NLRP3 siRNA转染RAW264.7细胞,然后暴露于PM2.5中48h。qRT-PCR和western blot结果表明,敲低NLRP3不影响caspase-1的表达,但却降低了cleaved-caspase-1、炎症因子IL-18 和 IL-1β的表达。这些结果表明,PM2.5诱导的炎症反应和COPD的恶化过程可以通过激活NLRP3炎症小体而引起的。
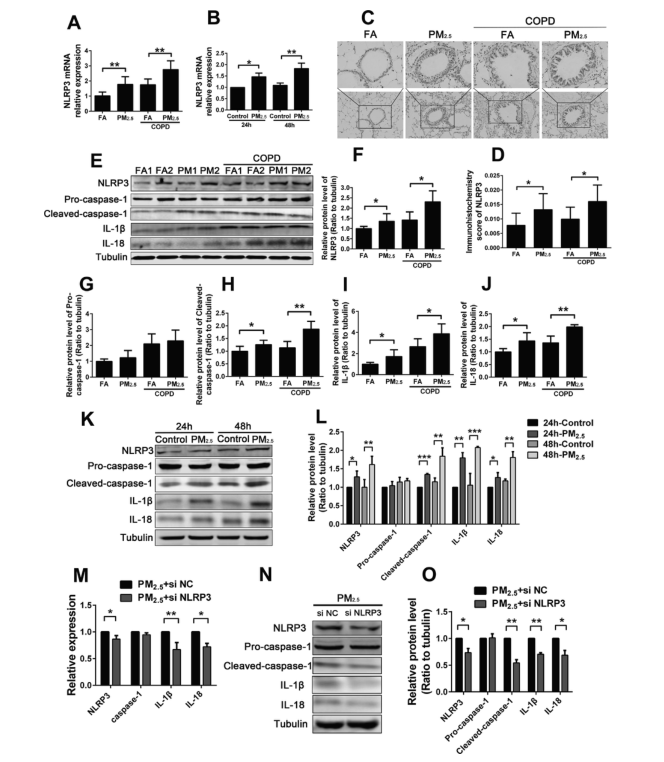
图4 NLRP3炎症小体途径参与PM2.5诱导的炎症反应
4、体内外PM2.5暴露后circBbs9的上调及其特性
为了鉴定正常和COPD模型小鼠中暴露于PM2.5后参与肺部炎症的circRNA,作者对FA组、PM2.5组、COPD+FA组和COPD+PM2.5组肺组织进行RNA-seq,选取差异倍数≥2的基因做后续研究。PM2.5暴露后,正常小鼠肺组织中有6,718种circRNA表达上调,COPD模型小鼠肺组织中有3,543种circRNA表达上调。用热图和散点图描述正常组和COPD组经PM2.5处理的小鼠肺组织中差异表达的circRNA。作者选择了PM2.5刺激后上调及其与NLRP3炎症小体途径相关的circRNA,circBbs9,做进一步分析。与FA组相比,PM2.5组的正常及COPD模型小鼠血液中circBbs9的表达也显著增加。由于circBbs9在PM2.5暴露后的COPD模型小鼠肺组织和血液中表达均上调,提示circBbs9可能涉及PM2.5诱导的COPD加重。同样在体外,PM2.5暴露24小时和48小时可诱导RAW264.7细胞circBbs9的表达上调。
随后的分析表明,circBbs9位于chr9:22692024–22692440上,由外显子1和2的反向剪接生成,其剪接位点已被Sanger测序验证。凝胶电泳检测circBbs9的PCR扩增产物表明,发散引物可从cDNA而非gDNA中扩增circBbs9。随后,作者通过仅仅使用寡聚DT引物或随机引物合成cDNA的qRT-PCR来进一步证实上述结果。寡聚DT引物可将含poly A尾的mRNA(如β-actin和Bbs9 mRNA)逆转录为cDNA,但不能将circBbs9逆转录为cDNA。使用RNase R测定circBbs9的稳定性,结果表明circBbs9具有RNase R抗性。这些实验证实了circBbs9为环状非编码RNA。随后,作者使用PARIS试剂盒和FISH检测circBbs9在RAW264.7细胞中的定位,在胞核和胞质中均检测到了circBbs9,相对来说,它主要定位于胞质。此外,还观察到PM2.5处理后circBbs9的上调。
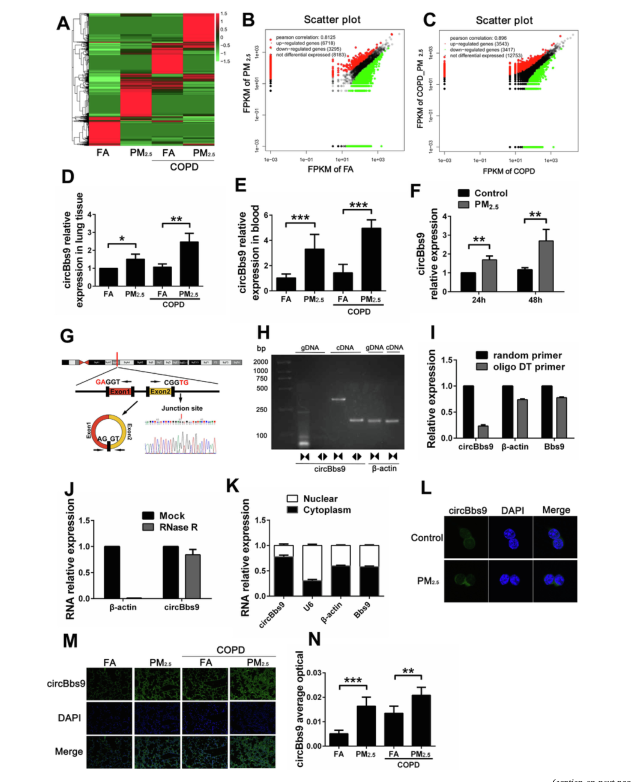
图5 体内外PM2.5暴露后circBbs9的上调及其特性
5、circBbs9促进PM2.5暴露引起的NLRP3激活和炎症反应
将circBbs9干扰序列转染到暴露于PM2.5的RAW264.7细胞内,观察circBbs9是否促进炎性细胞因子的应答和NLRP3的激活。作者设计了三个靶向circBbs9剪接区域的siRNA,通过RT-qPCR验证敲低效率,其中circ si 1和circ si 2的敲低效率分别为45%和42%,则选择他们作为circBbs9的干扰序列作做一步研究。免疫荧光法检测转染circBbs9干扰序列的RAW264.7细胞在PM2.5暴露48小时后NLRP3的表达水平,结果发现,circBbs9干扰可减轻PM2.5引起的NLRP3炎症小体水平升高。此外,RT-PCR和western blot分析显示,使用siRNA敲低circBbs9可减轻PM2.5暴露48小时引起的NLRP3炎症小体、IL-1β和IL-18的表达上调。随后,作者使用circBbs9过表达质粒转染RAW264.7细胞,导致circBbs9的水平增加约10倍,且PM2.5暴露48小时后的RAW264.7细胞中NLRP3、IL-1β和IL-18的表达升高。这些结果表明,circBbs9可促进NLRP3的活化和炎性细胞因子的成熟。
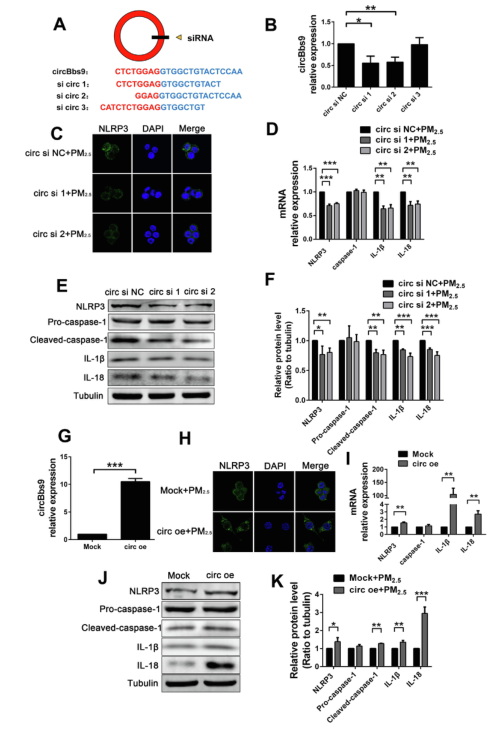
图6 circBbs9促进PM2.5暴露引起的NLRP3激活和细胞因子上调
6、circBbs9通过结合miR-30e-5p来减轻其对Adar的抑制作用
作者接下来研究circBbs9是否通过与miRNA结合来发挥生物学作用。作者通过生物信息学网站TargetScan、Miranda和Mireap预测了22个可能与circBbs9结合的miRNA。其中,miR-30e-5p有被报道,可以通过巨噬细胞调节炎症。因此,作者推测miR-30e-5p可能也参与circBbs9的分子机制。在小鼠的肺组织和血液中,发现miR-30e-5p与circBbs9的表达呈负相关。此外,FISH证实了miR-30e-5p和circBbs9在胞质的共定位。双萤光素酶报告基因检测验证了circBbs9可以与miR-30e-5p直接相互作用。这些实验结果表明,circBbs9可以作为内源性miR-30e-5p海绵,参与调节细胞功能。
接下来,使用MiRTarBase预测出5个miR-30e-5p的下游靶基因,包括Akt3、Dnajc3、 Adar、Gnai2、和Ifngr1。根据ceRNA理论,其表达水平应受miRNA负调控和circRNA正调控。作者将miR-30e-5p抑制剂/模拟物和circBbs9敲低/过表达载体分别转染至RAW264.7细胞,并评估了五个候选下游靶基因的mRNA表达水平。结果显示,仅仅只有Adar表达受miR-30e-5p和circBbs9所调控,miR-30e-5p负向调节其表达,而circBbs9正向调节其表达。此外,miR-30e-5p模拟物和circBbs9 siRNA共转染可以放大二者单独转染对Adar表达的抑制。在暴露于PM2.5 48小时后的RAW264.7细胞中,Adar mRNA水平升高,可通过共转染miR-30e-5p模拟物和circBbs9 siRNA而降低,且在过表达circBbs9上调Adar的基础上,转染miR-30e-5p模拟物会部分消除这种促进作用。这些结果表明,Adar,作为miRNA下游靶基因,参与了circBbs9的生物学过程。
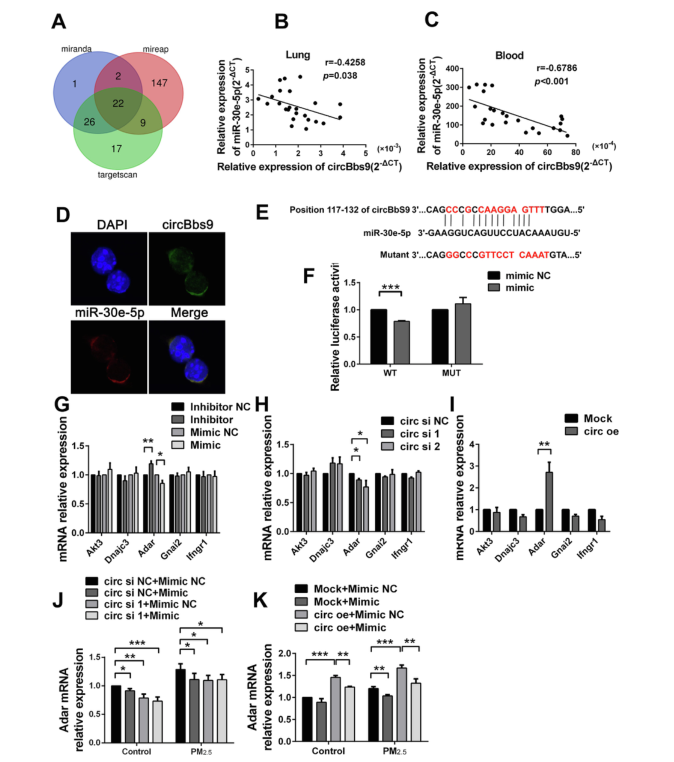
图7 circBbs9充当内源性miR-30e-5p海绵以减轻其对Adar的抑制作用
7、circBbs9通过miR-30e-5p调节PM2.5诱导的炎症
为了研究circBbs9-miR-30e-5p-Adar轴是否影响NLRP3炎症小体相关基因的表达,使用circBbs9 siRNA /过表达载体和miR-30e-5p模拟物转染RAW264.7细胞,在对照组和经PM2.5处理48小时后的RAW264.7细胞中检测NLRP3炎症小体相关基因的表达。结果显示,转染miR-30e-5p模拟物或circBbs9 siRNA后,NLRP3炎症小体相关基因NLRP3、IL-1β和IL-18的表达下降,这种下降在共转染miR-30e-5p模拟物和circBbs9 siRNA的RAW264.7细胞中被放大。在暴露于PM2.5 48小时后的RAW264.7细胞中,NLRP3炎症小体和炎性细胞因子IL-1β和IL-18的表达升高,且可被共转染miR-30e-5p模拟物和circBbs9 siRNA而抑制。另外,在暴露于PM2.5的RAW264.7细胞中,转染miR-30e-5p模拟物可以挽救过表达circBbs9对NLRP3炎症小体和炎性细胞因子的上调。这些结果表明,circBbs9可以调节PM2.5诱导的NLRP3炎症小体激活和miR-30e-5p的炎症反应。
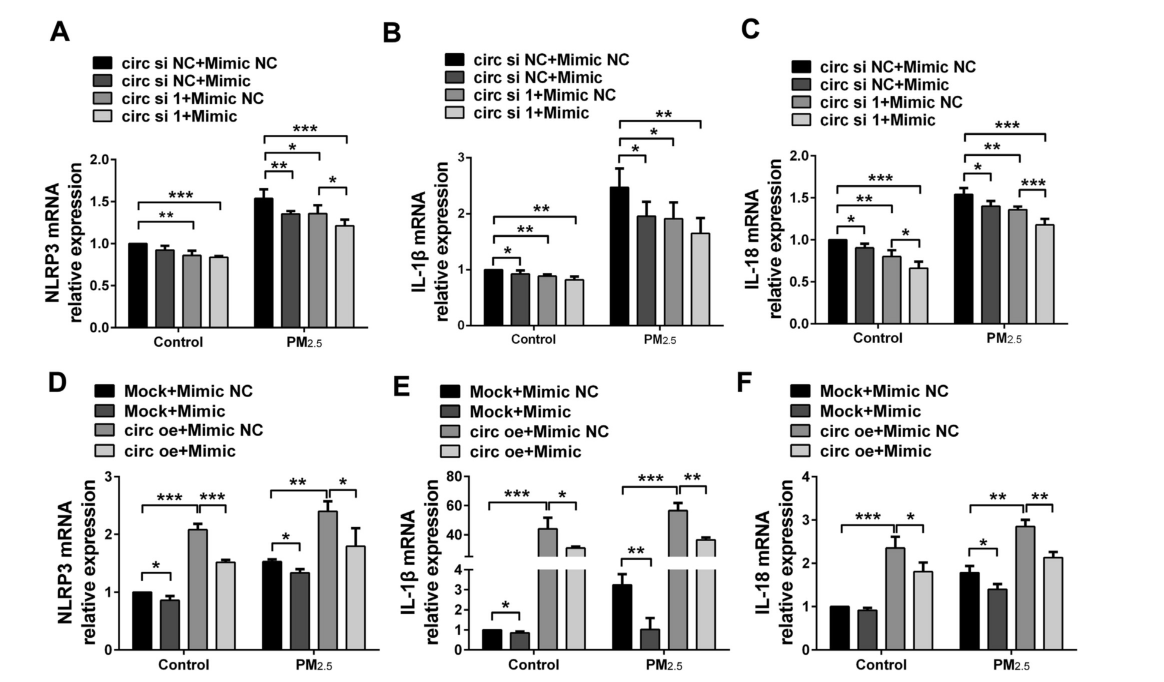
图8 circBbs9通过miR-30e-5p调节PM2.5诱导的炎症
参考文献:[1] Li M, Hua Q, Shao Y, et al. Circular RNA circBbs9 promotes PM2.5-induced lung inflammation in mice via NLRP3 inflammasome activation [published online ahead of print, 2020 Jul 21]. Environ Int. 2020;143:105976. doi:10.1016/j.envint.2020.105976
.png)