图片摘要:糖尿病视网膜病变(DR)中环状RNA cZNF532表达和致病机制研究。文中用到了Cre介导条件性敲低cZNF532的模型,值得一读。
4月28日,著名杂志The Journal of Clinical Investigation(IF=12.282)在线发表了一项circRNA的研究工作,报道糖尿病视网膜病变中环状RNA cZNF532高表达,与视网膜血管周细胞退化有关。cZNF532可以通过竞争性结合miR-29a-3p,促进NG2,LOXL2和CDK2的表达。文中用到了基于Cre杂交的条件性敲降cZNF532的模型,值得circRNA功能研究中学习应用([1])。南京医科大学附属眼科医院蒋沁,复旦大学附属眼耳鼻喉医院颜标,赵晨为本文的共同通讯作者。

糖尿病视网膜病变血管周细胞特异性高表达cZNF532
为筛选高糖诱导的高表达的circRNA分子,作者在人视网膜周细胞通过高通刺激后芯片分析差异表达circRNA分子,其中发现了来自ZNF532的一个circRNA,circ_0047814 (circBase ID:hsa_circ_0047814;circBank ID:hsa_circZNF532_007)。通过Sanger测序证明了Junction位点的序列,RNase R处理证明是环形分子。分离胞质和核组分结果显示cZNF532主要定位于胞质中。小鼠糖尿病模型不同时间段的视网膜血管细胞QPCR检测表明cZNF532在糖尿病模型中显著高表达。血管周细胞中高糖,氧化压力(H2O2处理)或炎症刺激(VEGF,IL-6,TNF-α处理)均可显著促进cZNF532的表达。人视网膜血管内皮细胞(HRVECs)中对应的变化不明显。说明高糖刺激后cZNF532会在视网膜血管周细胞中特异性的表达增高。
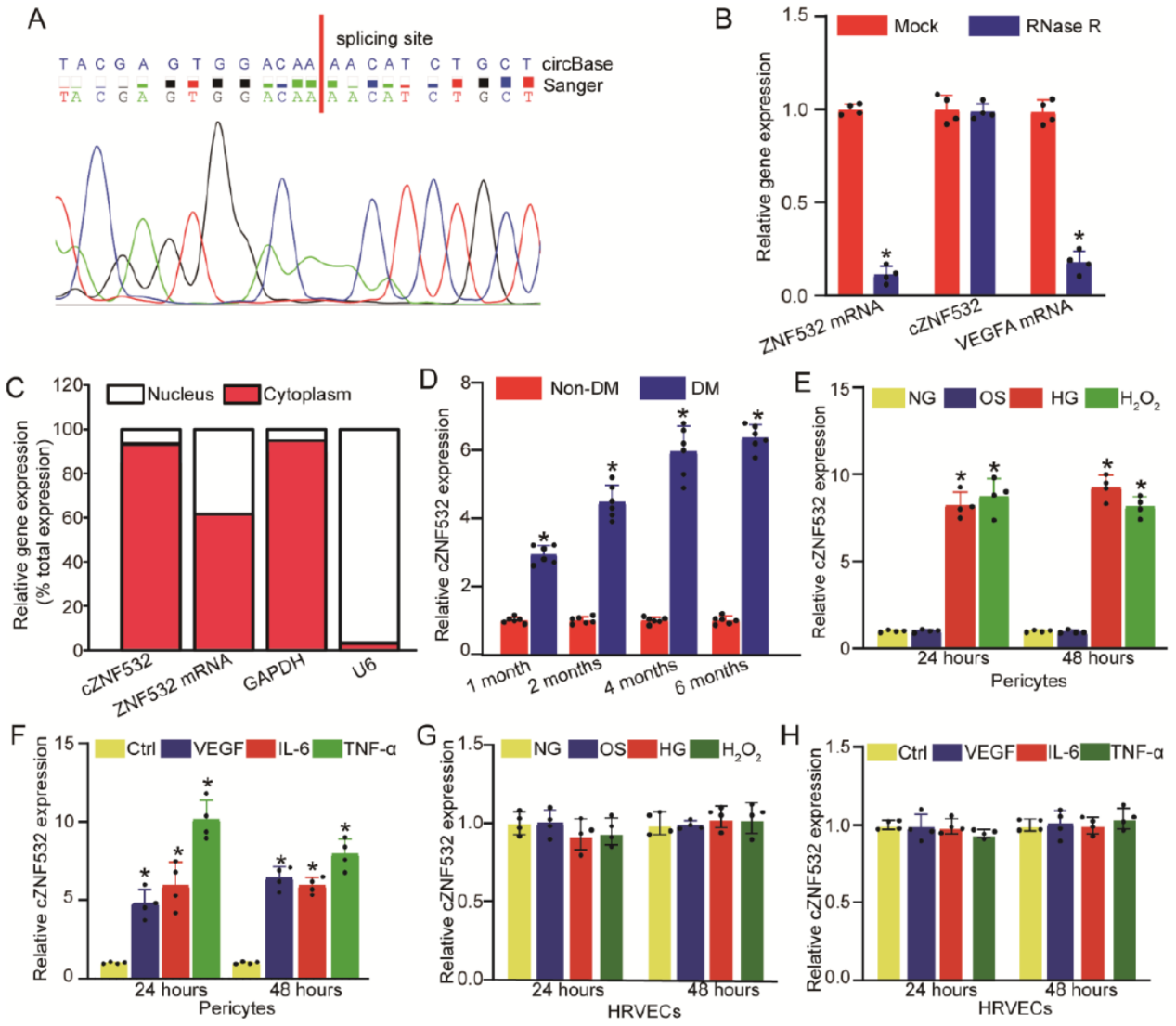
图1 高糖等诱导血管周细胞特异性高表达cZNF532 ([1])
cZNF532在视网膜血管周细胞中功能研究
cZNF532特异性的siRNA能够有效敲降cZNF532,但对母基因ZNF532没有影响。血管周细胞中干扰cZNF532可显著降低周细胞标志物的表达,如(PDGFR)-β,α-SMA,Desmin以及NG2。Matrigel共培养实验表明干扰 cZNF532显著降低血管周细胞向HRVECs聚集的能力,并且增加周细胞对大分子的通透性。MTT分析表明干扰cZNF532可抑制血管周细胞的增殖能力,诱导G0/G1期阻滞,促进血管周细胞的凋亡。
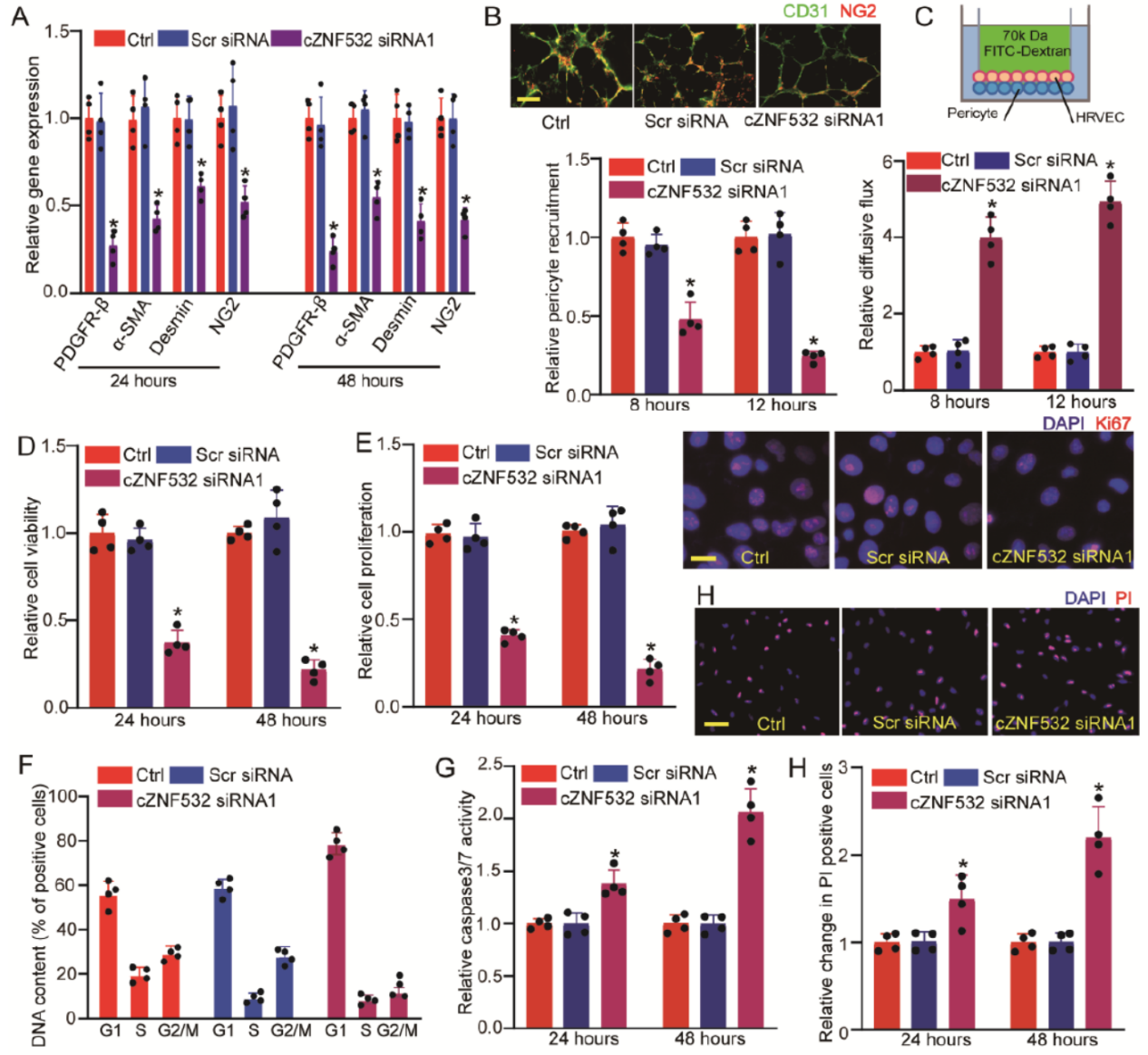
图2 cZNF532调控视网膜血管周细胞增殖 ([1])
体内cZNF532调节视网膜周细胞功能和血管完整性
糖尿病模型中通过玻璃体注射cZNF532的shRNA载体能够显著抑制cZNF532的表达,IB4和NG2染色可检测视网膜血管周细胞覆盖的程度。结果表明在第一个月的时间点,单独的糖尿病模型组和单独干扰cZNF532组没有显著的周细胞覆盖度变化,但糖尿病组联合干扰cZNF532能显著降低血管周细胞的覆盖度。第二至第六个月,单独的糖尿病模型组和单独干扰cZNF532组没有也呈现出周细胞覆盖度的显著变化,两者组合后血管覆盖度差异更明显。Evans blue染色检测视网膜通透性,结果表明干扰cZNF532可显著增加血管的通透性。
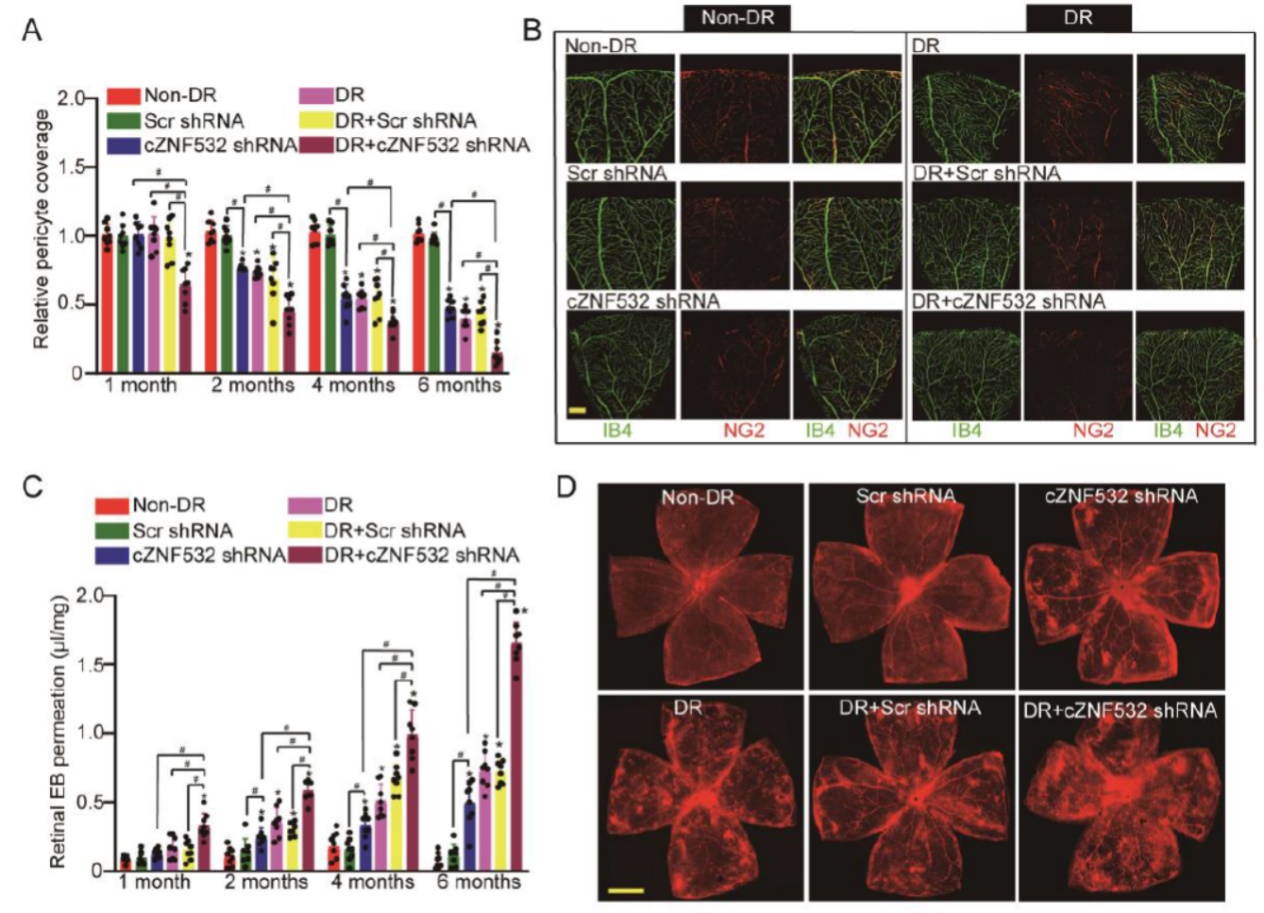
图3 体内cZNF532调控视网膜血管周细胞覆盖度和血管完整性 ([1])
血管周细胞条件性敲降cZNF532
Cre条件敲除模型为体内细胞特异性的功能研究提供了强大的工具,在传统mRNA基因的功能研究中扮演着非常关键的作用。circRNA目前还没有成熟的敲除体系,尤其是考虑到不影响母基因的表达,circRNA的敲除还不是非常成熟,但基于shRNA的敲降是可行的。为此,作者设计了Cre条件诱导表达shRNA的AAV载体,通过注射AAV载体到Cre模型小鼠中实现条件性敲降circRNA的动物模型。
作者用的Cre小鼠是PDGFR-β-cre小鼠,该小鼠的Cre酶仅在PDGFR-β基因阳性的细胞和组织中表达,例如血管周细胞等等。用该基因的启动子构建的Cre小鼠也可以实现在这些类型的细胞中特异性表达Cre酶。结果显示在该模型中,可以特异性对血管周细胞的cZNF532实现条件性敲降,而血管内皮细胞中没有发生变化。在这种条件性敲降cZNF532模型中分析血管周细胞覆盖度和血管完整性,结果表明血管周细胞中敲降cANF532可以显著降低血管周细胞覆盖度和血管完整性。
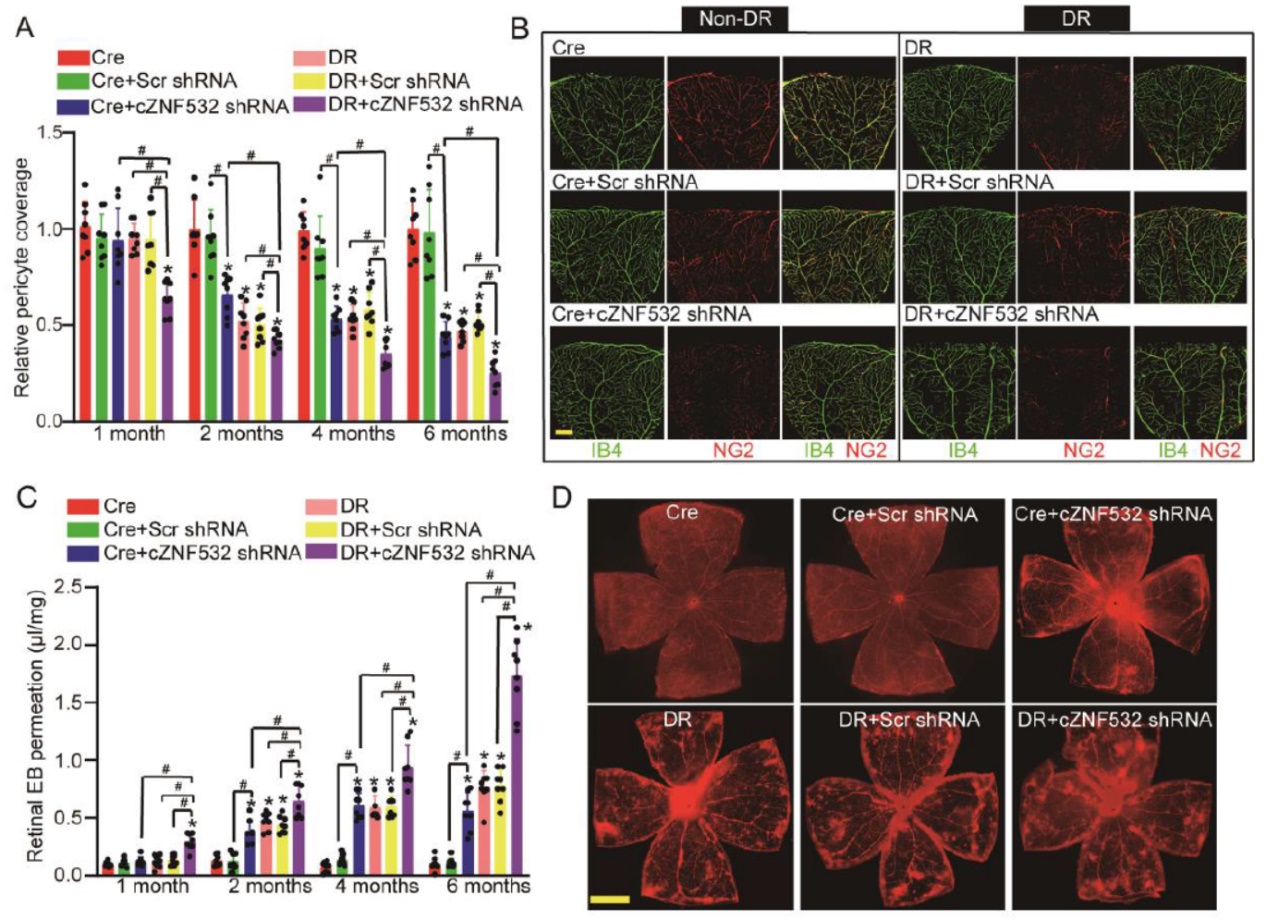
图4 血管周细胞条件性敲降cZNF532 ([1])
cZNF532 竞争性结合miR-29a-3p
基于荧光素酶报告基因筛选,作者发现miR-29a-3p是cZNF532竞争性结合的下游miRNA分子。基于突变分析,QPCR表达检测,共定位分析,荧光素酶报告基因分析等实验验证了这一竞争性结合的作用关系。进一步作者验证了CSPG4,LOXL2和 CDK2是miR-29a-3p的下游靶基因。
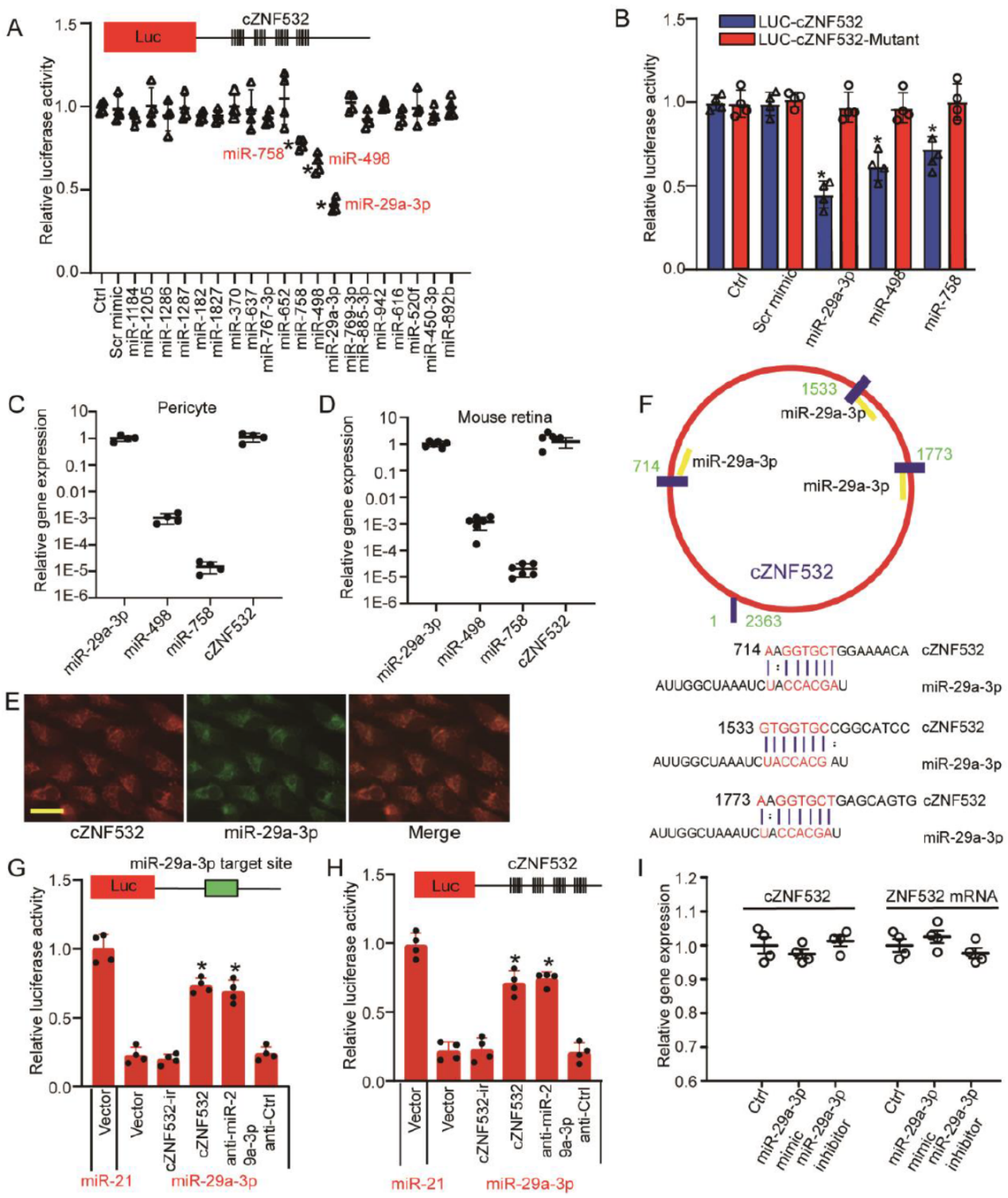
图5 cZNF532竞争性结合miR-29a-3p ([1])
cZNF532 竞争性结合miR-29a-3p的体内作用机制
为证明cZNF532-miR-29a-3p-NG2/LOXL2/CDK2通路在糖尿病视网膜病变模型中与视网膜周细胞功能和血管完整性的关系。玻璃体内注射miR-29a-3p agomir或空载体和对照。结果表明注射miR-29a-3p agomir可显著降低血管周细胞的覆盖度和血管完整性,证明了这一通路在体内也是存在的。
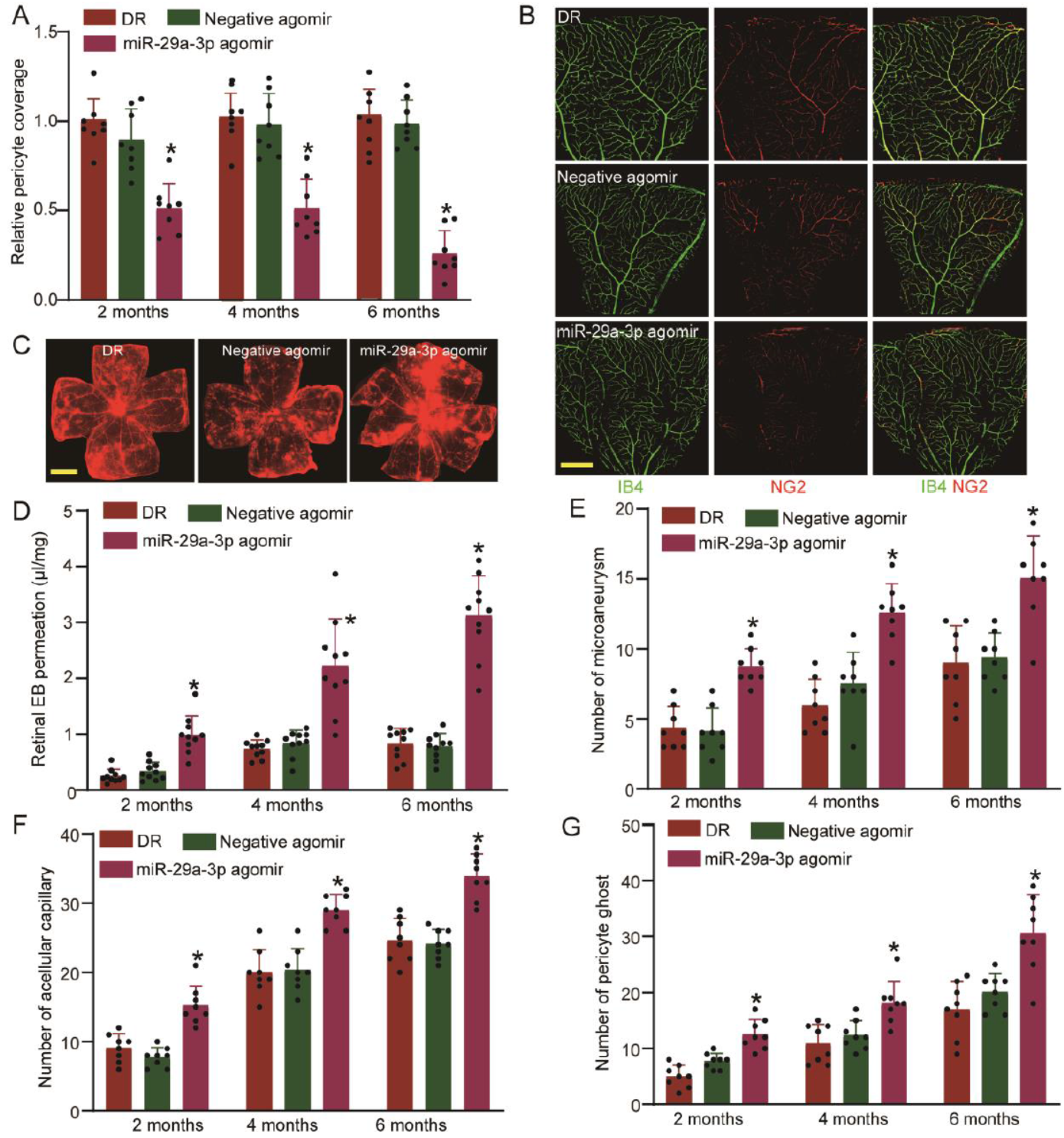
图6 体内验证cZNF532-miR-29a-3p-NG2/LOXL2/CDK2通路 ([1])
临床标本验证cZNF532-miR-29a-3p-NG2/LOXL2/CDK2通路
最后,作者在临床标本中检测了cZNF532和miR-29a-3p的表达,Caspase-3/7活性,细胞凋亡水平,血管通透性及周细胞覆盖度的关系。结果显示,该通路与视网膜血管功能障碍中有一定的关系。
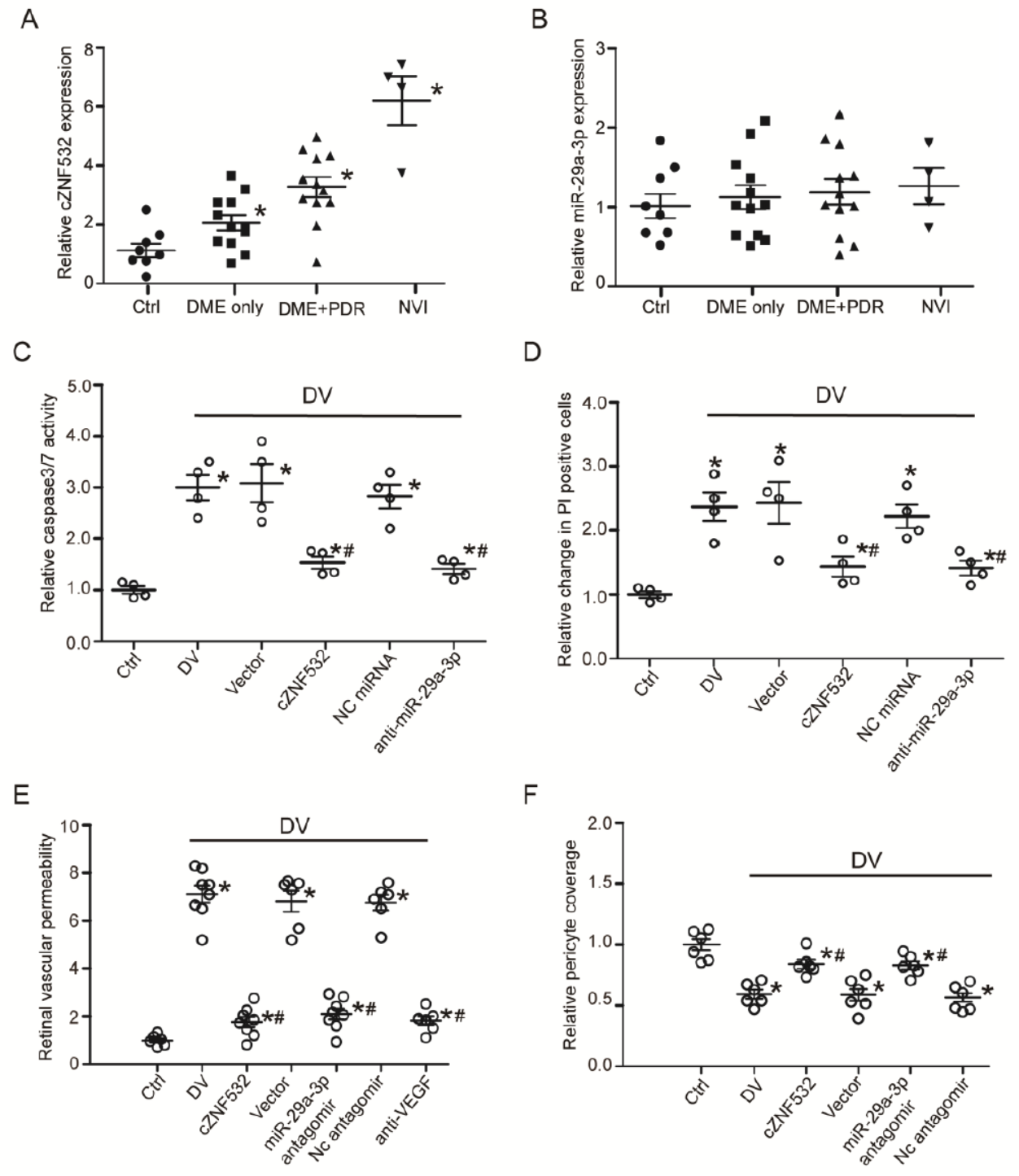
图7 临床标本验证cZNF532-miR-29a-3p-NG2/LOXL2/CDK2通路 ([1])
cZNF532作用机制模型
本文发现糖尿病视网膜病变中cZNF532高表达,cZNF532可以通过竞争性结合miR-29a-3p,调控了NG2/LOXL2/CDK2等基因的表达,最终影响了视网膜周细胞覆盖度和血管通透性,在糖尿病视网膜病变过程中发挥作用。
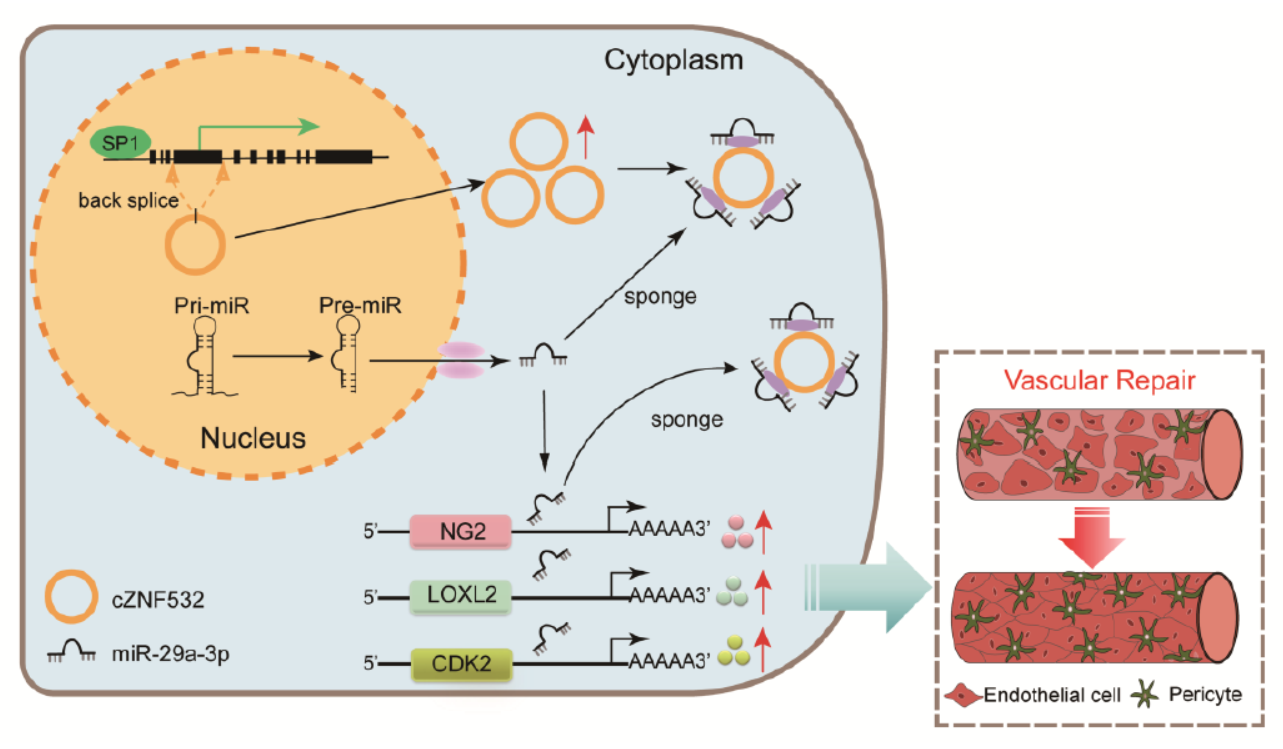
图8 cZNF532作用机制模型 ([1])
参考文献
1. Jiang, Q., et al., Circular RNA-ZNF532 regulates diabetes-induced retinal pericyte degeneration and vascular dysfunction. J Clin Invest, 2020.
.png)