
mRNA在生物系统中具有广泛的应用潜能,但由于其具有相对短的半衰期,使其无法稳定、持续和高效地表达蛋白。最近来自麻省理工学院(MIT)的Daniel G. Anderson等研究者在Nature Communications杂志发表了题为“Engineering circular RNA for potent and stable translation in eukaryotic cells”的研究论文。该研究开发了一种外源性环状RNA,通过合理设计普适的辅助序列辅助剪接,在体外改造一种自我剪接的内含子(PIE),可以有效地环化长达5kb的RNAs,延长了全长mRNA的蛋白表达的持续时间。经过HPLC纯化后的工程化circRNA可以翻译出质量高、数量多和稳定性高的蛋白质。该研究开创了在真核细胞中利用外源性circRNA表达正常和稳定蛋白的先河,也充分证明了circRNA很有可能是线性mRNA的理想替代物。
已有大量研究发现,真核细胞内源性的circRNA具有许多生物学功能,大多数circRNAs
是通过backsplicing机制产生的,实现非编码的功能。但是有些果蝇和人内源性的circRNA
具有编码蛋白质的功能。另外,相比于线性mRNA内源性circRNAs缺乏核酸外切酶介导降解的游离末端,可以抵抗RNA酶降解,延长其寿命。正因为这个特点,环化可以提高具有短半衰期的mRNAs的稳定性,改善外源性mRNA在不同用途中的整体效率。利用天然β球蛋白mRNA的非翻译区域,利用甲基鸟苷帽类似物保护mRNA免受脱盖酶,利用核苷修饰和密码子优化,可以适度增加mRNA的稳定性。而且RNA环化也是一种提高RNA稳定性的方法。但是如何在体外实现长RNA有效地环化,如何纯化circRNA,如何调控circRNA表达蛋白质,都是需要在circRNA实现蛋白编码之前解决的问题。
1. 采用同源互补序列来辅助长RNA的环化
目前有三种方法可以环化外源性RNA:利用溴化氰的化学方法、利用DNA/RNA酶的酶催化法和利用自我剪接内含子的核酶催化法。该研究采用的是第三种方法,利用的是一种置换的I型催化内含子(PIE),更加适合长RNA的环化,只需要额外添加GTP和Mg2+作为辅助因子。来自T4噬菌体Td基因的I型催化内含子中间切开,以保留对于核酶折叠非常关键的结构元件,接着外显子片段2与上游的外显子片段1连接,外显子之间可插入编码序列。然后precursor经过两次转酯反应,鸟苷酸的3’ 端羟基团在5’ 端剪接位点经历第一次转酯反应,导致5’ 端一半内含子被剪切,中间产物末端游离的羟基团在3’ 端剪接位点经历第二次转酯反应,3’ 端内含子被剪切,最后中间序列成环(a)。由于插入的编码序列长度是原序列长度的2-4倍大小,所以作者在precursor RNA的5’和3’端插入9nt(weak)或者19nt(strong)d的同源互补臂,以促进5’和3’端相互靠近(b)。长为9nt的同源互补臂将原来0%的剪接效率提高到16%,而长为19nt的同源互补臂将原来0%的剪接效率提高到48%(c)。RNase R可以消化掉非环状RNA,以保留环状RNA;而靶向寡合核苷酸的RNase H处理可以将环状RNA和precursor RNA一分为二。RNase R和RNase H消化处理检测circRNA的生成情况(d),sanger测序也对RNase R处理pre-RNA后得到的circRNA进行验证(e)。以上结果提示剪接反应得到的产物主要是circRNA,而且琼脂糖凝胶电泳可以简单有效地从线性pre-RNA、剪开的环状物、剪接中间产物、切掉的内含子中分离circRNA。
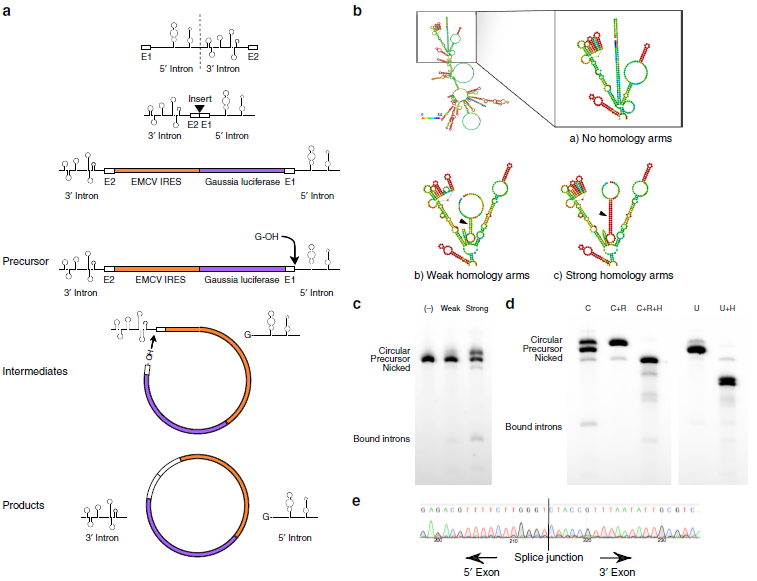
2. 在pre-RNA中插入间隔序列可增加环化效率?
为了进一步提高环化效率,作者对影响RNA环化的因素进行探讨。作者猜想3’端PIE剪接位点非常靠近IRES,因为序列是高度结构化的,IRES形成的二级结构会干扰到剪接核酶的折叠。为了让这些结构独立折叠而不受影响的发挥功能,设计一些允许或者干扰剪接的间隔序列插入在3’端PIE剪接位点和IRES之间,检测其对剪接效率的影响(a)。在内含子中插入允许剪接的间隔序列(P1和P2)将原来46%的剪接效率提高到87%,而在内含子中插入干扰剪接的间隔序列无法生成circRNA(b)。利用同源互补臂和合理设计的允许剪接的间隔序列改善pre-RNA后,可以促进高达5kb的RNA序列环化。
换一种I型催化内含子是否会提高环化效率?作者采用鱼腥藻pre-tRNA来源的I型催化内含子,Anabaena 1.0是缺乏内部同源互补臂,形成的二级结构图;Anabaena 2.0含有设计好的同源互补臂,形成的二级结构图(c)。琼脂糖凝胶电泳验证引入同源互补臂有助于减pre-RNA,提高剪接效率从84到95%(d);与T4噬菌体Td基因的I型催化内含子相比,Anabaena 2.0剪接效率更高,nicked circle更少(e)。
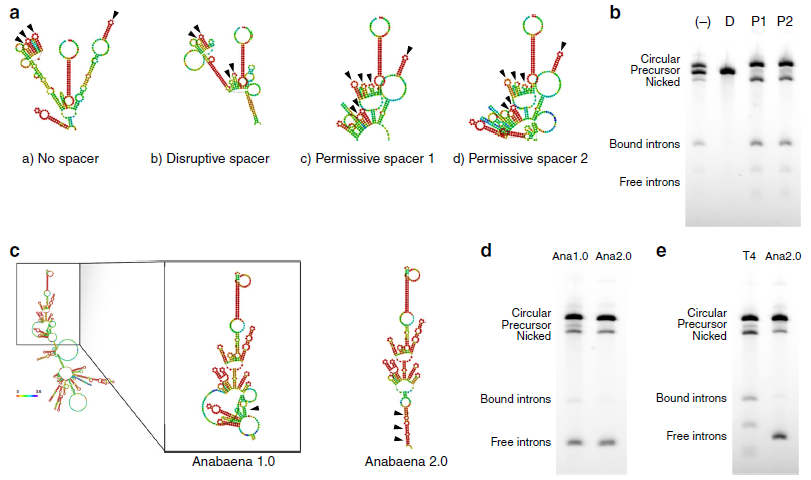
3. 为实现胞内蛋白有效翻译,需确保催化自我剪接的天然序列与插入的编码序列是否兼容
替换另一种I型催化内含子或者插入不同的编码序列,就需要重新设计不同的间隔序列,才能不影响pre-RNA二级结构中各种序列的空间位阻和功能,以适应不同长中间编码RNA序列的高效环化效率。需要进行改造的pre-RNA的元件示意图(a)。琼脂糖凝胶电泳验证,经过优化元件和设计间隔序列后的pre-RNA可以插入1313nt—4934nt大小的5种蛋白编码序列,进过RNase R处理验证后条带增强,但是得到的circRNA的总产量、纯度与插入序列长度成反比(b,c);
构建好的circRNA体外有效表达验证: 同时将RNase R处理后得到的circRNA转入细胞24h后验证其蛋白翻译情况,含有Gaussia、Firefly 荧光素酶或者EPO序列的circRNA在HEK293细胞中表达后,检测细胞上清中荧光表达明显增强(d, f)和EPO的表达也增多(e),confocal显微成像也证明了EGFP circRNA在胞内的表达情况(g)。同时流式检测发现,这个系统中引入Cas9 circRNA和sgRNA也可以实现靶向敲除GFP蛋白(效率高达97%)的效果(h)。
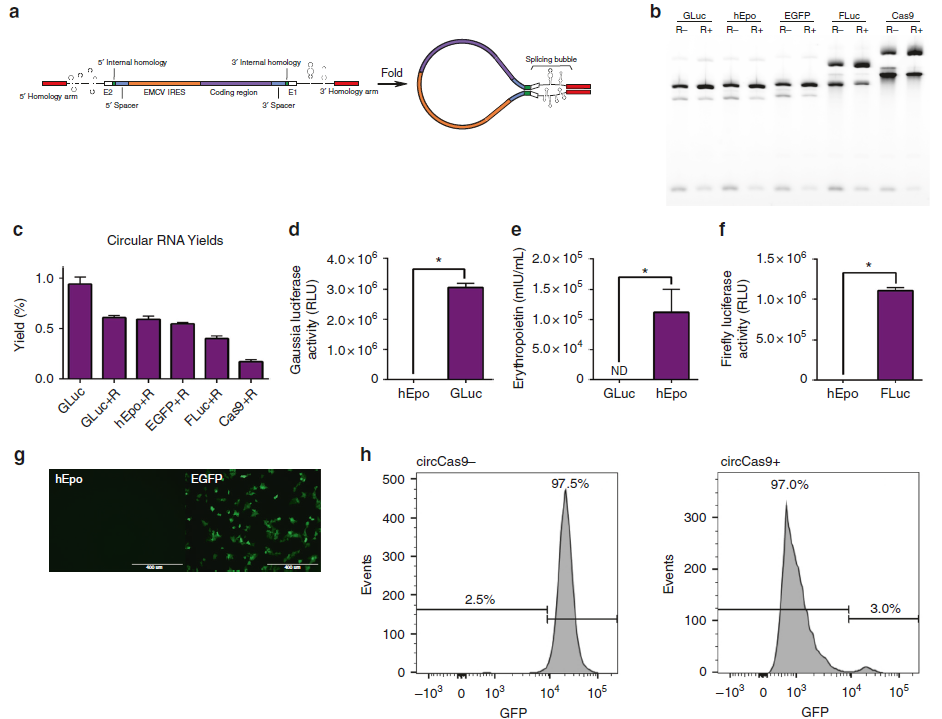
4. 替换不同的IRES序列和添加polyA尾是否可以提高circRNA的蛋白表替达效率?
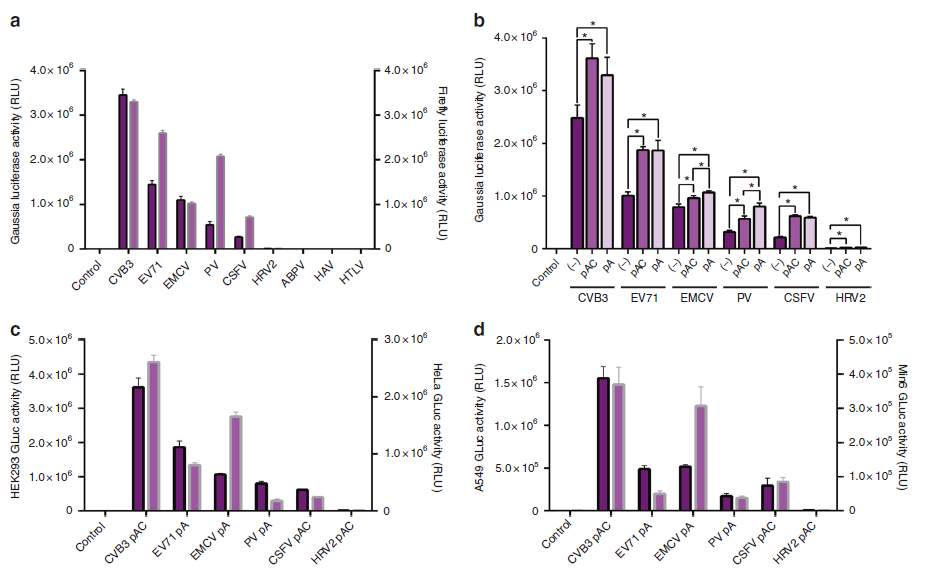
mRNA前体通过添加5′ Cap和3′ polyA尾提高线性mRNA的稳定性和翻译引发效率,为进一步提高circRNA的蛋白表达效率,作者将之前的EMCV IRES替换为不同病毒转录本的5′ UTR 序列或者在IRES中添加polyA或者polyAC间隔序列,并检测circRNA荧光蛋白的表达效率。柯萨奇病毒B3(CVB3)来源的IRES促进Gaussia luciferase 或者Firefly luciferase circRNA的蛋白表达效率最高,而且比EMCV IRES的高1.5倍。另外脊髓灰质炎病毒PV来源的IRES促进Gaussia luciferase 或者Firefly luciferase circRNA蛋白表达效率的差异最大(a)。在IRES序列和外显子—外显子连接点之间插入的polyA和polyAC都可以明显提高Gaussia luciferase circRNA的蛋白表达效率,但每种病毒来源的IRES中插入的poly序列不一样,circRNA的蛋白表达效率也不一样(b)。根据(b)结果选择促进表达效率高的polyA或polyAC序列,在不同类型细胞(HEK293、Hela、A549、Min6)中验证了同种病毒来源的IRES序列促进circRNA的蛋白表达效率不一样,但是CVB3来源的IRES促进circRNA的蛋白表达效率都是最高(c,d)。
5. 如何从剪接反应产物中纯化circRNA?
为促进circRNA的蛋白翻译的最大化和避免固有细胞免疫反应,纯化circRNA是非常有必要的。因为IVT和剪接反应过程的副产物中含有dsRNA、三磷酸RNA、nicked、precursor和introns等。虽然无法获得100%纯度的circRNA,但是可以利用小量和体积排阻的HPLC纯化大量的剪接反应产物,获得90%纯度的circRNA,对滤过的不同成分可以通过琼脂糖凝胶电泳分离纯化鉴定(a,b)。相比于单用RNAse R处理、琼脂糖凝胶电泳分离后RNAse R处理,HPLC分离后RNAse R处理可以减少introns,提高circRNA纯度(b)。而且HPLC分离后RNAse R处理CVB3-GLuc-pAC剪接反应产物得到的circRNA在HEK293细胞中的蛋白表达效率最高(c)。这表明HPLC分离纯化后RNAse R处理可以获得高纯度的circRNA,其蛋白表达效率也得到提高。
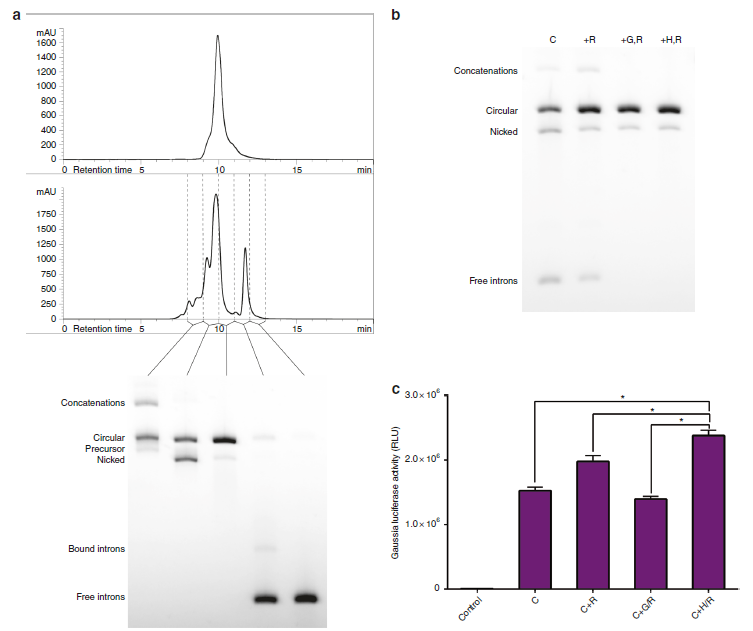
6. 与线性mRNA相比,外源性circRNA的蛋白翻译效率如何?
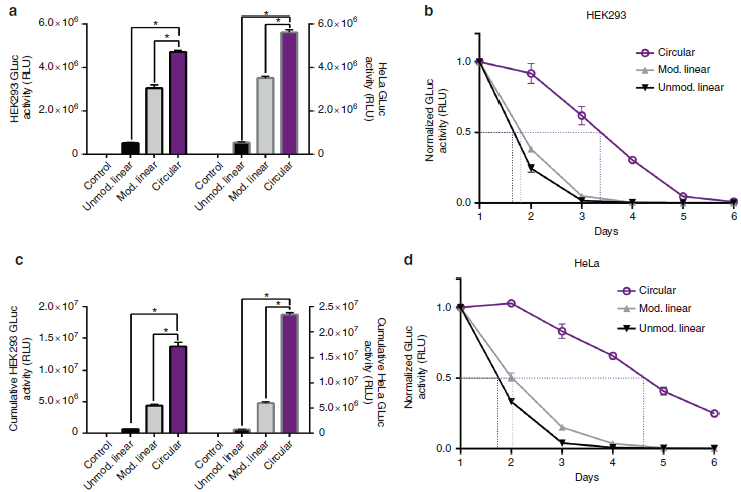
为突出HPLC纯化后的工程化circRNA的蛋白翻译效率高的优势,作者比较其与经典非修饰的GLuc circRNA、商业化的已被修饰的线性GLuc mRNA的蛋白翻译效率。在HEK293和Hela细胞中转染HPLC纯化后的工程化CVB3-GLuc-pAC circRNA 24h后,其蛋白表达效率最高(a),随后circRNA表达观察6天后,发现HPLC纯化后的工程化CVB3-GLuc-pAC circRNA表达的蛋白在HEK293细胞的半衰期最高,高达80h,另外两种线性mRNA表达的蛋白半衰期分别为43h和45h(b);而且HPLC纯化后的工程化CVB3-GLuc-pAC circRNA表达的蛋白在Hela细胞的半衰期也是最高,高达116h,另外两种线性mRNA表达的蛋白半衰期分别为44h和49h(d)。同时在三种RNA细胞内蛋白表达累积6天后的总量比较中,在两种细胞中HPLC纯化后的工程化CVB3-GLuc-pAC circRNA表达的蛋白总量也是最高的(c)。这些结果表明HPLC纯化后的工程化circRNA具有纯度高,蛋白表达效率高,半衰期长,蛋白表达总量高,优于非修饰和商业化经过修饰的mRNA的特点。
总结:作者为了可以在precursor-RNA中插入不同长度的编码序列并促进环化,改造了precursor-RNA上的原件,如替换IRES、替换I型催化内含子、插入设计的同源互补序列、插入设计的间隔序列等,或者验证不同方法纯化的经过剪接反应获得的circRNA在不同细胞上蛋白表达效率,以达到优化precursor-RNA的环化效率和其环化产物circRNA蛋白表达翻译的效率。小编认为,RNA测序分析还是远远不够的,还得对基因序列进行改造,熟悉和预测RNA的二级空间结构,了解和预测不同间隔序列对空间结构的影响,这才能合理地改造RNA,最大程度发挥改造后的RNA蛋白表达功能,并通过细胞转染来验证工程化circRNAs的蛋白表达效率。
参考文献
- Wesselhoeft RA, Kowalski PS, Anderson DG. Engineering circular RNA for potent and stable translation in eukaryotic cells. Nat Commun. 2018 Jul 6;9(1):2629. doi: 10.1038/s41467-018-05096-6.
.png)