、
最近来自南京医科大学第一附属医院的徐泽宽教授团队于Mol Cancer期刊在线发表了题为“Circular RNA circNRIP1 acts as a microRNA-149-5p sponge to promote gastric cancer progression via the AKT1/mTOR pathway”的研究,在胃癌组织中发现了表达上调的一种新的circRNA——circNRIP1,circNRIP1可海绵miR-149-5p,激活AKT1/mTOR通路,促进糖酵解的能量合成代谢,而抑制自噬相关的分解代谢,circNRIP1可通过外泌体的方式分泌,被胃癌细胞吸收,从而促进胃癌细胞的增殖、迁移和侵袭。该研究提示了circNRIP1可作为肿瘤促进因子,而miR-149-5p作为肿瘤抑制因子,有可能成为胃癌靶向治疗的理想靶分子。
1. 二代测序挖掘疾病相关circRNA:对正常组织和胃癌组织进行circRNA芯片表达谱分析,发现了49种差异表达的circRNA(33种表达上调,16种表达下调),作者把关注点放在表达上调水平最高的circNRIP1,同时在胃癌组织和胃癌细胞系中验证了circNRIP1的表达上调情况,与芯片结果一致。
2. circRNA的生物特征:sanger测序证明circNRIP1来源于母系基因NRIP1的2和3号外显子;利用特异性引物进行RT-PCR,RNase R和放线菌素D处理都证实了circNRIP1属于环状RNA,具有环状RNA的生物特性。临床预后分析,发现相比于circNRIP1表达低的患者,胃癌组织中circNRIP1表达高的患者的总体存活率OS和无疾病存活率DFS相对较低。
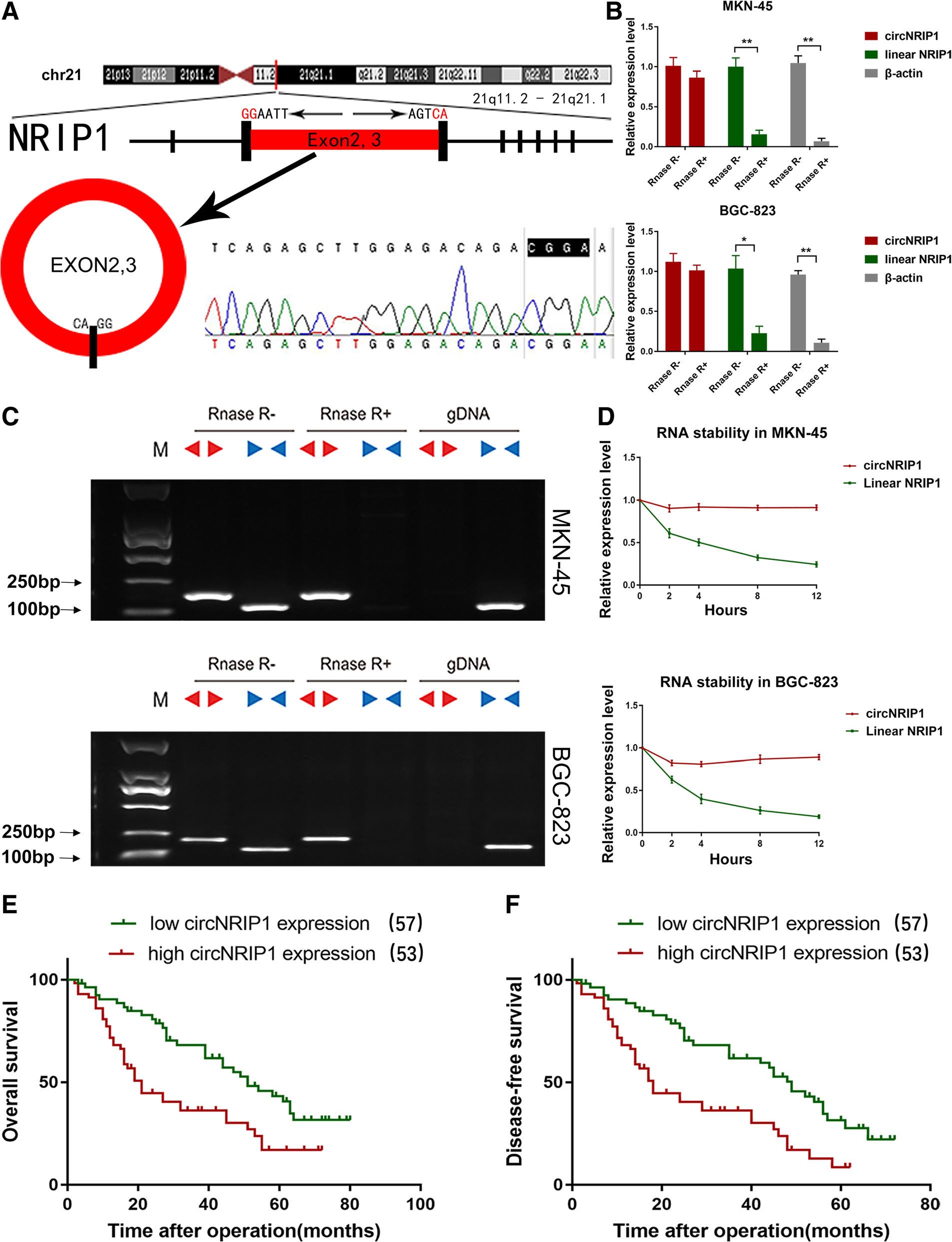
3. circRNA与miRNA的关系预测与验证: 同时利用CircNet,RNA22和RegRNA数据库预测了circNRIP1靶向结合的miRNA,其中有10种miRNA同时出现在三个数据库的预测结果中。为了进一步确定是哪种miRNA,作者利用circNRIP1探针在两种胃癌细胞MKN-45和BGC-823中进行pull-down实验,只有miR-149-5p可以在两种细胞中一致地被circNRIP1捕获富集。FISH实验证明了circNRIP1和miR-149-5p共定位于胞浆;针对两者结合位点进行突变后进行luciferase报告基因实验,证明了circNRIP1和miR-149-5p的相互结合;RT-qPCR临床分析胃癌组织则证明了circNRIP1和miR-149-5p表达成负相关的关系。
4. 那么miRNA靶向哪种下游基因?:已有文献报道,miR-149-5p靶向AKT-mTOR通路,抑制肝癌细胞的增殖、迁移和侵袭。双荧光素酶报告基因实验证明miR-149-5p与AKT1的相互结合作用;IHC实验和RT-qPCR分析发现,胃癌组织中AKT1的表达水平明显上调;针对AKT1表达分为高表达和低表达组,发现AKT1表达高的胃癌组织中circNRIP1的表达也相对较高;利用siRNA敲低circNRIP1表达后,细胞中AKT1的表达也下调,呈现正相关的关系。
5. circNRIP1的功能学实验:CCK8实验、Edu实验、克隆形成实验、迁移和侵袭实验、类器官模型证明过表达circNRIP1提高胃癌细胞的增殖能力,促进DNA合成,提高克隆形成能力,促进细胞的迁移和侵袭和类器官模型的生长,而敲低circNRIP1和转染miR-149-5p则出现相反的结果。EMT是介导胃癌发展和侵袭发生的重要机制,之前的实验结果已经明确了circNRIP1与胃癌的关系,而且circNRIP1正调控AKT1的表达。再结合已有文献报道,作者猜测circNRIP1通过PI3K/AKT1信号通路,上调转录因子TWIST、snail和slug的表达,促进EMT的进程。WB实验证明过表达circNRIP1促进TWIST、N-cadherin、snail和slug的表达;而敲低circNRIP1和转染miR-149-5p则出现相反的结果。
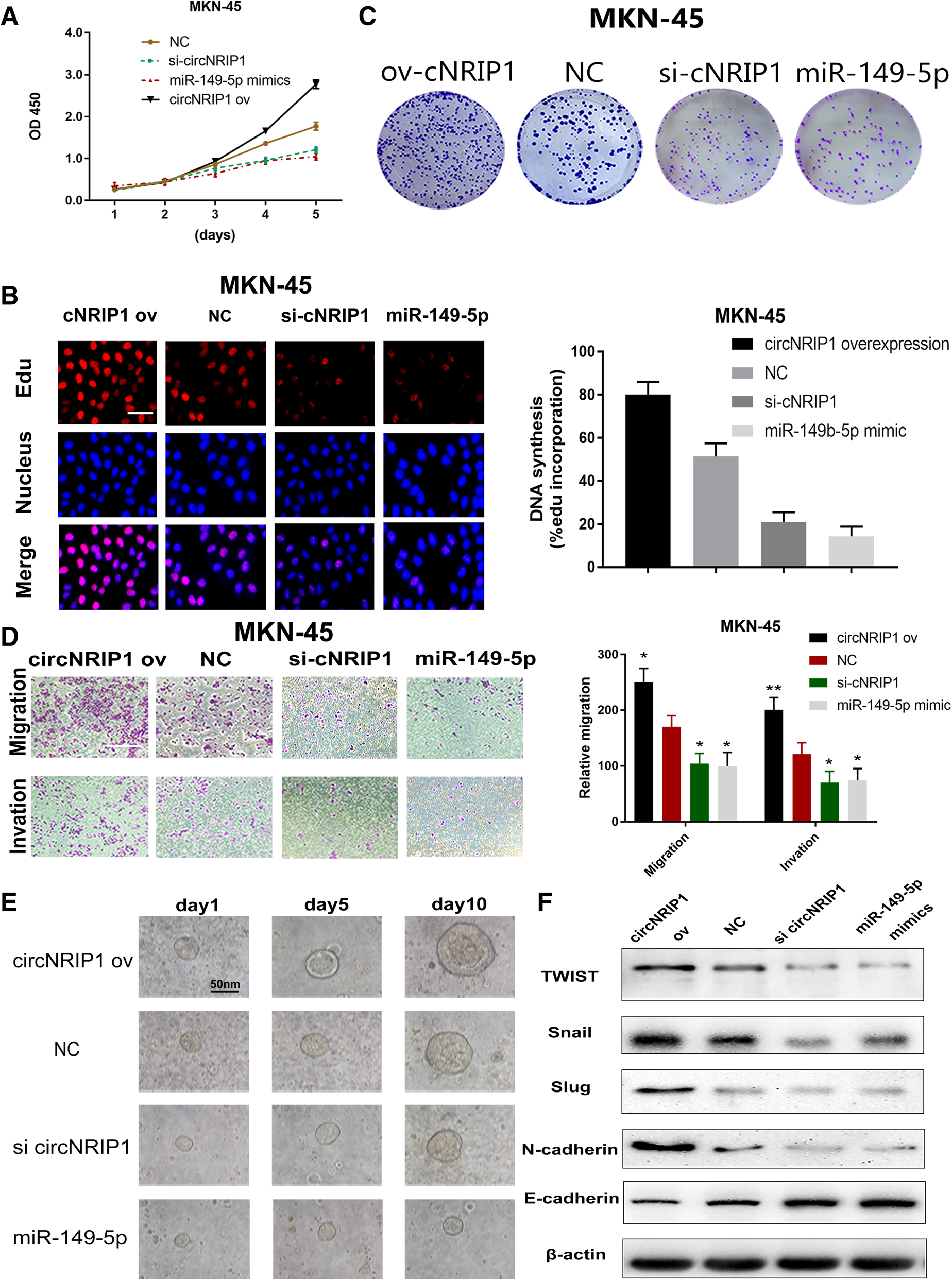
6. 为了验证circNRIP1是否通过海绵miR-149-5调控AKT/mTOR通路,作者敲低circNRIP1的表达明显下调AKT1, p-AKT1,mTOR和p-mTOR的表达,抑制DNA合成,抑制胃癌细胞的迁移和侵袭,抑制类器官模型的生长以及其中AKT1的表达,而如果同时抑制miR-149-5p表达则出现相反的结果。为了探讨circNRIP1/miR-149-5p/AKT/mTOR轴促进肿瘤生长和发展的进一步分子机制,作者检测了自噬相关蛋白和糖酵解通路相关蛋白,发现敲低circNRIP1的表达明显下调HIF1α, PFK, p-ULK的表达,而上调自噬水平,同时下调与EMT相关的阳性蛋白的表达;而如果同时抑制miR-149-5p表达则出现相反的结果。
7. 外泌体与circNRIP1:肿瘤细胞之间普遍存在以外泌体方式的交流。作者检测了胃癌患者血浆外泌体中的circNRIP1表达量出现上调;无论是带CD63-RFP标记的外泌体还是circNRIP1的外泌体与GFP标记的MKN-45胃癌细胞共孵育,外泌体均可以被癌细胞摄取到胞浆中,导致胞内circNRIP1的表达明显上调,同时也上调了胞内AKT1, mTOR和EMT markers的蛋白水平;与circNRIP1-exo共孵育的胃癌细胞尾静脉回输裸鼠后,发现其肿瘤迁移到胸腔的能力明显增强。
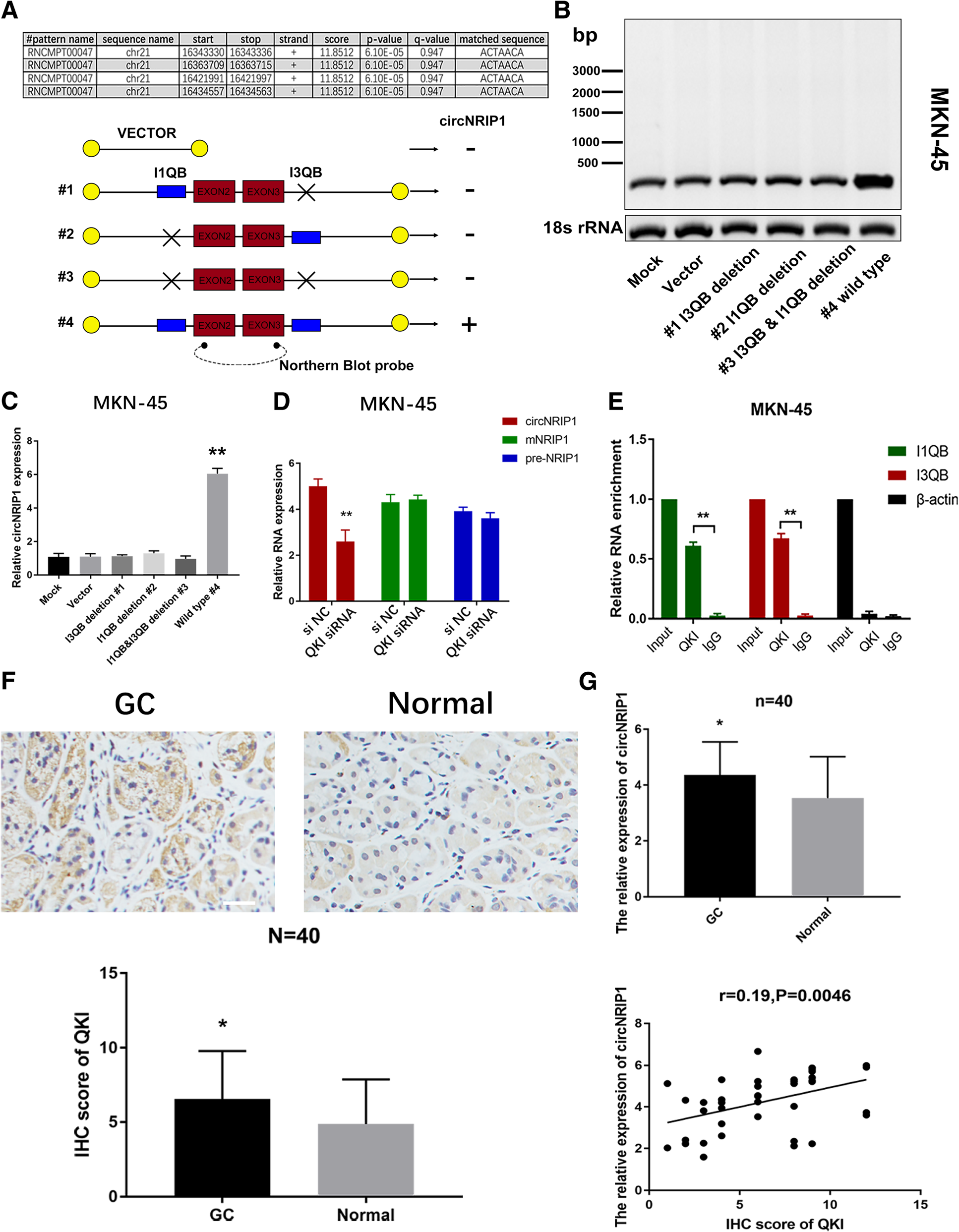
8. QKI是一种RNA结合蛋白,曾被报道主要调控circRNA的生物形成。为探讨QKI是否会通过靶向结合NRIP1 pre-mRNA,促进其生物形成。考虑到circNRIP1来源于母系基因NRIP1的2和3号外显子,从其上下游预测寻找QKI结合位点,发现两个结合序列存在剪切位点的上游1号内含子之中,故将包含这两个位点的序列统称I1QB,而两个结合序列存在剪切位点的下游3号内含子之中,故将包含这两个位点的序列统称I3QB。针对 I1QB和I3QB设计突变,验证这些位点对于circNRIP1形成的重要性。Northern blot和RT-qPCR实验证明I1QB和I3QB对于circNRIP1形成是缺一不可。敲低QKI表达只会影响circNRIP1的表达,而不会影响pre-mNRIP1和 mNRIP1的形成。RIP实验证明QKI可以结合I1QB和I3QB序列。IHC结果证明胃癌组织中QKI表达水平出现明显上调;RT-qPCR分析发现QKI表达与circNRIP1表达成正相关的关系。
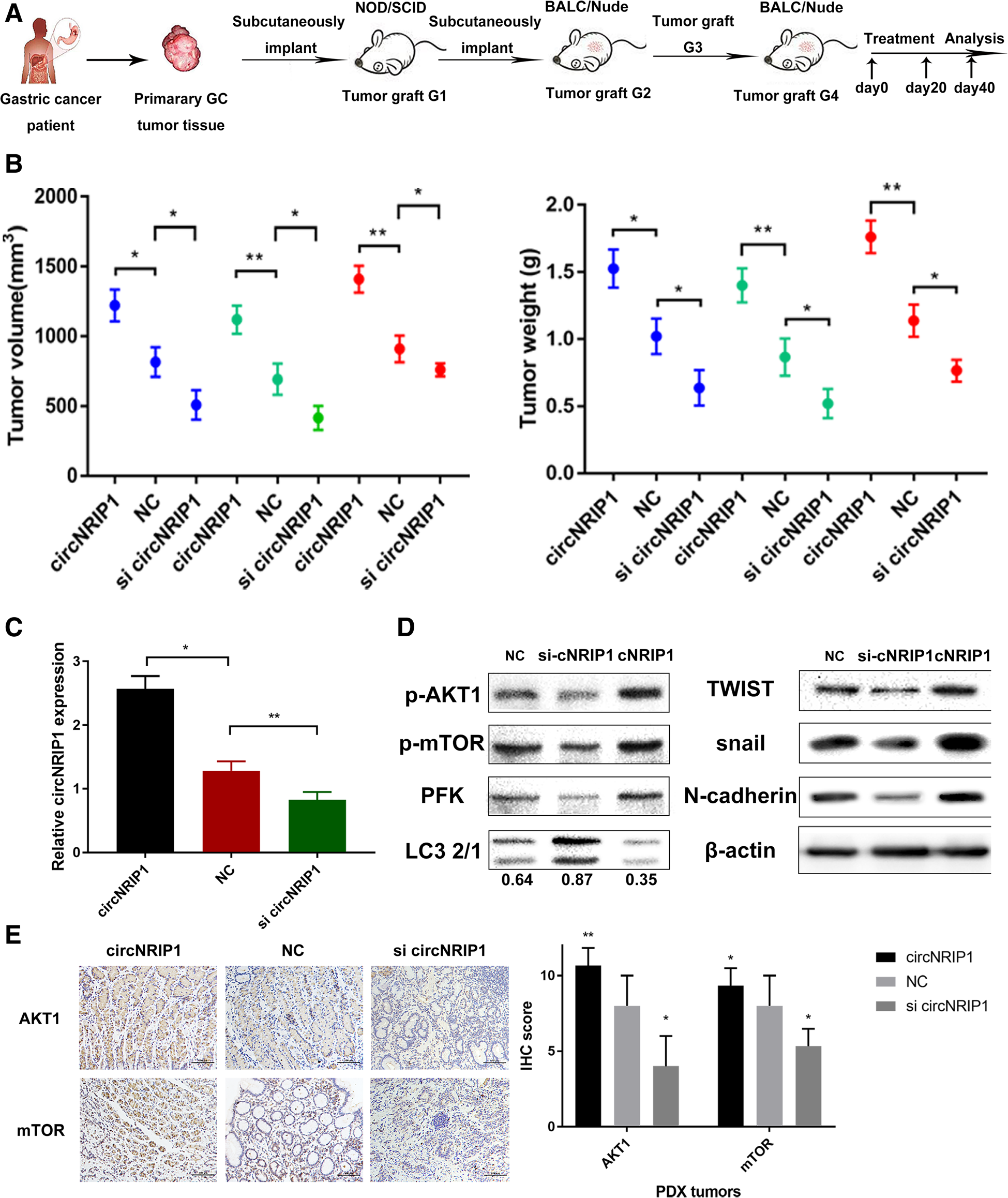
9. 体内实验:在异体移植小鼠模型的瘤内不断注射circNRIP1过表达质粒或者circNRIP1 siRNA,分析肿瘤体积和重量后发现过表达circNRIP1明显促进肿瘤的生长,而敲低circNRIP1明显抑制肿瘤的生长。circNRIP1过表达组的肿瘤组织中circNRIP1 mRNA水平明显上调,同时p-AKT1, p-mTOR, 和糖酵解基因PFK 的蛋白水平也明显上调,而自噬水平则被下调;circNRIP1表达敲低组的肿瘤组织则出现相反的结果。肿瘤组织的IHC结果与WB结果一致。
总的来说,作者通过测序发现胃癌组织中表达上调程度最高的circNRIP1,进一步的机制分析发现, circNRIP1通过靶向microRNA-149-5p,活化AKT/mTOR信号通路,促进能量合成代谢活性(如warburg效应),而抑制分解代谢活性(如自噬),从而促进肿瘤的生长。另外,circNRIP1还可以通过外泌体方式分泌后,被胃癌细胞摄取后,上调EMT markers蛋白水平,促进胃癌的转移和发展。
参考文献
- Zhang X, Wang S, Wang H, et al. Circular RNA circNRIP1 acts as a microRNA-149-5p sponge to promote gastric cancer progression via the AKT1/mTOR pathway. Mol Cancer. 2019 Feb 4;18(1):20. doi: 10.1186/s12943-018-0935-5.
.png)