环状RNA(circRNA)因其共价闭合的环状结构特点而具有稳定性,成为了新型的生物标志物。circRNA具有miRNA和蛋白海绵功能,调控下游相关蛋白的表达,使癌症发生相关的信号通路激活或失活。然而,circRNA在iCCA转移中的潜在机制仍有待进一步阐明。

cZNF215在iCCA组织中高表达,并与iCCA患者预后不良相关
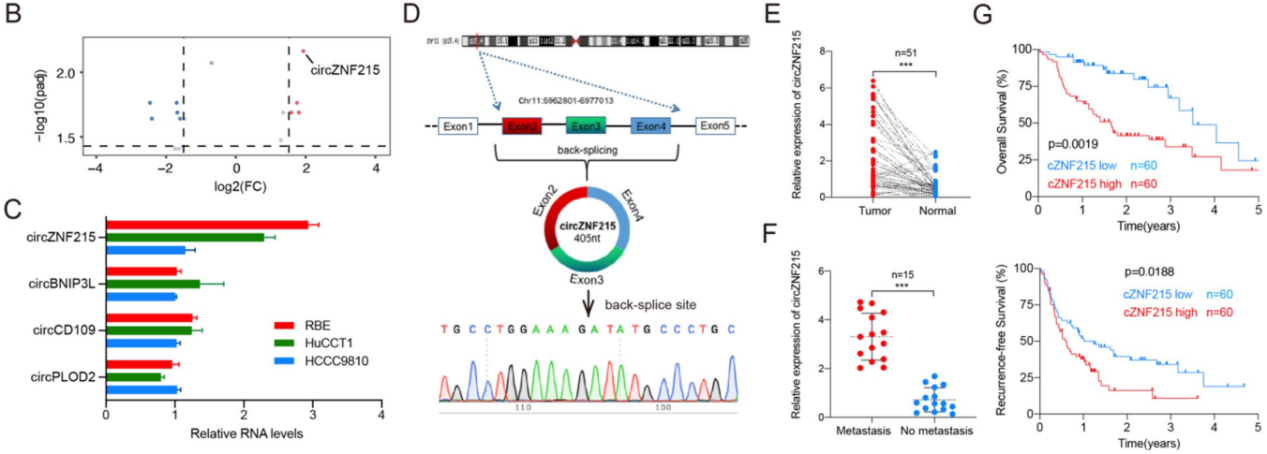
图1 cZNF215在iCCA中的表达分析和患者生存分析
cZNF215在体内外均促进iCCA的生长和转移
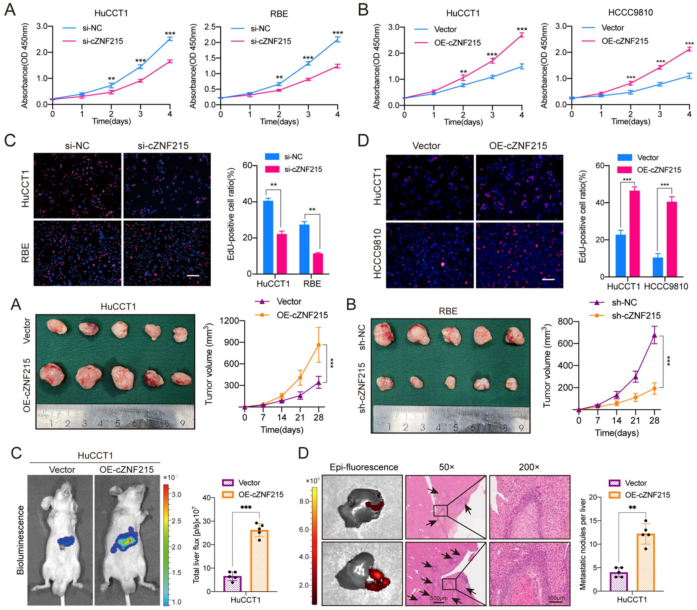
图2 cZNF215在体内外均促进iCCA的生长和迁移
cZNF215通过促进PTEN氧化使PTEN/AKT途径失活
作者采用RNAseq方法研究了cZNF215过表达调控的潜在基因,推测cZNF215可能通过氧化诱导的PTEN/AKT通路失活来促进iCCA的生长和转移。WB实验结果表明,cZNF215过表达确实增强了PTEN氧化和AKT(Ser473和Thr308)磷酸化,而敲低cZNF215则降低了PTEN氧化水平和AKT磷酸化水平。此外,在iCCA组织中进行IHC染色发现,cZNF215高表达组比cZNF215低表达组的AKT磷酸化水平更强。作者进一步探索PTEN在PTEN/AKT途径的介导作用,WB结果显示,过表达PTEN使AKT Ser473/Thr308磷酸化水平显著降低,而敲低PTEN则提高了AKT Ser473/Thr308磷酸化水平。接着,作者通过一系列细胞功能实验发现,NAC(一种调节细胞内氧化还原状态的含巯基抗氧化剂)可以逆转由cZNF215过表达引起的iCCA细胞增殖、迁移和侵袭,而PTEN失活则使cZNF215敲低后仍发生iCCA细胞增殖,迁移和侵袭的情况。总之,以上数据表明,过表达cZNF215使氧化诱导的PTEN/AKT途径失活,从而促进了iCCA的生长和转移。
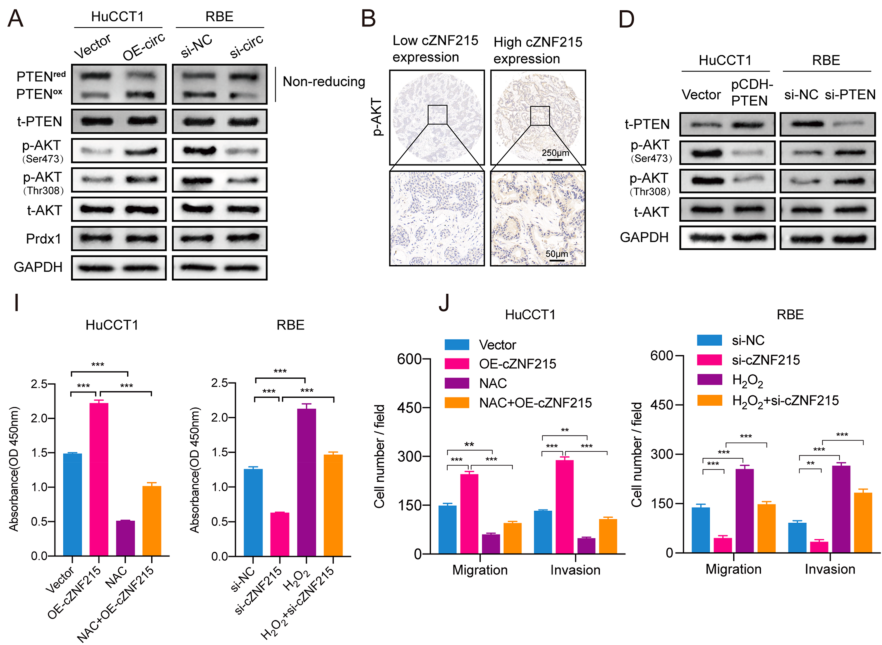
图3 cZNF215通过促进PTEN氧化使PTEN/AKT途径失活
cZNF215与PRDX1互作使PTEN/AKT途径失活
作者通过RNA pull-down实验和质谱检测,发现PRDX1是cZNF215最可能的RBP,并用RIP实验确认了cZNF215和PRDX1在iCCA细胞中的互作。为了进一步探索PRDX1在iCCA肿瘤发生中的作用,作者敲低或过表达PRDX1后检测PTEN氧化水平和AKT磷酸化水平,WB结果显示,PRDX1的过表达显著降低了PTENox和AKT磷酸化水平,而敲低PRDX1则出现相反的结果。此外,过表达PRDX1减弱了cZNF215过表达对AKT磷酸化的促进作用,而敲低PRDX1挽救了cZNF215诱导的AKT磷酸化的减少。在功能上,过表达PRDX1显著减弱了cZNF215过表达而引起的细胞增殖、迁移和侵袭,而敲低PRDX1则消除了cZNF215敲低对细胞增殖、迁移和侵袭的抑制作用。综上表明,cZNF215通过与PRDX1相互作用促进氧化诱导的PTEN失活,从而促进了iCCA的肿瘤进展和转移。
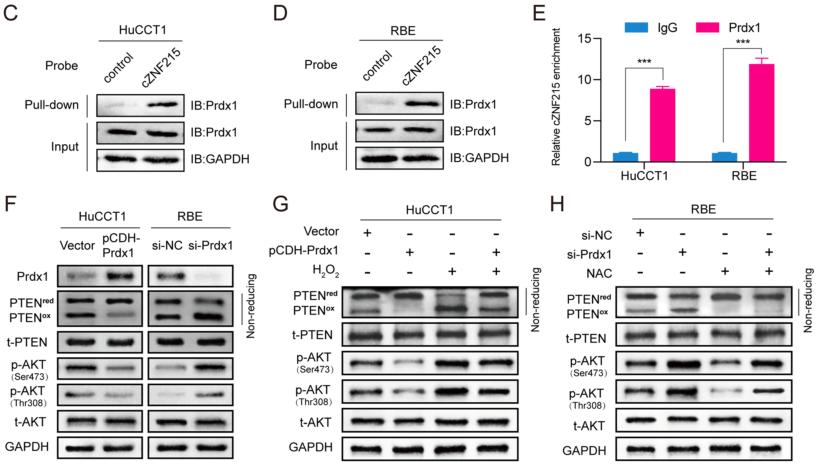
图4 PRDX1与cZNF215相互作用使PTEN/AKT途径失活
cZNF215阻止PRDX1和PTEN互作来促进PTEN氧化
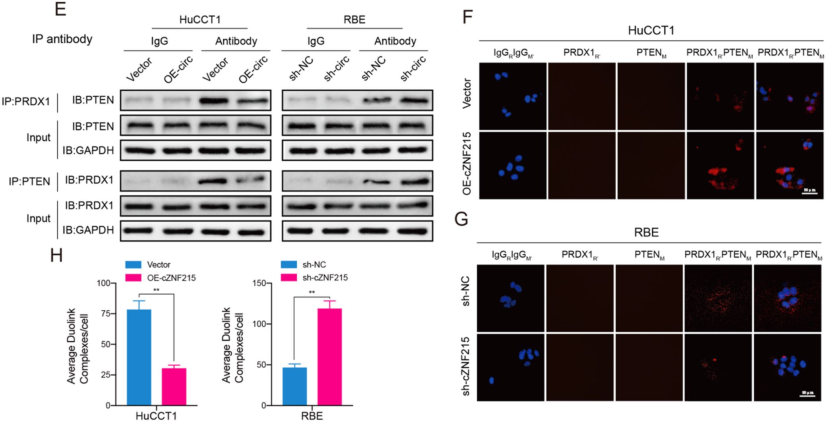
图5 cZNF215阻止PRDX1和PTEN之间的相互作用来促进PTEN氧化
敲低cZNF215可增强ipatasertib在体内的抗肿瘤作用
作者通过裸鼠皮下移植瘤实验发现,单独敲低cZNF215或使用ipatasertib可显著抑制肿瘤生长,并且结合cZNF215敲低与ipatasertib治疗能进一步增强对肿瘤生长的抑制作用。而且,在肝原位移植瘤模型和肺转移癌模型中均得到了相似的实验结果。此外,与单独使用ipatasertib治疗相比,敲低cZNF215显著增强了ipatasertib介导的iCCA抑制作用。总而言之,靶向敲低cZNF215以增强ipatasertib的抗肿瘤作用,可能是iCCA的潜在治疗策略。
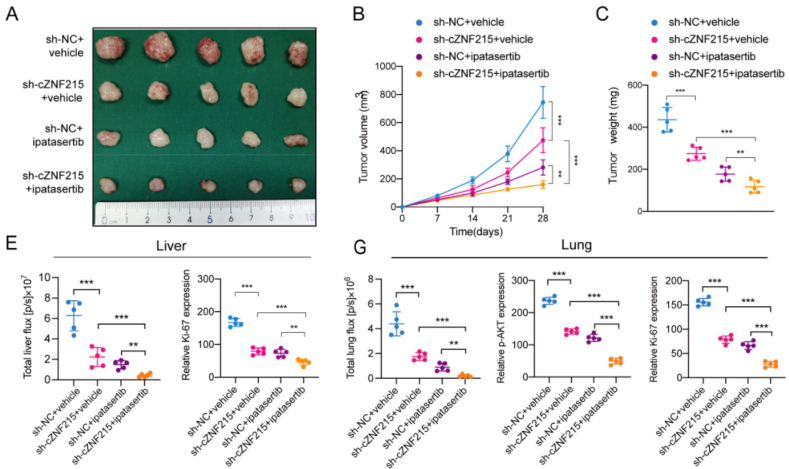
图6 敲低cZNF215可增强ipatasertib在体内的抗肿瘤作用
总结

图7 cZNF215促进iCCA细胞的生长和转移的分子机制
[2] Cidon EU. Resectable Cholangiocarcinoma: Reviewing the Role of Adjuvant Strategies. Clin Med Insights Oncol. 2016; 12(10): 43-8.
原文链接:

.png)