环状RNA (circRNAs)是一种内源性非编码RNA分子,具有反向拼接和共价闭合连续环形成的圆形结构。越来越多的证据表明,细胞外囊泡(EV)穿过血脑屏障(BBB)并调控相关基因表达。而有研究发现,circRNA已被证明可以通过增强神经可塑性、抑制神经胶质反应性和外周免疫细胞浸润来改善中风后的运动功能恢复[1]。然而,circRNA是否促进缺血性中风后血管修复及其下游机制尚不清楚。

1、circSCHM1改善缺血性中风恢复期的血管修复
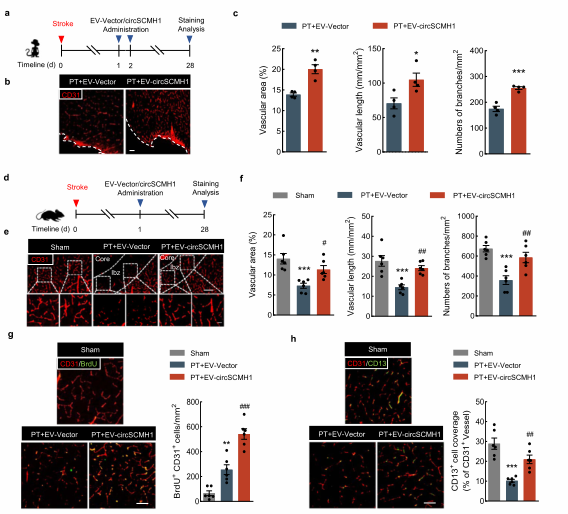
图1. CircSCHM1改善缺血性中风恢复期的血管修复
2、m6A修饰在中风患者和PT小鼠增加
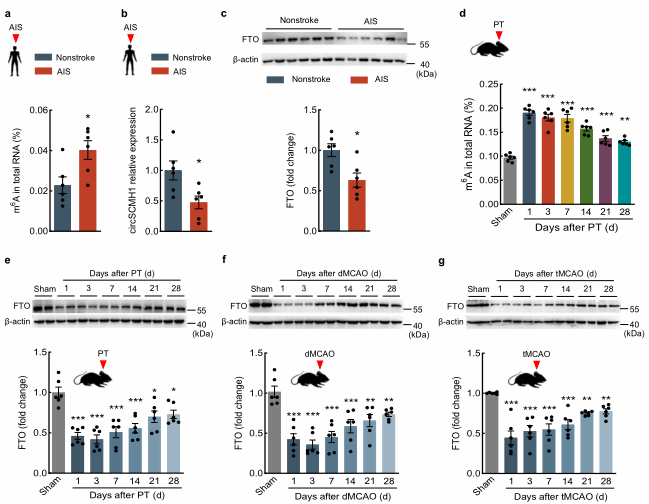
图2. m6A修饰在中风患者和PT小鼠增加
3、circSCMH1与FTO结合可减少m6 A修饰
(1)circSCMH1增强中风后血管修复;
先前的研究表明,FTO在细胞核和细胞质中表现出不同的底物偏好,m6A更可能是细胞核中初级聚腺苷酸RNA中的FTO底物29。因此,作者将眼光放到circSCMH1是否影响FTO转位到细胞核。我们首先研究了circSCMH1和FTO之间的相互作用。
通过RNA结合免疫沉淀试验,与阴性对照circHECW2和GAPDH相比,circSCMH1,而不是SCMH1,在ECs中显示出与FTO更强的亲和力。circSCMH1 pulldown实验显示,circSCMH1比circCon富集更多的FTO。作者进一步利用catRAPID算法预测出FTO中的三个区域与circSCMH1具有较高的互作能力,并设计突变和野生型载体进行了验证。综上提示,ECs中circSCMH1和FTO之间存在互作,并减少了m6 A修饰。

图3. circSCMH1与FTO结合可减少m6 A修饰
4、circSCMH1通过泛素化增加了FTO进入细胞核的易位
有研究报道,泛素化可促进FTO从细胞质转移到细胞核,作者接下来研究了circSCMH1对FTO泛素化的潜在影响。circSCMH1过表达显著增加了赖氨酸63(Ub-K63)连接的泛素化水平。UBC13是Ub-K63的E2泛素偶联酶。RNA结合免疫沉淀实验显示,circSCMH1在bEnd中对UBC13具有更强的亲和力。
由于circRNAs被证明可以作为一个支架来增强泛素酶与其靶基因的结合[32],接下来作者研究circSCMH1是否可以增强FTO与UBC13的结合。免疫共沉淀发现,circSCMH1能够促进FTO和UBC13相互作用。此外,作者发现,UBC13的敲低显著减弱了circSCMH1增强的FTO向细胞核的易位,为此作者做了调控模型如图k所示。综上所述,这些发现表明circSCMH1通过UBC13酶增加FTO的Ub-K63,并促进FTO从细胞质运输到细胞核。
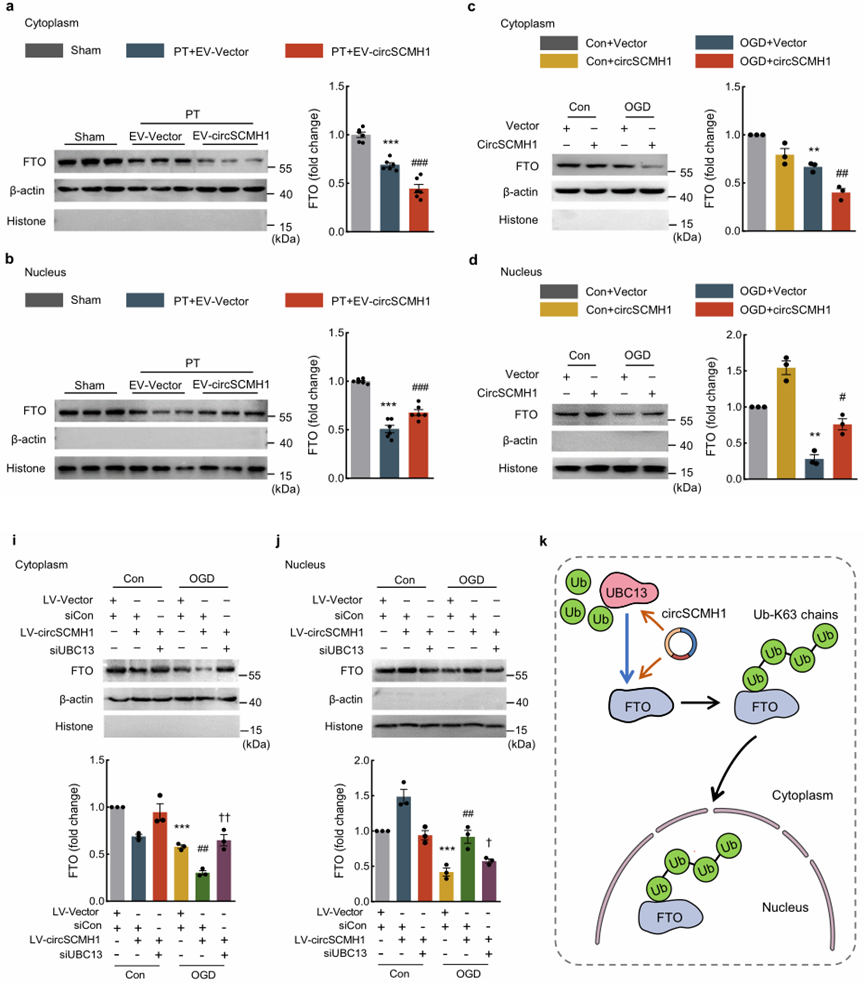
图4. circSCMH1通过泛素化增加了FTO进入细胞核的易位
5、circSCMH1调控PT小鼠梗死周围皮层Plpp3 mRNA的m6A修饰
通过分析m6A峰的密度,我们发现在PT中风诱导后,m6A修饰水平在梗死周围区增加,EV-circSCMH1处理抑制了PT诱导的m6A修饰。PT模型诱导后,14个转录本的m6A峰值显著增加,EV-circSCMH1处理后抑制这14个转录本出现。两组比较中有8个重叠的转录本,这提示circSCMH1影响了PT后血管修复的靶转录本。
m6A通常在3-UTR中富集,作者进一步研究了m6A甲基化的变化是否影响这8种重叠转录本的水平。通过qPCR和WB检测发现,EV-circSCMH1上调血管生成相关基因Plpp3的表达。进一步分析了Plpp3的m6A修饰水平,结果显示,EV-circSCMH1减弱了Plpp3的m6 A修饰水平,而敲低FTO则可逆转这一结果。这表明m6A修饰介导了circSCMH1增强了Plpp3 mRNA的稳定性。

图5. m6A修饰介导了circSCMH1增强了Plpp3 mRNA的稳定性
6、FTO过表达促进PT小鼠血管及运动功能的恢复
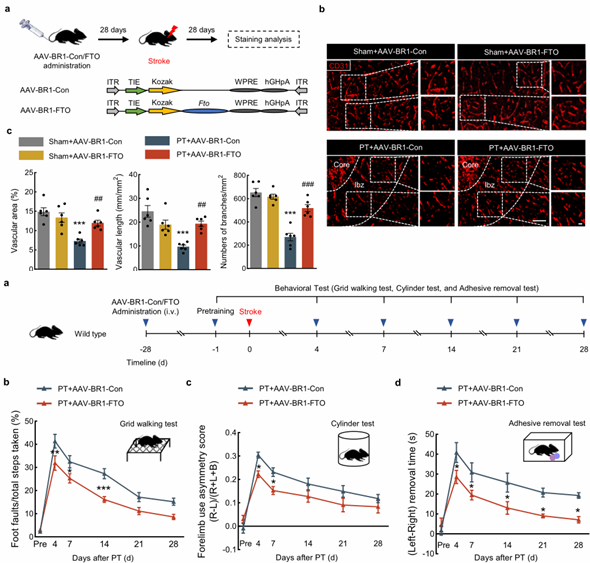
图6. FTO过表达促进PT小鼠血管修复
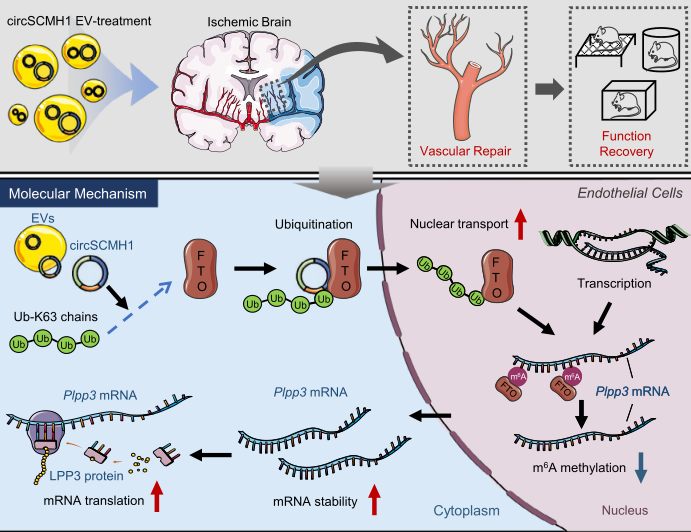
EV-circSCMH1在缺血性中风后血管修复中的增强作用
https://doi.org/10.1038/s41467-023-36008-y
参考文献:
[1] Yang, L. et al. Extracellular vesicle-mediated delivery of circular RNASCMH1 promotes functional recovery in rodent and nonhuman primate ischemic stroke models. Circulation 142, 556–574 (2020).
[2] Yao, M. D. et al. Role of METTL3-dependent N(6)-methyladenosine mRNA modification in the promotion of angiogenesis. Mol. Ther.28,2191–2202 (2020).
转载请联系邮箱授权:circRNA@163.com
.png)