环状RNA (circRNAs)是一类单链RNA,它可形成闭环结构,具有调控功能。以往的研究表明,circRNA可发挥分子海绵机制促进梗死心肌细胞的生成和延缓衰老等效果;在长寿果蝇中,circRNA可以延长寿命[1]。种种迹象表明,circRNA对于抵抗衰老伴随的心力衰竭是一种新的思路。

一、circRNA在年轻和中年小鼠心脏中的表达及影响
RNase R外切酶处理结果显示,circHIPK3耐消化。设计敲低circHIPK3能够降低H9C2细胞中的circHIPK3水平,β-Gal染色水平升高,而过表达circHIPK3的结果相反。除此之外,过表达circHIPK3后,H9C2中衰老标志物p16和p21的mRNA和蛋白水平显著降低,而沉默circHIPK3后,衰老标志物p16和p21的mRNA和蛋白水平升高。这些结果表明circHIPK3在H9C2细胞系和原代CMs中都能防止细胞衰老。
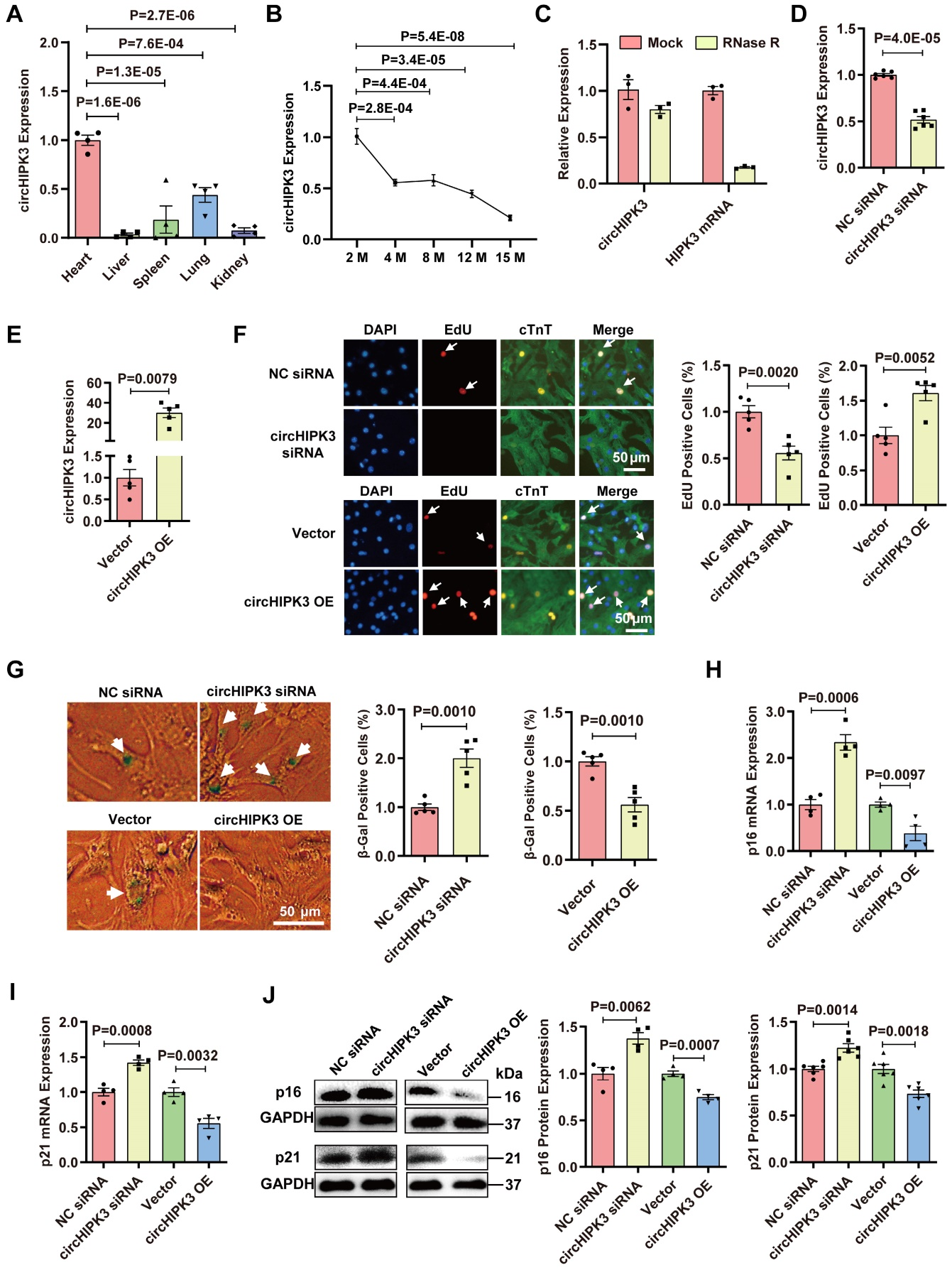
图1.circRNA在年轻和中年小鼠心脏中的表达及影响
二、 circHIPK3的敲除诱导小鼠心脏衰老
有研究报道,αMHC驱动的Cre酶可能影响心脏细胞生物学。为了确定Cre酶的潜在作用,作者比较了Cre小鼠和CKO小鼠心脏中circHIPK3的表达和心脏功能。数据表明,与Cre小鼠相比,CKO小鼠心脏中circHIPK3水平下降,心功能受损。为了证实circHIPK3在心脏衰老中的保护作用,作者在CKO小鼠中注射了慢病毒过表达circHIPK3 (LV-circHIPK3),结果表明,LV-circHIPK3改善CKO心功能。这些结果表明,心肌细胞中circHIPK3的缺失导致心脏衰老和生存不良。
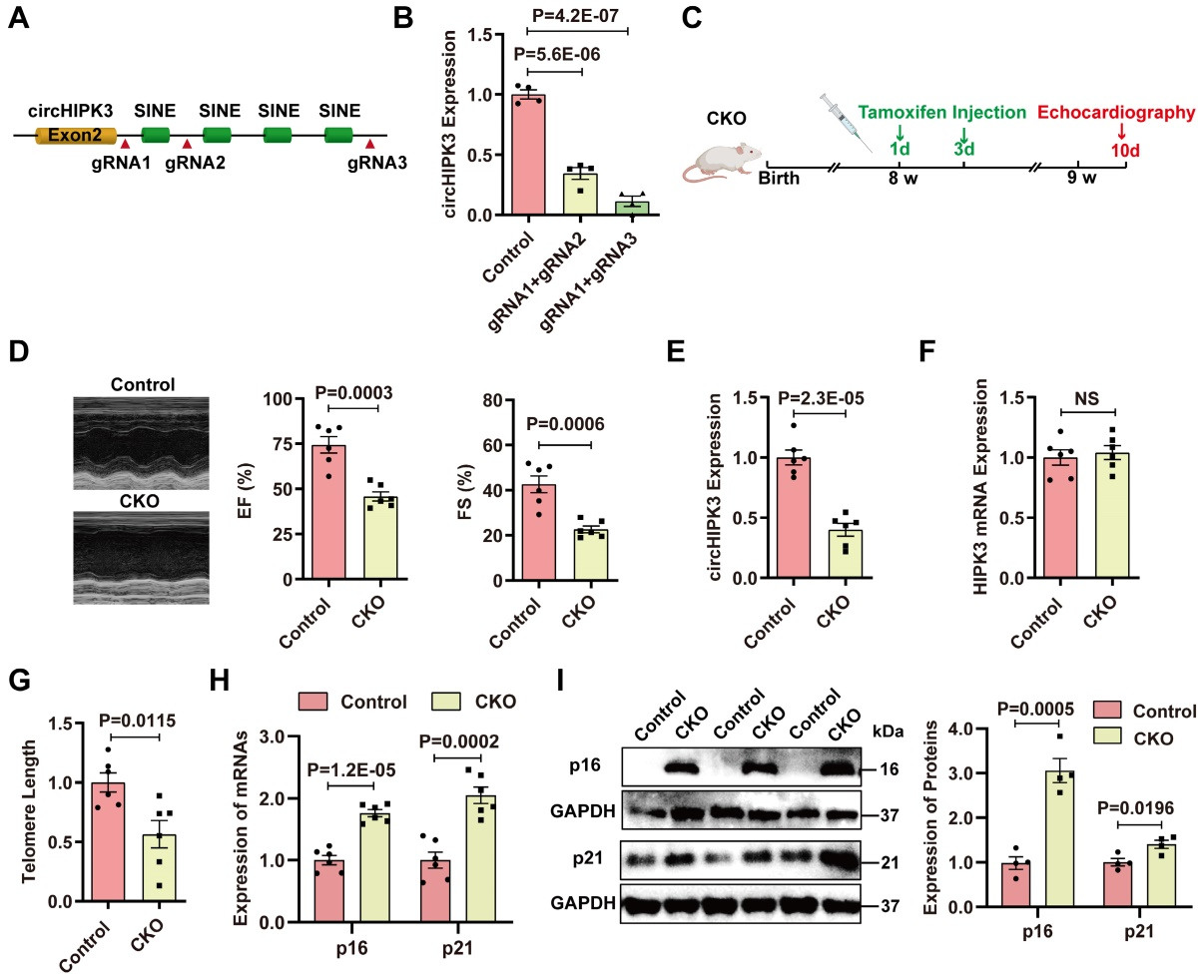
图2.circHIPK3的敲除诱导小鼠心脏衰老
三、 circHIPK3调控HuR蛋白表达
既往研究表明,HuR主要位于细胞核内,但在缺血、缺氧、紫外线照射下可向细胞质转移[2]。作者假设circHIPH3通过抑制HuR向细胞质的转运或增加HuR降解,从而导致p21 mRNA的不稳定来防止衰老。WB和免疫荧光结果发现,CKO小鼠心脏细胞质的HuR升高。有趣的是,对照组和circHIPK3 CKO小鼠心脏中HuR蛋白表达上调,但是HuR mRNA的表达没有差异,并且沉默或过表达circHIPK3也不能改变H9C2细胞中HuR mRNA的表达。但是,过表达circHIPK3时,H9C2细胞中HuR总蛋白水平下降,而沉默circHIPK3时,结果相反。这些结果表明,circHIPK3可以决定HuR的定位,调控HuR的表达。
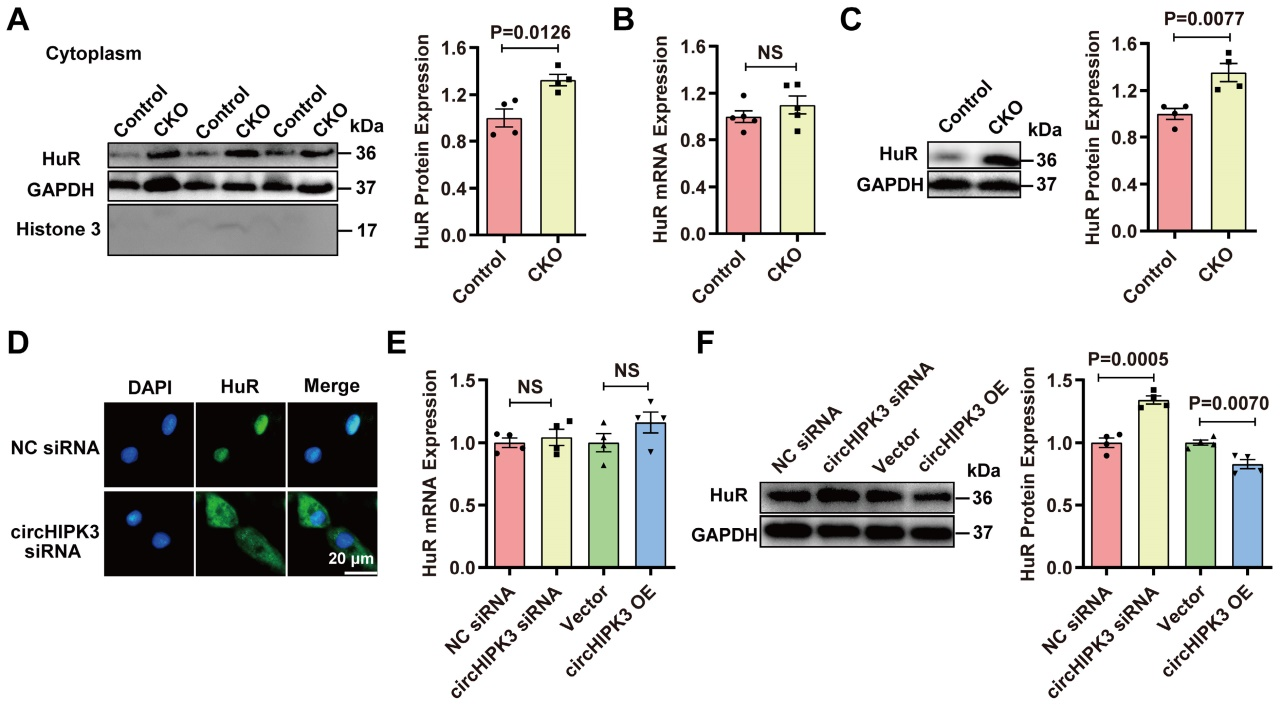
图3.circHIPK3调控HuR蛋白表达
四、 circHIPK3作为HuR和E3泛素连接酶的支架,促进HuR降解
作者进一步研究了circHIPK3是否通过泛素-蛋白酶体系统调控HuR降解。RPISeq预测显示circHIPK3不仅能与HuR结合,还能与泛素连接酶β-TrCP结合。RIP实验证实circHIPK3与β-TrCP之间存在直接相互作用。Co-IP表明,敲低circHIPK3削弱了HuR与β-TrCP之间的相互作用,并降低了HuR的泛素化。RIP实验显示敲低circHIPK3增强了HuR蛋白与p21 mRNA的相互作用。
为了确定HuR在p21 mRNA表达中的作用,作者用RNA合成抑制剂(放线菌素D)处理细胞,发现HuR沉默后,p21 mRNA的半衰期从5.2 h下降到3.5 h,说明HuR可以增加p21 mRNA的稳定性。为了确定敲低circHIPK3是否通过抑制HuR来促进p21的表达,作者用siRNA敲除了circHIPK3和HuR。WB结果显示,敲低HuR逆转了敲低circHIPK3对p21表达的影响,表明circHIPK3通过调控HuR抑制p21水平。这些结果表明,circHIPK3增强了HuR和β-TrCP的相互作用,通过泛素-蛋白酶体途径降解HuR,导致p21表达降低。
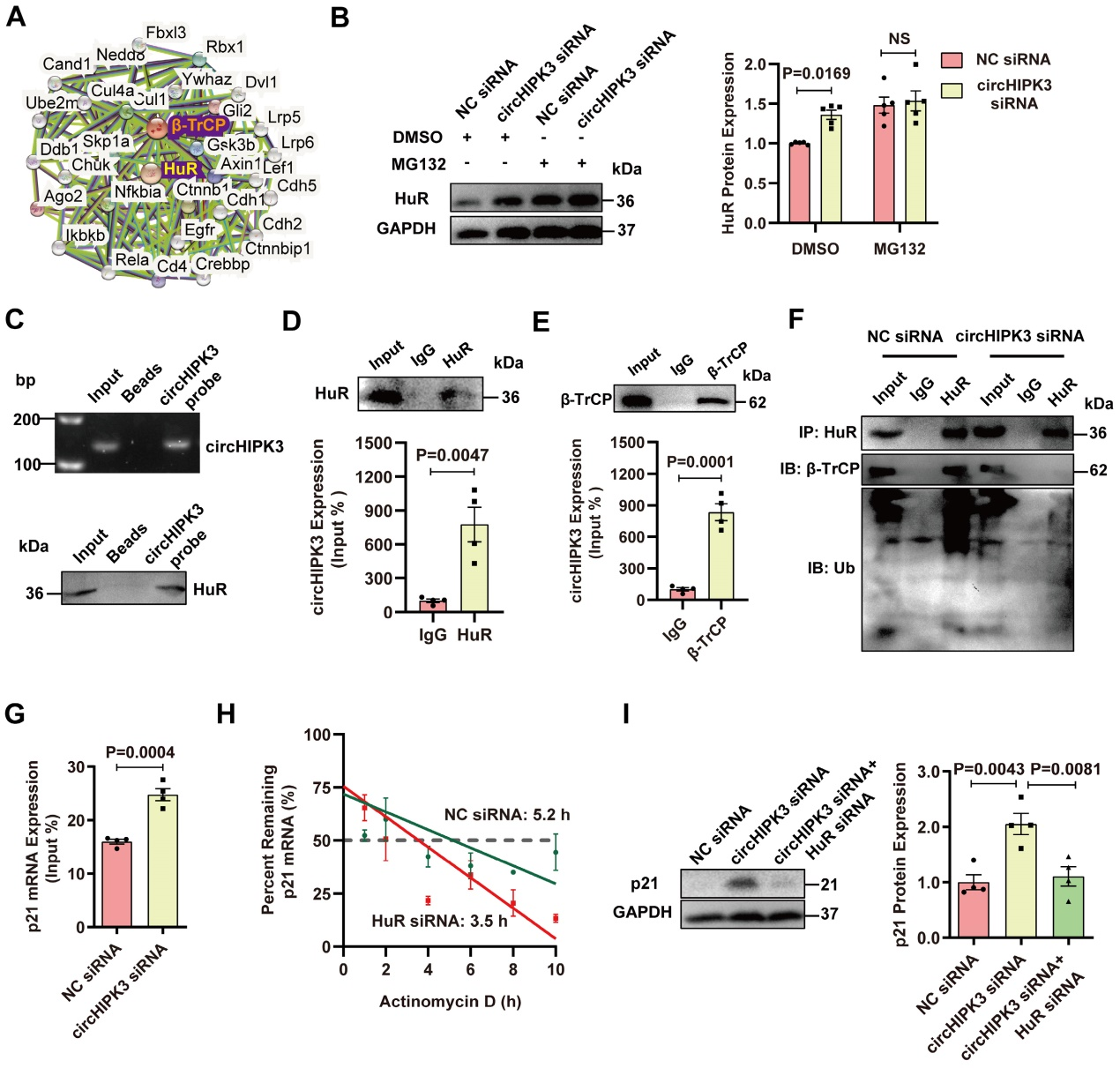
图4.circHIPK3作为HuR和E3泛素连接酶的支架,促进HuR降解
五、 外泌体通过释放circHIPK3来防止CM衰老
为了确定外泌体是否通过传递circHIPK3来保护心脏免受心脏衰老,作者通过尾静脉注射PBS、外泌体(NC-Exo)和circHIPK3沉默外泌体(si-Exo)。结果发现注射外泌体的小鼠心脏功能改善、circHIPK3水平升高、端粒长度延长、p16和p21 mRNA和蛋白水平降低。然而,敲低circHIPK3抑制了外泌体发挥的这些有益作用。
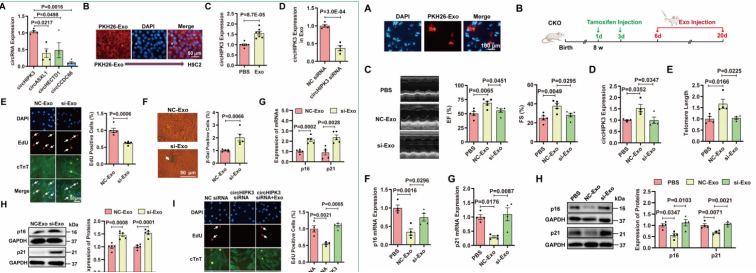
图5.外泌体通过释放circHIPK3来防止CM衰老
小结
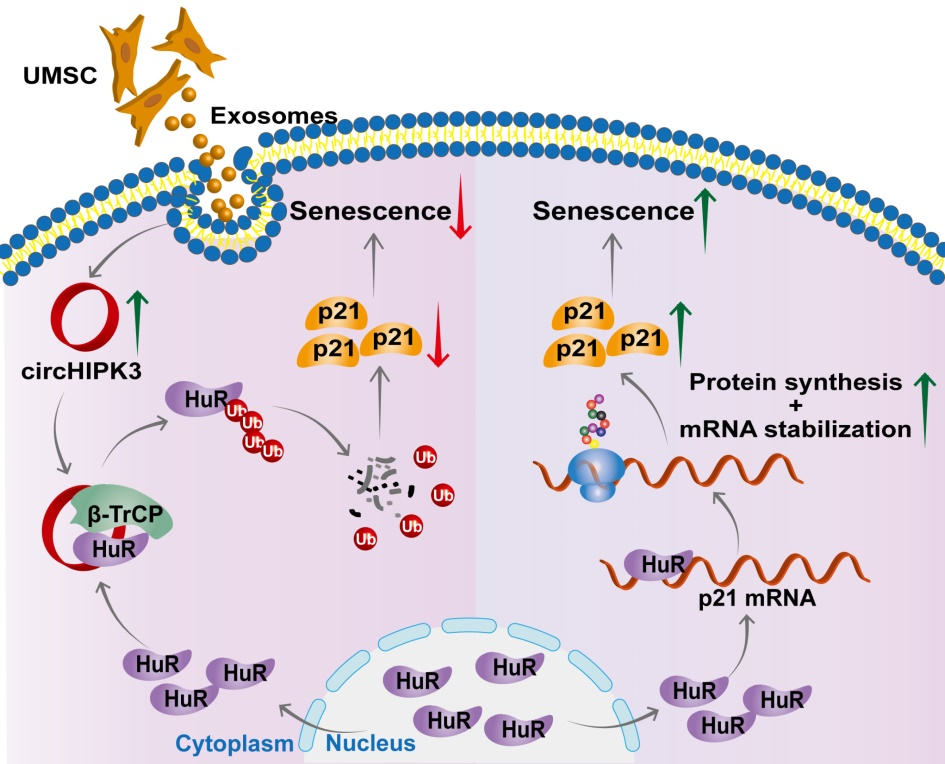
图6.circHIPK3/HuR/p21在心脏早衰中的调控机制
doi:10.7150/thno.77630
参考文献:
[1] Zheng Q, Bao C, Guo W, Li S, Chen J, Chen B, et al. Circular RNA profiling reveals an abundant circHIPK3 that regulates cell growth by sponging multiple miRNAs. Nat Commun. 2016; 7: 11215.
[2] Sun Q, Tripathi V, Yoon JH, Singh DK, Hao Q, Min KW, et al. MIR100 host gene-encoded lncRNAs regulate cell cycle by modulating the interaction between HuR and its target mRNAs. Nucleic Acids Res. 2018; 46: 10405-16.
[3] Lan Y, Xiao X, He Z, Luo Y, Wu C, Li L, et al. Long noncoding RNA OCC-1 suppresses cell growth through destabilizing HuR protein in colorectal cancer. Nucleic Acids Res. 2018; 46: 5809-21.
[4] Zhu B, Zhang L, Liang C, Liu B, Pan X, Wang Y, et al. Stem cell-derived exosomes prevent aging-induced cardiac dysfunction through a novel exosome/lncrna malat1/nf-kappab/tnf-alpha signaling pathway. Oxid Med Cell Longev. 2019; 2019: 9739258.
转载请联系邮箱授权:circRNA@163.com
.png)