乳腺癌(BC)是世界范围内最常见的女性恶性肿瘤[1,2]。在过去的几十年里,尽管BC的诊断和治疗取得了巨大的进步,但由于复发率高、远处转移和化疗耐药等原因[3],BC的死亡率仍然很高。因此,深入研究BC发病和转移的分子机制成为亟待解决的问题。
环状RNA具备的高度稳定性和显著的组织特异性使其成为疾病诊断和治疗的可靠生物标志物。环状RNA作为ncRNA的一类,通常被认为没有编码蛋白质的能力。然而,最近的研究表明,一些含有开放阅读框的细胞质环状RNA可以编码功能肽或蛋白。circRNAs和PI3K/ akt相关信号参与了BC肿瘤的发生和发展过程。迄今为止,很少发现有环状RNA编码的蛋白参与BC肿瘤发生。

1、CircSEMA4B在BC组织中显著低表达
在这项研究中,作者在BC的PI3K/AKT信号通中筛选出7个具有蛋白编码潜能的circRNA。在15对BC组织和癌旁组织检测中发现在BC组织中显著低表达的hsa_circ_0000650,命名为CircSEMA4B。对其进行了鉴定和细胞定位验证。
BC有明确的4个分子亚型分类,包括TNBC、her2阳性、luminal-A和luminal-B。作者发现CircSEMA4B在TNBC和luminal-B中显著高表达。与正常乳腺上皮细胞系MCF-10A相比,CircSEMA4B在BC细胞系中的表达减少,特别是在TNBC细胞系MDAMB-231和管腔细胞系MCF-7中。因此,作者选择探讨CircSEMA4B在MDAMB-231和MCF-7细胞系中的功能和机制。
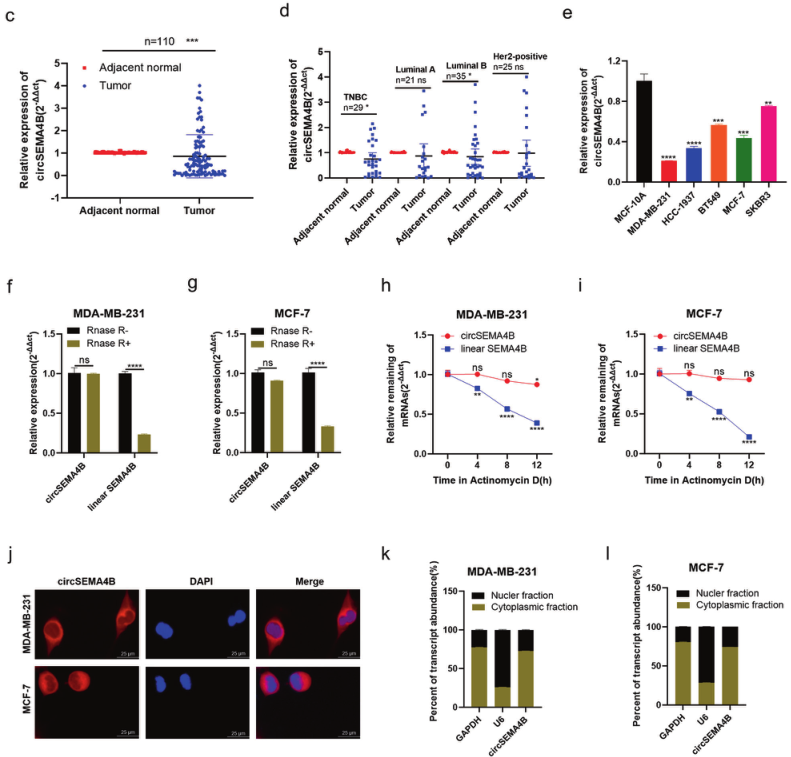
图1.CircSEMA4B在BC组织和细胞系中的特性
2、CircSEMA4B抑制BC细胞的增殖、迁移和侵袭能力
作者通过功能实验结果表明,CircSEMA4B过表达显著抑制BC细胞增殖。CircSEMA4B下调促进了BC细胞的迁移,而CircSEMA4B过表达显著降低了MDA-MB-231细胞的迁移。敲低CircSEMA4B表达后,MDA-MB-231细胞的侵袭能力增强。以上结果表明,CircSEMA4B在BC细胞中起抑癌作用。
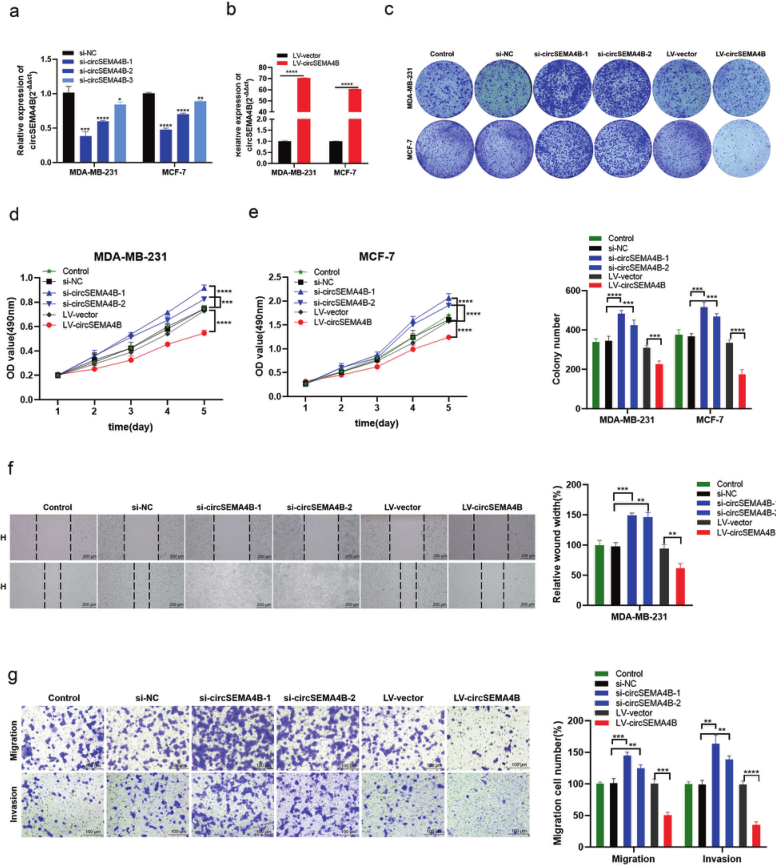
图2.CircSEMA4B抑制BC细胞的增殖、迁移和侵袭能力
3、CircSEMA4B编码蛋白SEMA4B-211aa
作者通过双荧光素酶验证了IRES的活性,随后通过构建翻译载体,证明了CircSEMA4B的ORF在MDA-MB-231和MCF-7细胞中是可翻译的,预测CircSEMA4B编码一个211a的新蛋白,命名为SEMA4B-211aa。作者针对SEMA4B-211aa构建了一种抗体,通过Western blotting证明了内源性翻译蛋白SEMA4B-211aa的存在。IF结果显示SEMA4B-211aa主要定位于BC细胞的细胞质中。
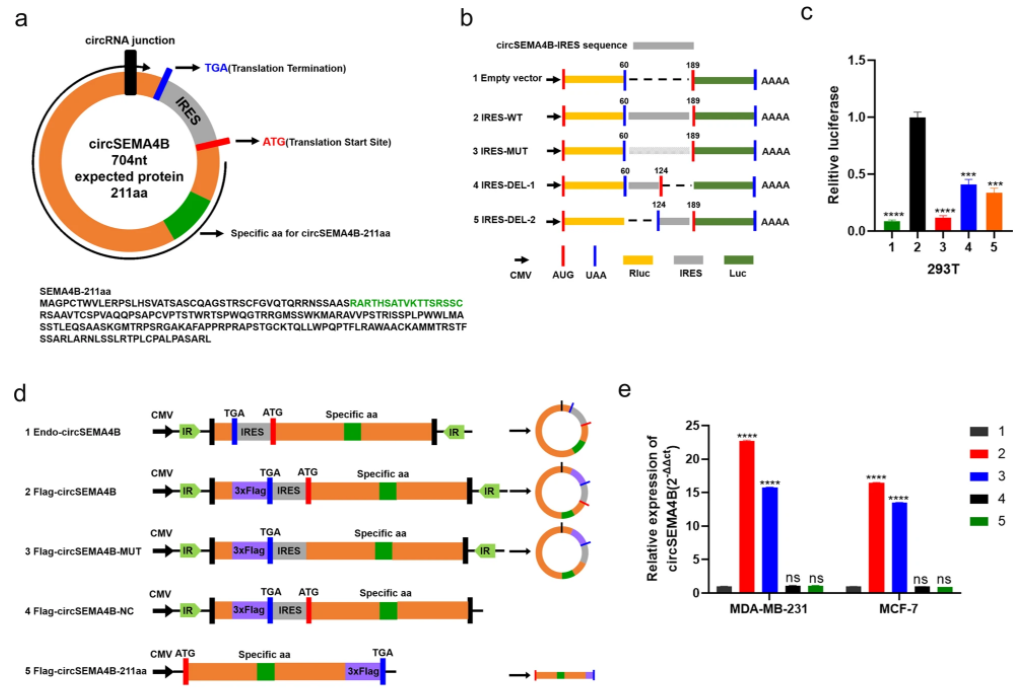
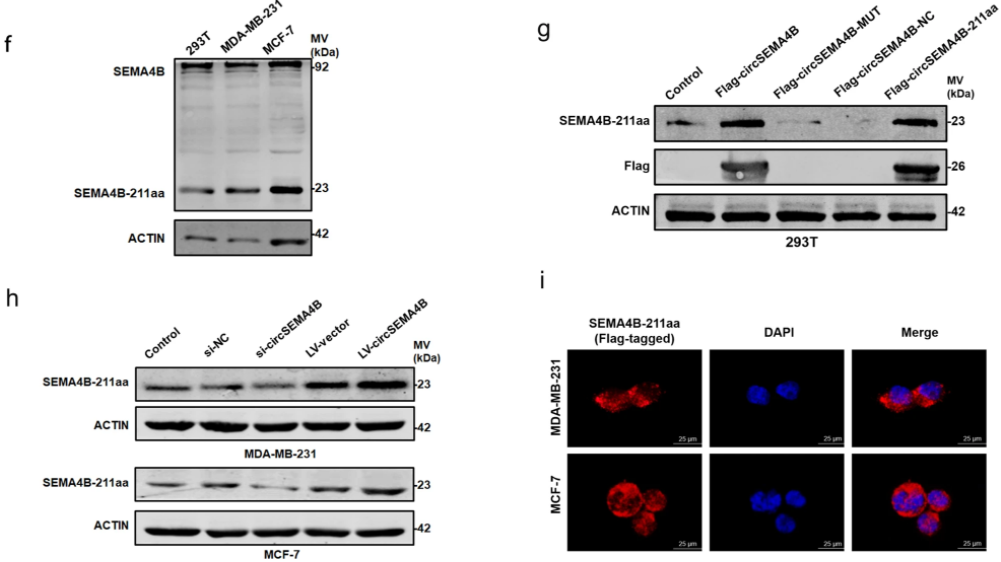 图3.CircSEMA4B编码一种新蛋白SEMA4B-211aa
图3.CircSEMA4B编码一种新蛋白SEMA4B-211aa
4、CircSEMA4B至少可以通过两种途径抑制BC的进展
作者检测到SEMA4B-211aa在BC中的低表达,提示其可能在BC细胞中起抑癌作用。作者将Flag-CircSEMA4B、Flag-CircSEMA4B- mut、Flag-CircSEMA4B- nc和Flag-CircSEMA4B-211aa质粒转染到BC细胞中,探讨SEMA4B-211aa和CircSEMA4B本身的生物学功能。通过Tanswell和划痕实验发现不能翻译SEMA4B-211aa的突变体和CircSEMA4B过表达都能降低BC细胞的增殖、迁移和侵袭能力。以上结果表明,CircSEMA4B自身和SEMA4B-211aa均在BC中发挥抑瘤作用,说明CircSEMA4B至少通过两种途径抑制BC的进展。
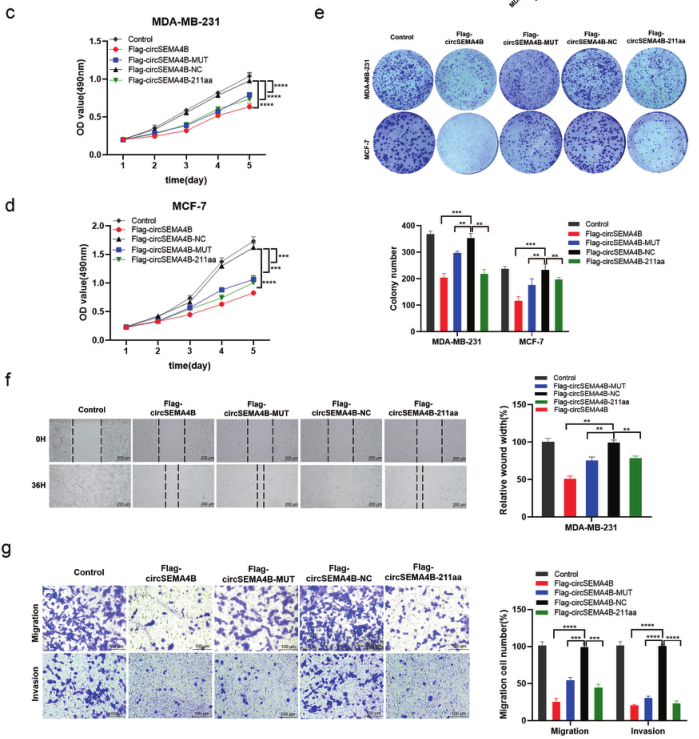 图4.CircSEMA4B和SEMA4B-211aa均在BC中发挥抑瘤作用
图4.CircSEMA4B和SEMA4B-211aa均在BC中发挥抑瘤作用
5、SEMA4B-211aa与p85相互作用,调节PI3K活性
此外,作者在敲除和过表达CircSEMA4B后,SEMA4B的mRNA和蛋白水平没有明显变化,说明CircSEMA4B发挥其作用独立于其亲本基因。由此作者推断SEMA4B-211aa发挥作用于p110上游。然后,作者检测SEMA4B-211aa是否在转录水平上降低p110的表达。与蛋白质水平不同,p110的mRNA水平不受SEMA4B-211aa的影响,表明p110蛋白的减少发生在转录后阶段。
鉴于调控亚基p85是稳定催化亚基p110的上游信号,作者推测p85可能是SEMA4B-211aa的潜在结合蛋白。作者通过Co-IP实验验证SEMA4B-211aa与p85在体内存在相互作用。IF结果也支持SEMA4B与p85共定位。
根据p85(PI3K)可以将代谢物PIP2磷酸化为PIP3,ELISA法检测PI3K活性,结果显示SEMA4B-211aa显著抑制PIP3的生成。综合以上结果,SEMA4B-211aa可能与p110竞争结合p85,从而降低p110的稳定性,抑制第二信使PIP3的生成。
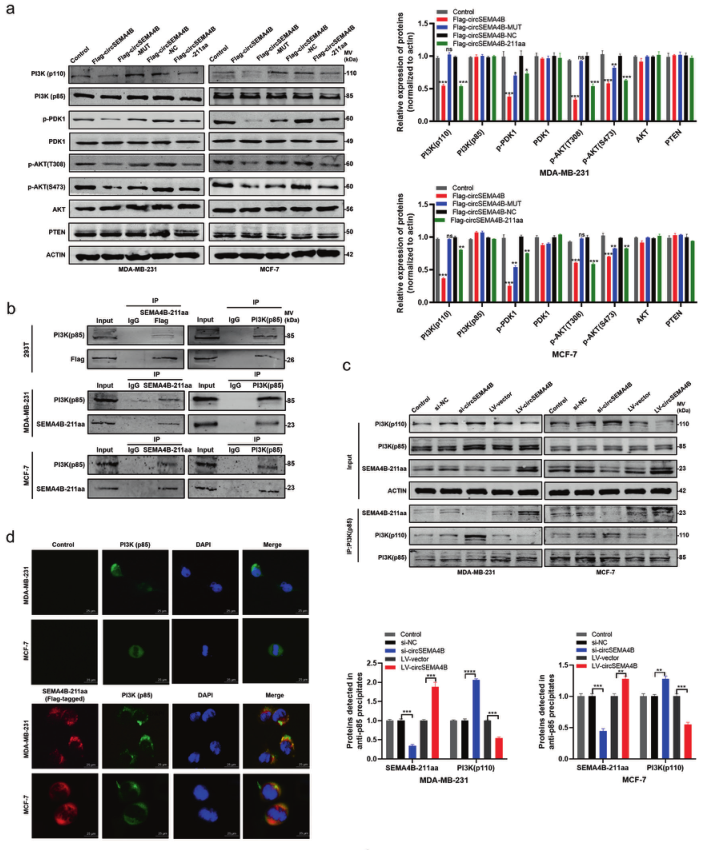
图5.SEMA4B-211aa与p85相互作用,调节PI3K活性
6、CircSEMA4B通过作为miR-330-3p的海绵调控PDCD4和PI3K/AKT信号通路
在之前的研究中miR-330-3p已被发现在BC中起致癌作用,miR-330-3p的上调提示BC患者预后不良。miR-330-3p可以通过直接与PDCD4 mRNA的3 ‘ UTR相互作用抑制PDCD4[4]。因此作者推测CircSEMA4B通过miR-330-3p正向调控PDCD4。并通过qRT-PCR、拯救试验,MTT、克隆形成和transwell证实。
此外,有报道称PDCD4是PI3K/AKT信号通路的抑制剂,可抑制AKT- ser308的磷酸化,作者研究了CircSEMA4B是否会影响BC中PI3K/AKT信号通路。正如预期的那样,CircSEMA4B下调后,PDCD4蛋白水平下降,p-AKT(S473)蛋白水平升高,表明PI3K/AKT信号通路激活。
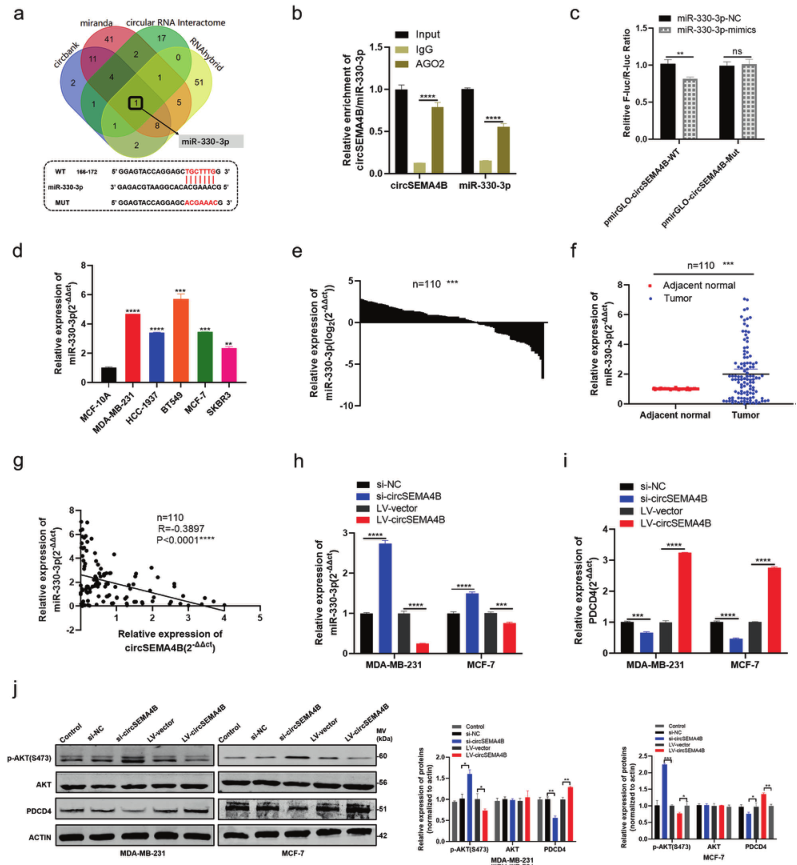
图6.CircSEMA4B通过作为miR-330-3p的海绵
为进一步确认CircSEMA4B通过PI3K/Akt通路发挥抑癌作用,作者研究Akt抑制剂MK2206处理的BC细胞,CircSEMA4B对增殖、迁移和侵袭的抑制作用明显减弱,表明CircSEMA4B特异性靶向PI3K/AKT通路。作者进行了体内功能实验,与体外实验结果一致。随后,作者通过免疫组化检测异种移植肿瘤中PDCD4、p110和p-AKT (T308/S373)的表达水平。再次验证CircSEMA4B在BC肿瘤发生中是PI3K/ AKT信号的重要负调控因子。
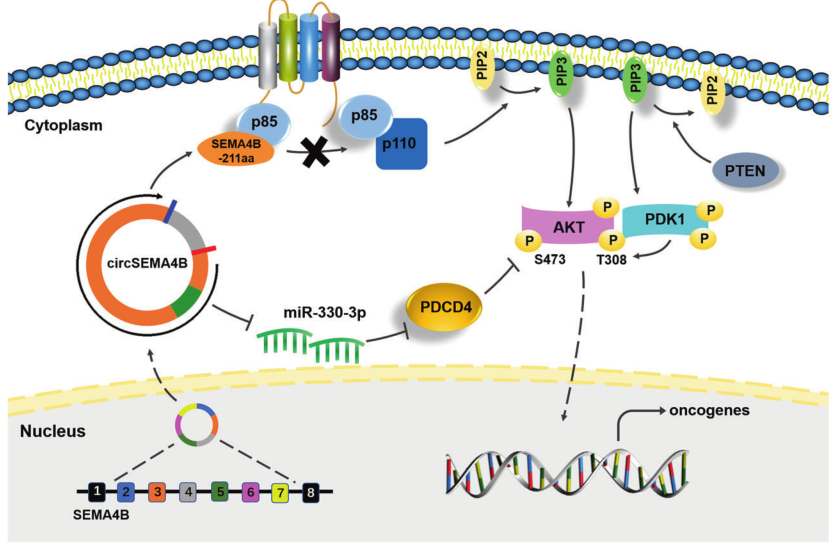
图7.CircSEMA4B和SEMA4B-211aa的作用机制
原文链接:
https://doi.org/10.1038/s41419-022-05246-1
参考文献:
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin.2020;70:7–30.
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin.2019;69:7–34.
[3] He X, Xu T, Hu W, Tan Y, Wang D, Wang Y, et al. Circular RNAs: their role in the pathogenesis and orchestration of breast cancer. Front Cell Dev Biol.2021;9:647736.
[4] Ji C, Hu J, Wang X, Zheng W, Deng X, Song H, et al. Hsa_circ_0053063 inhibits breast cancer cell proliferation viahsa_circ_0053063/hsa-miR-330-3p/PDCD4 axis.Aging. 2021;13:9627.
转载请联系邮箱授权:circRNA@163.com
.png)
