2019年7月1日,新加坡基因组研究所的Roger Foo与杜克-新加坡国立大学医学院的Dan Xu和Lei Sun为共通讯作者在Nature Metabolism杂志上发表了一篇题为“Adipose circular RNAs exhibit dynamic regulation in obesity and functional role in adipogenesis”的文章,阐述circArhgap5-2和circTshz2-1可以在分化中期驱动成脂过程,且circArhgap5-2的表达对于维持整体脂肪细胞转录程序至关重要,证明了circRNA在脂肪细胞分化和代谢中起着重要的调节作用([1])。

肥胖在世界范围内构成日益严重的健康负担。了解肥胖组织发育、能量存储和营养稳态的潜在机制对于研发肥胖及其合并症的新疗法是十分重要的。非编码RNA正在成为脂肪细胞分化和功能的新型调控分子,circRNA作为一类新的单链闭合环状非编码RNA,它在脂肪生物学中的功能尚未被挖掘。本篇文章中,作者首先分析了深度RNA测序(RNA-seq)数据集,并鉴定了数千种脂肪表达的circRNA。随后,选择一组高度丰富、保守和脂肪富集的候选circRNA,来检测它们在脂肪形成和肥胖过程中的动态表达模式。结果表明,circArhgap5-2是体内和体外成脂基因程序必不可少的驱动分子。
1、脂肪circRNA的整体表达分析
作者对人内脏(网膜)和皮下脂肪组织以及小鼠附睾和腹股沟脂肪中提取的去除核糖体RNA的总RNA进行了深度RNA测序。4个RNA-seq文库中的每一个测序均实现了127±10 million配对末端读取。使用Tophat2将它们与参考基因组(人类的hg19,小鼠的mm9)进行比对,具有≥80%的高映射效率。使用Cufflinks2(v.2.2.1)对基因表达进行量化,并以FPKM为单位进行报告。每个文库均显示一系列高水平的表达基因(FPKM>1),在所有人类和小鼠样本中分别检测到超过16,000个基因和14,000个基因。
作者选取一种高效且无偏差的算法-CIRI2,用于circRNA鉴定。CIRI2根据严格筛查标准鉴定出以头尾反向剪接区域(BSJ)为特征的circRNA。在GENCODE v.19标注人类circRNA后,作者发现大多数circRNA(5,651 / 6,925,81.6%)均来自编码外显子,其余来自内含子(376 / 6,925,5.4%)、外显子-内含子边界(190 /6,925,2.7%)和其他位点(708 / 6,925,10.2%)。在小鼠中也观察到了类似的分布。将得到的脂肪circRNA列表与公开可用的circBase数据库进行比对,结果显示RNA seq发现了952种新的circRNA亚型。
作者标注了脂肪文库中表达最高的100个circRNA。其中,丰度最高的人类circRNA circHIPK3-1,其亲本基因产生的另一种环状异构体,可充当miRNA海绵。circZNF609-1是人类第四高表达的候选circRNA,据报道它可以被主动翻译成截短肽。排名前10位的其他高丰度的circRNA是从RHOBTB3、COL3A1、SMARCA5、ESYT2、ASPH、LPAR1和CORO1C基因转录而来的,这些基因的线性mRNA可编码结构或酶调节蛋白。在产生最多的circRNA亚型的宿主基因中(例如AHNAK、ZNF124、NRIP1、ASPH和PDE3B),其也会通过广泛的可变剪接产生多个线性转录本。总体而言,每个人类外显子circRNA的外显子预测中位数为3,其中,10.6%的circRNA仅包含一个外显子,6.2%的circRNA超过10个外显子。有趣的是,关键的白色脂肪细胞调节因子,例如PPARγ、LEP、ADIPOQ、FABP4和INSR,均能在人类脂肪中产生可检测的外显子环状RNA。
当比较人类和小鼠皮下脂肪和内脏脂肪之间circRNA的归一化丰度时,作者观察到两个脂肪库中的表达模式之间有很好的相关性。尽管如此,少数circRNA也显示出库特有的分布,包括仅在内脏中检测到的circRNA (例如,circEPB41L2-2、circNCL-2、circHNRNPA2B1-1、circEFEMP1-1、circCOL1A1-1和circMETRNL-1),或者仅在皮下脂肪中检测到的circRNA(例如,circVIM-1、circFBLN2-1、circCOL1A2-1、circ-COL4A2-1和circFBN1-4)。此外,在两种类型的白色脂肪组织(WAT)中,反向剪接与线性剪接比率(BSR)的分布是一致的,这表明相对于宿主基因中的线性转录,两种组织中的circRNA生成受到类似的调控。从总体来看,内脏和皮下脂肪中环状转录本的丰度大大超过其同源线性转录本,但是一小部分circRNA丰度与线性转录本相似,或者更高。高表达线性转录本的宿主基因倾向于产生更多circRNA亚型,但是这种比例关系不是完全线性的,这表明circRNA的生物发生受到基因座基础转录以外的其他调控层的调控。
接下来,为了鉴定脂肪中富集的circRNA,作者对ENCODE Project Consortium下载的人类组织RNA测序数据集应用相同的算法,并将这些文库中的circRNA表达谱与作者得到的脂肪circRNA列表进行比对。结果显示,在circRNA列表中,有1,810种circRNA(占26.1%)仅在人类脂肪数据集中检测到,表明这些circRNA具有高度组织特异性。
根据同源基因的人和小鼠BSJ序列之间≥70%的序列同源性标准,作者额外鉴定了120种物种保守的circRNA。他们在人和小鼠脂肪样品之间显示出相似的相对表达。有趣的是,与非保守的circRNA相比,它们表现出更高的丰度,这表明这些保守的circRNA可能与脂肪功能相关。
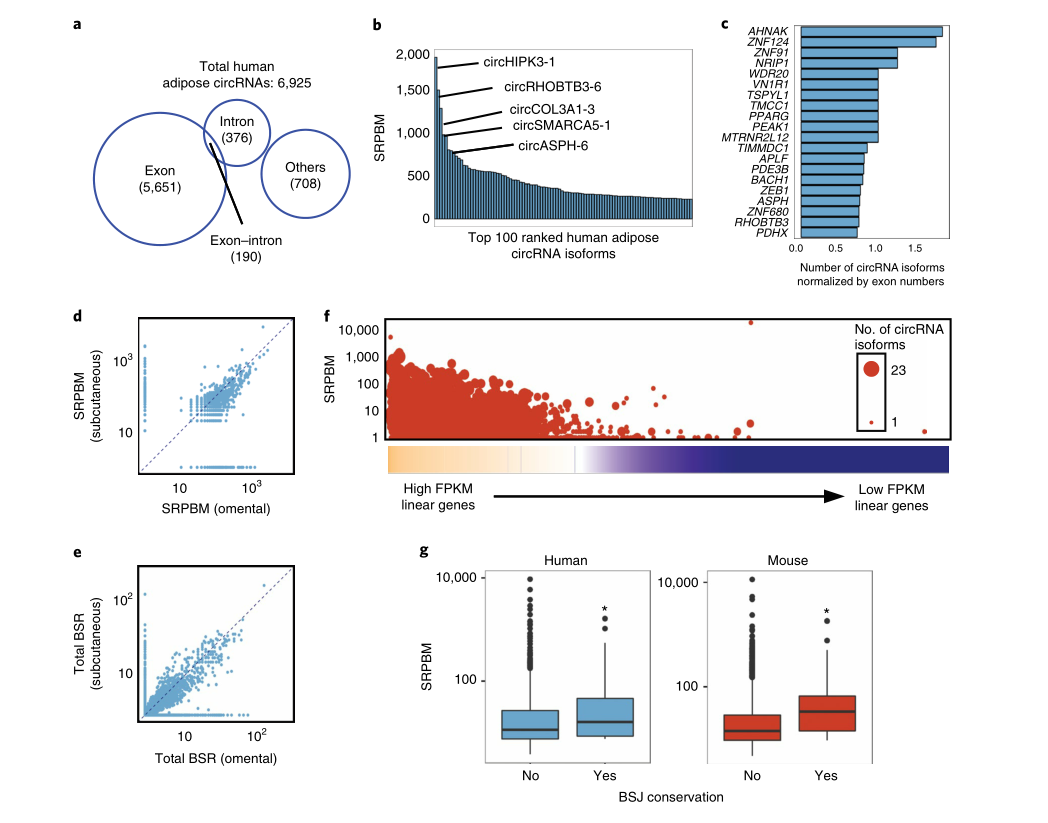
图1 环状RNA的整体表达分析
2、脂肪circRNA的实验验证
接下来,作者选取circRNA在脂肪组织中进行进一步的验证和鉴定。在保守的circRNA子集中,作者根据BSJ读取计数选取了20种在人类或小鼠脂肪组织中表达最高的circRNA,以及脂肪最富集的15种circRNA。由于PCR的检测限制,使长度小于90bp的circRNA被排除在外,最终仅得到含41个候选circRNA的集合。随后,作者设计并合成可以特异性扩增circRNA的发散引物,进行逆转录PCR(RT-PCR),成功地在小鼠脂肪组织中检测到37个候选circRNA的反向剪接。对于每个候选基因,凝胶提取预期大小的条带,并通过Sanger测序确认其头尾剪接序列。
为了确认反向剪接序列是否确实反映环状结构或仅仅是由基因组串联重复或外显子重组衍生的线性连接体,作者对其中10个circRNA进行RNase R处理的RT-PCR分析,显示他们均存在RNase R抗性,这表明他们确实具有环状结构。因此,在分析中检测反向剪接序列是证实这些转录本环状结构的可靠指标。
接下来,作者将验证预测结果是否可以真正反映circRNA在体内的表达水平。作者使用BSJ特异性引物的实时定量-反转录PCR (RT-qPCR),来量化12个推定的脂肪富集的circRNA在不同小鼠器官和脂肪库中的相对丰度,包括circAbca1-2、circCrim1-2、circHspa4-3、circMap2k1-1、circMed13l-1、circPhkb-2、circSkap2-1、circTshz2-1、circAsph-9、circHipk3-1、circNfix-2和circOgdh-2。12个circRNA均优先在棕色脂肪组织(BAT)和/或WAT中表达。与circRNA相比,他们的线性同源物的分布在不同组织之间表现出更大的分散性,并在脂肪中特异性更低。这与先前的发现相符,即除其宿主基因的转录活性外,circRNA的组织特异性表达还受其他调控层的调控。作者还检测了预计不会在脂肪中富集的十种circRNA的相对丰度,不出所料,这些circRNA及其线性同源物均未显示出明确的脂肪特异性表达。
为了确定候选circRNA的亚细胞定位,作者分离了腹股沟脂肪的胞核和胞质部分,并通过RT-qPCR来定量其中circRNA的相对丰度。大多数候选circRNA主要在胞质中表达,这可能与他们的功能相关。此外,由于脂肪组织由多种细胞类型组成,因此作者探索这些circRNA在成熟脂肪细胞中的表达与基质血管部分(SVF)的关系,以确定他们的分布。结果表明,大多数circRNA在成熟的脂肪细胞中优先表达。
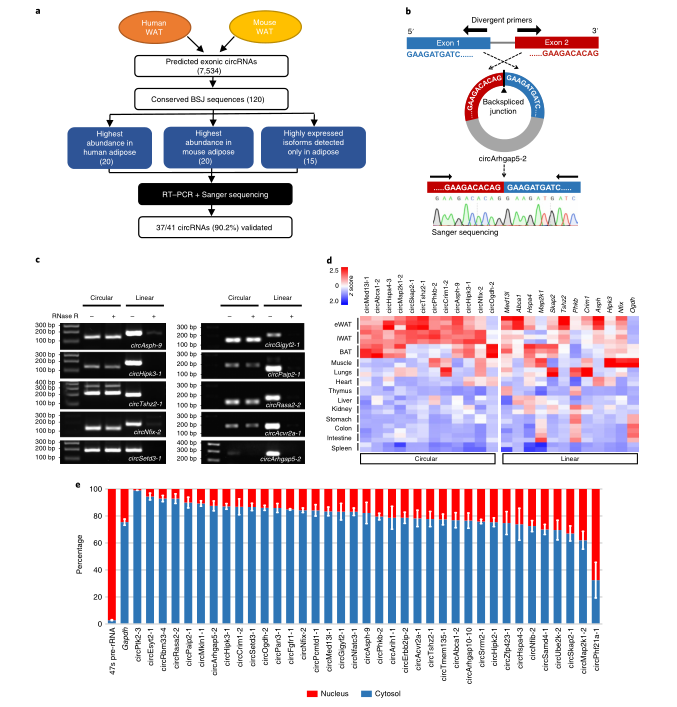
图2 脂肪circRNA的验证、组织特异性和细胞定位
3、circRNA在脂肪细胞分化过程中表达上调
为了检测作者之前验证的circRNA在脂肪形成过程中的转录变化,在不同的时间点收集了化学诱导分化的原代小鼠前脂肪细胞的总RNA,通过RT-qPCR来定量整个时间过程中circRNA及其同源线性转录物的表达水平。在脂肪形成过程中,大多数circRNA(31/37)显示出2倍以上的上调,这与线性mRNA水平的升高密切相关。
为了量化分化过程中环形和线性转录本的共表达,作者计算了整个时间过程中每个circRNA-信使RNA对的Pearson相关系数(PCC)。所有circRNA的表达均与其同源线性转录物呈正相关,37个circRNA中的32个(86.5%)显示r> 0.6,37个circRNA中的18个(48.6%)显示r> 0.9的强相关阈值。因此,结果表明,成脂过程中circRNA的动态表达变化很大程度上取决于其宿主基因的转录调控。有趣的是,有六种circRNA–mRNA对在环状和线性转录本之间表现出截然不同的表达模式(circAbca1-2、circArih1-1、circArhgap5-2、circNfib-2、circPhkb2-1和circTshz2-1)。与相对静止的同源mRNA相比,这些circRNA的积累速度要快得多。因此,除了circRNA的低衰减率之外,调节pre-mRNA反向剪接的阶段特异性因子可能会驱动独立于线性mRNA的环状异构体的产生。
4、circRNA在饮食诱导的肥胖中表达下调
接下来,作者通过比较高脂饮食(HFD)和正常饮食C57BL/6小鼠脂肪组织中circRNA的表达差异,来评估肥胖对体内circRNA表达的影响,以经典肥胖模型中分别上调和下调的脂肪因子瘦素和脂联素的表达作为对照。值得注意的是,在HFD条件下,观察到37个circRNA中有33个在附睾WAT中显著下调,其中19个具有统计学意义。在HFD小鼠的腹股沟皮下脂肪组织中circRNA也有类似的下降趋势。对于内脏脂肪,线性mRNA通常随着circRNA丰度的降低而下调。有趣的是,在腹股沟脂肪中,这些mRNA中的大多数以相反的方式上调,与下调的circRNA相反。因此,HFD对皮下脂肪circRNA的调控不能完全归因于宿主基因转录活性降低,应在转录后水平存在额外的调控机制。
考虑到circRNA在肥胖中的普遍下调,作者随后将研究的重点放在调控circRNA的机制中。过度肥胖通常会导致单核细胞和其他免疫细胞募集到脂肪库中,从而释放细胞因子来激活慢性炎症。肿瘤坏死因子-α(TNF-α)是一种重要的促炎细胞因子,肥胖时其水平明显升高。因此,作者测试了肥胖中TNF-α诱导的脂肪细胞炎症是否参与调控circRNA的异常表达。在可溶性TNF-α(sTNF-α)处理分化的原代小鼠皮下脂肪细胞24小时后,发现37种circRNA中有31种circRNA表达降低,其中19种显示出明显降低。有趣的是,circRNA的倍数变化与其线性同源转录物的相关性很差(R2=0.034),只有少数mRNA在sTNF-α处理后显著下调。因此,成熟脂肪细胞中炎症通路的激活有助于肥胖对circRNA表达的抑制作用,提示炎症可能对circRNA的生成具有转录后影响。
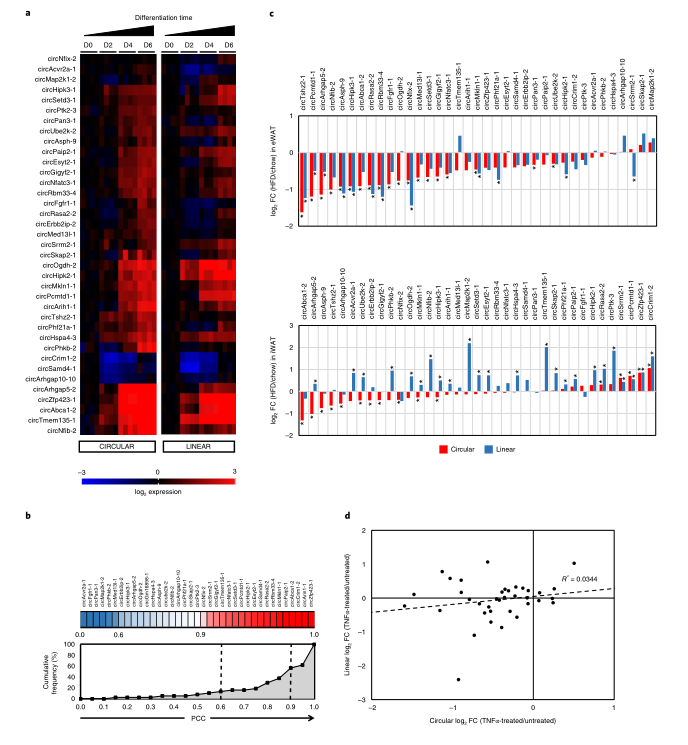
图3 circRNA在脂肪形成和肥胖过程中的表达
5、circTshz2-1和circArhgap5-2对于脂肪形成必不可少
为了探索circRNA在脂肪形成过程中的功能,作者使用RNAi技术来敲低circTshz2-1和circArhgap5-2,这两个候选circRNA在分化过程中相对于其线性同源转录本高度上调,线性mRNA在分化过程中没有明显变化。在小鼠和人类的保守的circRNA子集中,circTshz2-1和circArhgap5-2分别在脂肪中高度富集。
circTshz2-1是一种有方向感的环状转录本,起源于teashirt锌指同源盒2(Tshz2)基因座 ,该基因是来自参与癌症进展和胚胎发育的转录因子蛋白家族的保守基因。circTshz2-1包含其线性同源转录物外显子2的第一个2,934 bp,BSJ临近于外显子2的5’端和下一个传统外显子-内含子边界上游的3’内部剪接位点。原代白色脂肪细胞分化的第6天(D6),circTshz2-1丰度增加了四倍,而Tshz2 mRNA的水平保持相对不变。
作者设计并合成了三个靶向不同转录本的Dicer底物小干扰RNA(DsiRNA):si-circ仅与环状转录本的BSJ结合,si-lin与未纳入circRNA的3’UTR序列互补,仅靶向circRNA的线性同源转录本,si-circlin与环状和线状转录本共有的外显子区域相结合,从而敲低这两种转录本。将DsiRNA转染原代小鼠白色前体脂肪细胞中,RT–qPCR验证了分化前后circTshz2-1和Tshz2 mRNA的敲低效率。
为了评估circRNA缺失对脂肪形成的影响,作者通过亲脂荧光团BODIPY 493/503和油红O(ORO)染色成像来观察脂滴(成熟脂肪细胞的标志)的积累。si-circ和si-circlin会抑制脂滴的累积,而单独敲低Tshz2 mRNA则没有这种抑制效应。此外,RT-qPCR分析显示,si-circ和si-circlin而非si-lin抑制了成脂标记物Pparγ、AdipoQ、C /ebpα和Fabp4的表达。值得注意的是,低丰度环状异构体circTshz2-2源自Tshz2的全长外显子2,但他的表达不受circTshz2-1基因敲低的影响。因此,抗分化表型是circTshz2-1沉默所特有的。
作者同样应用RNAi技术,来探索另一个候选基因circArhgap5-2对脂肪细胞分化的影响。circArhgap5-2是由其线性转录本的整个外显子1和2的反向剪接生成,Arhgap5 mRNA可以编码调节性Rho GTPase激活蛋白5(Arhgap5)。理论上,circRNA可以包含或排除插入的内含子序列。为了推测其结构,作者设计了两组引物来特异性地扩增仅含外显子和保留内含子的circArhgap5-2亚型。为了检测仅含外显子的结构,作者使用与上游外显子的5’(反向引物R)和3’(正向引物F1,F2,F3)远端相对应的不同发散引物进行RT–PCR,来扩增仅含外显子的circArhgap5-2。同样,为了检测保留内含子的circRNA亚型,作者将反向引物R与另一组与内含子序列互补的正向引物(F4,F5,F6)相配对。结果显示,仅外显子引物扩增了预期大小的PCR产物,内含子引物并没有扩增出可检测的条带,从而证实了circArhgap5-2是一个仅含外显子的4,037-bp大小的环状结构。
原代白色脂肪细胞分化的第6天(D6),circArhgap5-2 水平增加了33倍,其同源线性转录物水平仍然保持稳定。与circTshz2-1相似,作者利用DsiRNA特异性地敲低原代脂肪细胞分化前后的circArhgap5-2及其同源线性转录物,敲低效率使用RT-qPCR证实。si-circ和si-circlin敲低sircArhgap5-2会导致脂滴积聚明显受到抑制,并显著下调成脂标志物的表达,而si-lin单独敲低线性转录本并不能抑制脂肪细胞分化。综上所述,作者的体外研究结果证明了circRNA候选物在脂肪形成调控中的功能作用。
在circArhgap5-2的RT-PCR分析中,作者观察到了circRNA的一个较短异构体circArhgap5-1,它是由Arhgap5外显子1的反向剪接形成。作者想知道circArhgap5-2的敲低是否会影响circArhgap5-1的表达。使用异构体特异性引物,证明了siRNA介导的circArhgap5-2敲低不会显着影响circArhgap5-1水平。此外,用异构体特异性DsiRNA沉默circArhgap5-1也不会影响circArhgap5-2的表达,只会导致成脂标志物的轻度抑制。因此,脂肪形成受阻主要是由于circArhgap5-2的缺失。
接下来,想知道哪个成脂阶段受circArhgap5-2和circTshz2-1敲低的影响,作者在前脂肪细胞转染了DsiRNA,然后在细胞分化过程中的不同时间点检测成脂标记物的水平。在前脂肪细胞阶段和成脂早期(直到D1),基因敲低对成脂标志物没有影响。只有在D2时,细胞才开始表现出明显的成脂标志物表达缺陷。因此,这些环状RNA是在分化中期开始驱动脂肪生成。
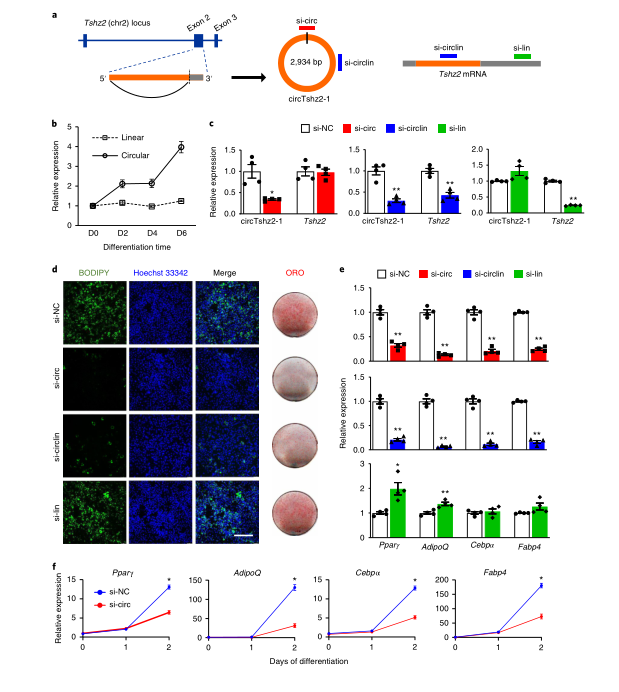
图4 敲低circTshz2-1会抑制脂肪形成
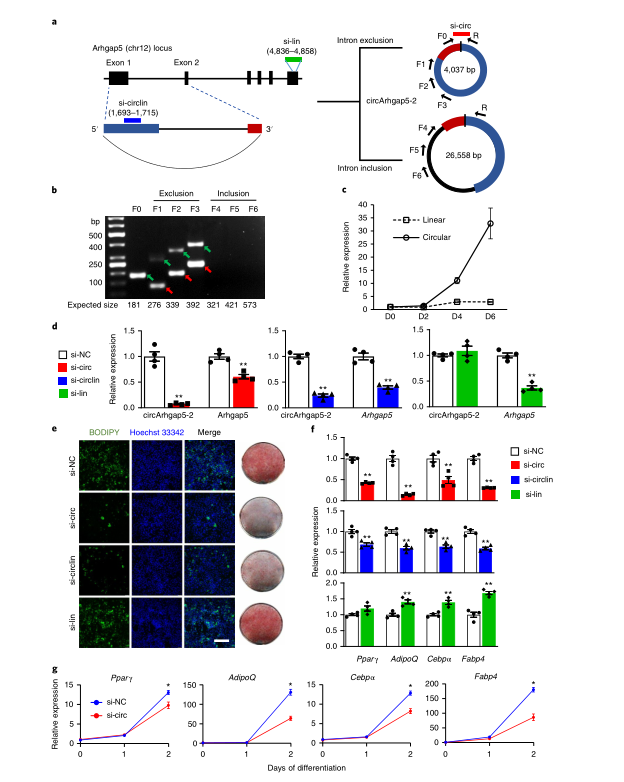
图5 敲低circArhgap5-2会抑制脂肪形成
6、circArhgap5-2维持脂肪细胞的整体基因程序
现在,作者想要评估circArhgap5-2是否在维持成熟脂肪细胞的成脂基因程序中起着关键作用。作者使用靶向circArhgap5-2 BSJ的腺病毒shRNA(sh-circ)转染分化的脂肪细胞(D4),与阴性对照(sh-NC)相比,转染后2d显示出>70%的基因敲低效率,且不影响Arhgap5 mRNA水平。然后,作者对脂肪细胞样本进行poly(A) RNA-seq,随后进行基因集富集分析(GSEA)。sh-circ和sh-NC之间差异表达基因的排序列表被用作查询MSigDB标志性基因集的预先排序的GSEA运行的输入。脂肪酸代谢和脂肪生成是下调最严重的功能途径,这表明成熟脂肪细胞中circArhgap5-2的缺失会导致脂肪细胞转录程序的整体抑制。与之一致的是,在circArhgap5-2敲低后,脂肪细胞的关键标志物(Pparγ、 AdipoQ、 C/ebpα、 Fabp4、Glut4和Lipe)在转录和蛋白水平上均相应降低,尽管没有检测到对脂质积累的明显影响。总之,circArhgap5-2对于成熟脂肪细胞在体外维持其基因表达程序是必不可少的。
接下来,作者将检测circArhgap5-2是否同样在体内维持脂肪细胞的基因程序。作者将腺病毒shRNA注射到8周大的C57BL/6 小鼠的腹股沟脂肪垫中,在转染后7d,观察到所有重复组中circArhgap5-2的敲低效率均大于70%。对三重对照和sh-circ组的脂肪组织样品进行mRNA-seq,随后再进行差异表达和DAVID通路分析。与体外结果一致,许多显著下调的基因与脂肪生成相关,下调最明显的基因与脂肪细胞的关键代谢和合成代谢功能相关。上调最显著的基因与炎症途径相关。RT-qPCR和western blotting证实敲低circArhgap5-2会导致脂肪细胞标志物 Fabp4和Pparγ的表达降低,并在转录水平上诱导炎性标志物F4/80、Itgam和Il6的表达。经sh-circ感染的脂肪组织染色显示,脂滴大小减小,反映脂质代谢紊乱。总之,作者的发现证实了circArhgap5-2是维持体内成熟脂肪细胞关键特征不可或缺的调节因子。
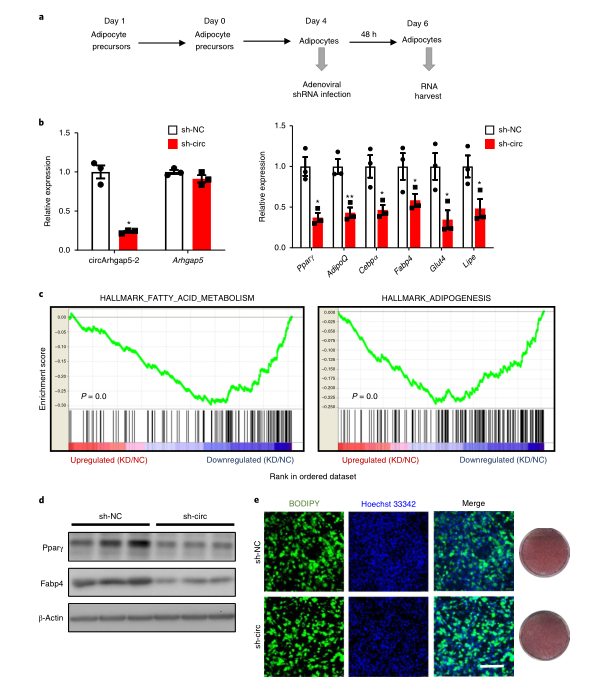
图6 circArhgap5-2维持整体成脂基因程序
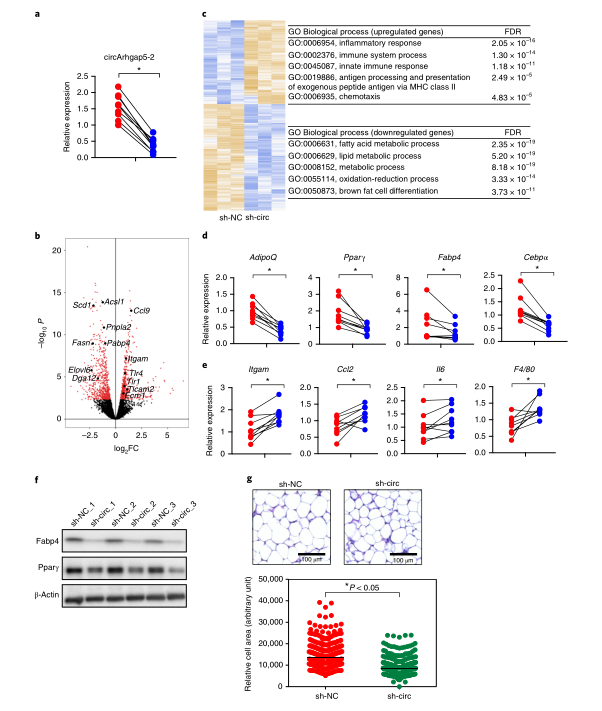
图7 体内敲低circArhgap5-2可下调成脂基因表达
7、circArHGAP5-1的促成脂功能在小鼠和人脂肪细胞之间保守
circArHGAP5-1是circArhgap5-2的一个同源环状转录本,作者的数据显示,它为人类脂肪中第13高表达的保守异构体。circARHGAP5-1的BSJ来自经典pre-mRNA的外显子2和3的反向剪接,它们与小鼠同源物中环化的两个相同外显子具有93.5%的序列同源性。相应地,BSJ也高度保守(50bp范围内94%的同源性)。与小鼠中观察到的结果相反,在人类白色脂肪细胞分化过程中,circARHGAP5-1的表达没有明显变化。作者想要确定它在脂肪形成中的重要作用是否保守。作者使用靶向circARHGAP5-1 BSJ的慢病毒shRNA(hsa-sh-circ)来进行敲低,在永生的人白色脂肪祖细胞分化前后,观察到circARHGAP5-1的敲低效率均>70%。值得注意的是,作者发现敲低circARHGAP5-1会显著下调脂肪细胞标志物(PPARγ、 FABP4、 GLUT4和CIDEA)的表达,这表明敲低circARHGAP5-1可显着抑制脂肪生成和脂质堆积。总之,circARHGAP5-1的促成脂功能在小鼠和人脂肪细胞之间保守。
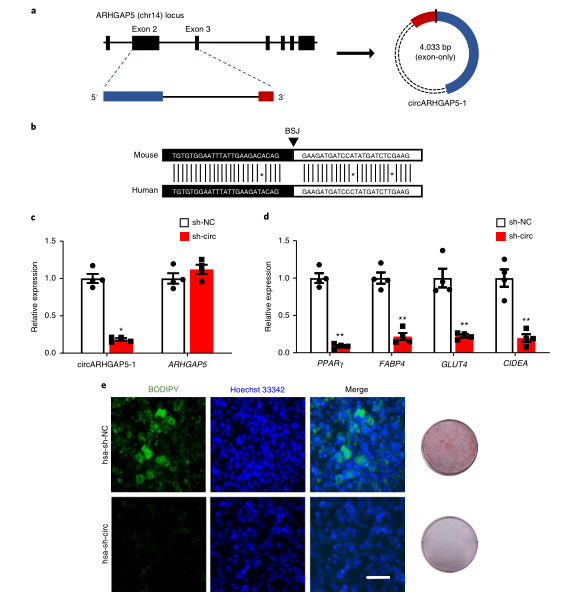
图8 circARHGAP5-1功能在人体脂肪细胞中保守
8、circArhgap5-2不能作为miRNA海绵分子
有研究表明,circRNA可以海绵吸附miRNA,从而阻止miRNA对靶标mRNA的沉默效应。circArhgap5-2序列包含多个miRNA结合位点,作者推测它可能通过海绵吸附抗成脂miRNA而发挥作用。
假如circRNA可以海绵吸附miRNA,它的缺失将导致游离miRNA的增加,促进其对下游靶基因的沉默,进而影响靶基因表达。如果,circArhgap5-2的缺失不能显著影响其预测结合的miRNA的靶基因表达,则不应认为它是miRNA海绵。利用TargetScanMouse数据库,作者鉴定出43种保守性不同的miRNA,对应于circArhgap5-2内的66个种子序列结合位点,并分别为这43种miRNA提供相应的靶标mRNA。使用脂肪组织circArhgap5-2敲低的mRNA-seq数据集,作者绘制了每个miRNA的所有靶mRNA的表达变化倍数的累积分布,并与所有其他转录本的参考分布进行比对。作为阳性对照,作者将之前的操作应用于已发表的转染miR-155的HeLa细胞数据集,并观察到其靶标mRNA累积分布曲线的预期左移,证实miR-155对这些mRNA的抑制作用。然而,circArhgap5-2缺失并没有影响43种miRNA的所有靶标mRNA分布。随后,作者对成熟脂肪细胞的体外基因敲除数据集进行了类似的分析,得到了同样的否定结果。
此外,证实circRNA作为miRNA海绵分子,需要证明circRNA与RISC的核心蛋白Argonaute-2(AGO2)之间的互作。作者使用AGO2抗体进行RNA免疫沉淀,然后用RT-qPCR检测AGO2是否可以下拉circArhgap5-2。在AGO2下拉的几个RNA中,并没有检测到circArhgap5-2,这表明两者之间没有相互作用。综上所述,circArhgap5-2不太可能通过海绵吸附miRNA来调控脂肪形成。
9、circArhgap5-2不能编码肽
在排除miRNA的海绵化机制后,作者探索circArhgap5-2是否像早期的circRNA研究所报道的那样编码新的功能肽。circArhgap5-2含有一个假定的开放阅读框,可能会编码肽。作者在原代培养的脂肪细胞中进行多核糖体图谱分析,以确定circArhgap5-2和circTshz2-1是否与核糖体相关联。虽然Srebp1仅存在于多核糖体组分中,但没有类似地检测到circArhgap5-2和circTshz2-1,表明circArhgap5-2和circTshz2-1并没有被翻译。
参考文献:
[1] Arcinas C, Tan W, Fang W, et al. Adipose circular RNAs exhibit dynamic regulation in obesity and functional role in adipogenesis. Nat Metab. 2019, 1(7):688-703. doi:10.1038/s42255-019-0078-z
.png)