2020年6月10日,郑州大学第一附属医院的殷德涛、刘金波和孙振强为共通讯作者在Molecular Cancer(IF=10.679)杂志上发表了一篇题为“The role of N6-methyladenosine (m6A) modification in the regulation of circRNAs”的综述,总结了m6A修饰在circRNA调控和功能中的作用。此外,还讨论了该领域的潜在应用和未来方向([1])。

N6-甲基腺苷(m6A)是真核细胞中RNA最丰富的修饰方式,可调节RNA的转录、加工、剪接、降解和翻译。环状RNA(circRNA)是一类单链共价闭合的RNA分子,以进化的普遍性、多样性、稳定性和保守性为特征。越来越多的证据表明,m6A修饰和circRNA均涉及到多种疾病的发病机制,如癌症、神经疾病、自身免疫性疾病和不孕不育。最近,已发现富集的m6A修饰具有调节circRNA生物学功能的重要作用。在这篇综述中,作者总结了m6A修饰在circRNA调控和功能中的作用。此外,还讨论了该领域的潜在应用和未来方向。
1 m6A的Writer、Eraser和Reader
m6A的调控功能主要由“Writer”、“Eraser”和“Reader”三种不同功能的酶调控。功能上,Writer、Eraser和Reader分别介导m6A的修饰、去修饰和读取识别。m6A的Writer是参与甲基转移酶复合物形成的蛋白质,包括甲基转移酶样3和14蛋白(METTL3和METTL14)及其辅助因子WT1相关蛋白(WTAP)、RNA结合基序蛋白15 / 15B(RBM15 / 15B)、VIRMA和ZC3H13。METTL3作为发现最早和最广为人知的组分,是一种S-腺苷甲硫氨酸(SAM)结合蛋白,并在多种真核生物中高度保守。值得注意的是,METTL3除了以复合物的形式发挥Writer功能外,METTL3的同系物(METTL16)已被鉴定为一种新的独立RNA甲基转移酶,它可以调节细胞SAM水平和甲基化U6小核RNA。
m6A修饰的动态可逆过程也依赖于某些去甲基酶(Eraser)。脂肪和肥胖相关蛋白(FTO)是首次发现催化m6A去甲基化的蛋白质,它通过与自身同源物(ALKBH5)合作来维持转录组中m6A水平的平衡。ALKBH3是新发现的一种去甲基化酶,相比mRNA或rRNA,更倾向于在tRNA上执行其去甲基功能。此外,ALKBH3也是一种公认的DNA修复酶,并有可能作为肿瘤的分子标志物。m6A修饰的RNA需要一类可变的RNA结合蛋白作为Reader,从而执行特定的生物学功能。YT521-B同源性(YTH)结构域家族的蛋白质,包括YTHDC1、YTHDC2、YTHDF1、YTHDF2和YTHDF3,它们具有保守的m6A结合域,是人类中前五个特征化的m6A Reader。异质核糖核蛋白(HNRNP)家族是另一类可作为m6AReader的RNA结合蛋白(RBP)组。异质核核糖核蛋白A2 / B1(HNRNPA2B1)可特异性识别m6A修饰的RNA,并在m6A依赖的核RNA加工中充当调节分子。相反,HNRNPC和HNRNPG不能直接与m6A位点结合,但它们可以通过识别结合m6A依赖的结构开关来介导含有m6A修饰转录本的选择性剪接过程。翻译起始因子3(eIF3)通过与mRNA 5‘-UTR中m6A结合来启动翻译过程,胰岛素样生长因子2 mRNA结合蛋白(IGF2BP,包括IGF2BP1/2/3)通过m6A依赖性方式使靶基因和相应的翻译更加稳定。此外,富含脯氨酸的卷曲螺旋2 A(Prrc2a)是一种新型m6A Reader,通过m6A依赖性方式结合于编码序列(CDS)的GGACU基序来稳定mRNA表达。
m6A修饰的动态可逆性与机体的正常生理活动密切相关。研究表明,m6A修饰的mRNA或非编码RNA(主要是miRNA和lncRNA)在精子发生、T细胞稳态,果蝇性别选择、热休克反应、重编程和多能性以及其它过程中起关键作用。考虑到m6A修饰在调节基因表达和各种生物学功能中的重要性,m6A水平失调会导致多种疾病,特别是对某些癌症。最近有研究表明,在急性髓系白血病(AML)、肝细胞癌(HCC)、胶质母细胞瘤干细胞(GSC)、乳腺癌、肥胖、不孕、自身免疫性疾病和神经疾病中,可检测到m6A修饰异常和m6A调节蛋白的异常表达。
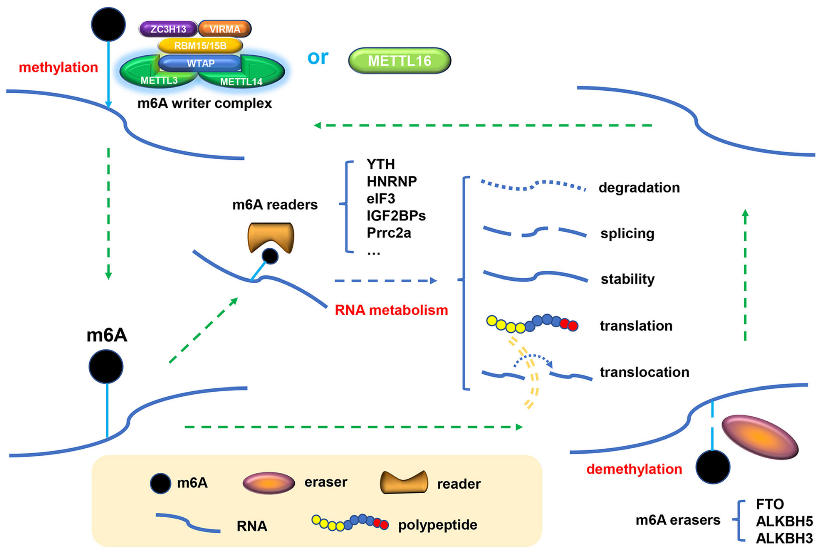
图1 动态可逆的m6A修饰过程
2 circRNA的特性、调控机制及其生物学功能
根据来源,可以把circRNA可分为四大类:外显子circRNA(EcircRNA)、内含子circRNA(ciRNA)、外显子-内含子circRNA(EIciRNA)和其它circRNA,可来源于病毒、tRNA、rRNA和snRNA等。circRNA分布广泛,可以在大多数生物中检测到circRNA,包括古细菌、植物、寄生虫和大多数哺乳动物。先前有研究表明,在人类成纤维细胞中,有超过25,000种不同的RNA可以产生相应的circRNA。此外,同一基因还可以通过交替环化产生不同的circRNA,从而导致circRNA的多样性。另一个重要特征是,circRNA对核酸外切酶存在抗性,因此它们比线性RNA更加稳定。不同物种之间的同源性研究表明,circRNA在物种之间的进化中高度保守。人和小鼠的circRNA同源性水平达到20%或更高,而猪和小鼠的circRNA同源性在15%至20%之间。最后一个也是最实用的一个特征是,circRNA的表达水平在不同组织和不同生长阶段中有所不同,这也是理想疾病生物标记物的基本特征。人和小鼠不同组织的表达谱表明,神经组织(尤其是脑组织)比其它组织含有更丰富的环状RNA,并且随着脑的发育,circRNA的表达水平逐渐上升。
在挖掘circRNA特征的基础上,越来越多的研究集中于circRNA的调控机制。最典型的作用机制是circRNA作为竞争内源性RNA(ceRNA)来执行特定功能。含有miRNA反应元件(MRE)的circRNA可以与特定的miRNA结合,来负向调节miRNA活性,因此circRNA也被称为“miRNA海绵”。第一个被定义为“ miRNA海绵”的circRNA是ciRS-7,在2013年,由Thomas B团队在人和小鼠的大脑中首次发现。 此外,circRNA还可以与某些RBP相互作用来执行特定的生理功能。在大多数情况下,这些circRNA充当“分离剂”的作用来抑制RBP的功能或转运。circEIF3J和circPIAP2主要定位于细胞核,它们可以与U1 snRNP相互作用来促进其亲本基因的转录。有趣的是,一些位于胞质的circRNA也同样具有相似的蛋白结合能力。circFoxo3可以与DNA结合抑制因子1(ID-1)、E2F转录因子1(E2F1)、粘着斑激酶(FAK)和缺氧诱导因子1亚基α(HIF1-α)相互作用,将这些组分一起保留在胞质中。最近有研究表明,某些circRNA可以翻译成蛋白质。在没有游离5‘端的情况下,circRNA的翻译不能由传统的帽子依赖性调控元件启动,因此需要内部核糖体进位点(IRES)或其它元件来激活非帽子依赖性的翻译途径。为了支持这一假设,Wanget等人在circRNA中设计了IRES,然后成功地在293T细胞中检测到由该circRNA翻译的相应蛋白。最近,其它研究发现,m6A修饰在许多circRNA中大量存在,这种甲基化修饰能够以类似于IRES的方式驱动circRNA翻译。
虽然circRNA研究还处于起步阶段,但已证实circRNA与各种疾病的发生、发展和预后密切相关。最近有研究表明,在各种癌症、神经心理疾病、
自身免疫性疾病、不育症、糖尿病、肾病和关节炎等疾病中存在circRNA的表达失调,但是在这些失调的circRNA中只有少数具有生物学功能。一些研究认为这可能与circRNA的表观遗传修饰有关,其中m6A修饰是被最先考虑的因素。
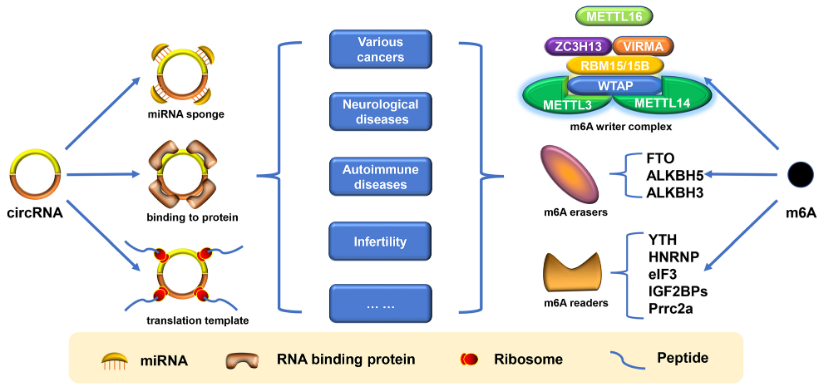
图2 circRNA和m6A修饰在多种疾病中的作用
3 m6A修饰在circRNA调控中的作用
目前的研究表明,m6A失调会导致多种疾病,尤其是某些癌症。一般来说,m6A具有双向调节作用。在多数情况下,m6A失调有助于肿瘤的发生和进展。然而,最近的研究表明,m6A水平异常也会导致肿瘤抑制。因为m6A主要通过影响RNA代谢来发挥功能,近年来,多数研究的注意力都集于m6A修饰的mRNA上,很少有研究涉及m6A修饰的ncRNA,特别是circRNA。在这里,作者总结了m6A修饰在circRNA调控和功能中的作用。
3.1 m6A修饰调控circRNA翻译
最近的研究表明,某些circRNA具有蛋白编码潜力,并且翻译过程可以由m6A驱动。通常,真核细胞的RNA翻译需要真核翻译起始因子4F(eIF4F)复合物的参与,它由三个启动因子组成:eIF4A(解旋酶蛋白)、eIF4E(m7GReader)和eIF4G(支架蛋白)。在mRNA上,这些转录起始元件定位于5’端的帽子结构,因此将其定义为帽子依赖性途径。由于缺乏游离的5’末端,这种传统的帽子依赖性途径在闭合环状转录物中不起作用。因此,一些非帽子依赖性翻译启动机制被提出来,如IRES依赖性途径和m6A依赖性途径,用于解释一些circRNA的蛋白编码潜力。IRES是介导核糖体和RNA结合从而启动翻译的序列。据报道,由IRES驱动的circRNA翻译包括,在肌肉生成中的circZNF609 、在胶质瘤发生中的circSHPRH和circFBXW7、蝇头提取物中的circMbL和在肝癌生长中的circβ-catenin。
然而,Yang等人最近的一项研究开阔了人们对人类转录组编码领域的认知。在细胞对环境压力的反应中,证实了m6A驱动的翻译途径。在这项研究中,检测到包含m6A模序的circRNA被翻译,并验证了翻译效率由m6A水平调控。从机制上讲,m6A驱动的翻译是由eIF4G2和m6AReaderYTHDF3启动,它可以被甲基转移酶METTL3 / 14增强,而被去甲基酶FTO抑制。此外,还检测了一些内源性circRNA的m6A水平,结果表明circRNA中的m6A模序十分丰富。就整个人类转录组而言,具有编码潜能的circRNA存在
m6A修饰并不罕见。最后,选择circRNA反向剪接区域编码的33个内源肽段进行功能分析。遗憾的是,尽管这些circRNA在面对细胞应激时的翻译效率确实有所提高,但并未检测到功能的富集。
值得注意的是,这两个非帽子依赖性翻译途径可能不是独立的发挥作用。Legnini等人重新分析了成肌细胞中m6A-Seq和免疫沉淀数据,并将这些数据与其它m6A免疫沉淀(IP)结果相结合。结果表明,在IRES驱动的蛋白编码circRNA circZNF609中检测到m6A的富集,这表明两个非帽子依赖性途径可能存在相互联系。
3.2 m6A修饰促进circRNA降解
由于闭合环状结构,circRNA比其亲本线性RNA更加稳定,因为它们不是外来化学物质或核酸外切酶的主要靶标。许多circRNA表征有关的研究已证实这一点。然而,circRNA是如何被降解,以及什么因素会调控其降解途径,在很大程度上还不清楚。以前有研究表明,具有大约完全互补miRNA靶点的circRNA可以通过Ago2依赖性方式进行降解,但是这种方式并不适用于没有miRNA海绵功能或特殊miRNA靶点的circRNA。另一项研究发现,GW182的缺失会导致内源性环状转录本的积累。遗憾的是,GW182对circRNA的核转运影响不大,它在细胞质中的功能也未完全阐明,因此需要其它研究来解释circRNA的降解。
内切酶切割途径是m6A驱动RNA降解的途径之一。circRNA作为非编码RNA研究领域中的一颗新星,m6A修饰的circRNA可以通过YTHDF2-HRSP12-RNaseP/MRP轴被核酸内切酶所降解。HRSP12是介导YTHDF2(m6AReader蛋白)和RNase P / MRP(核酸内切酶)形成YTHDF2-HRSP12-RNase P / MRP复合物的衔接蛋白,其中以YTHDF2作为指导。当YTHDF2识别m6A修饰的circRNA时,无论其是否占据HRSP12结合位点,RNaseP / MRP都始终执行其核酸内切酶功能。HRSP12结合位点存在的唯一差别是,它极大地提高了核酸内切酶的切割效率。随后,m6A修饰的circRNA被选择性下调,随之而来的是circRNA生物学功能的变化。因此,可以得出结论,m6A可以通过调节circRNA降解来影响其生物学功能。
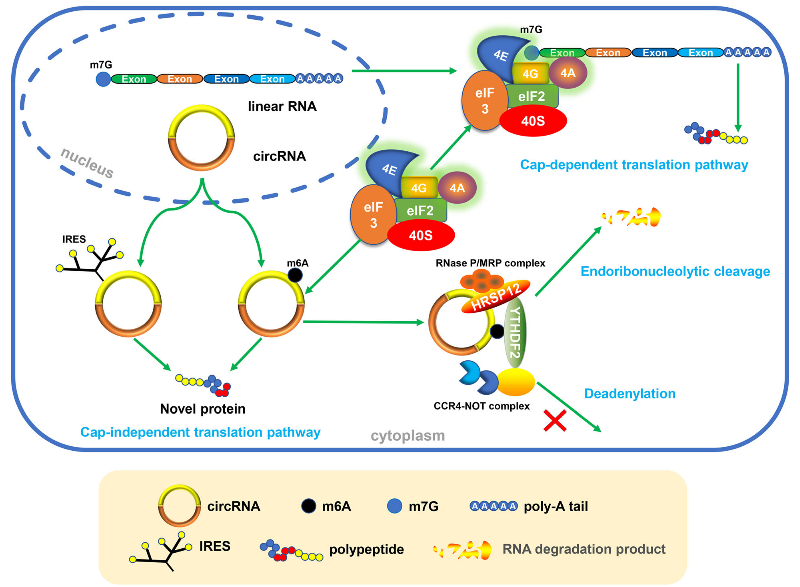
图3 m6A修饰可调节circRNA的翻译和降解
3.3 m6A修饰的circRNA在先天免疫中的作用
先天免疫(又称非特异性免疫)是机体在发育和进化过程中形成的天然免疫防御能力。它在控制和解决组织损伤的炎性反应中起着决定性作用。最近的一项研究发现,先天免疫可以由外源性和内源性RNA不同地激活。由RNA聚合酶II直接产生的所有转录本均带有m7G帽,RIG-I(也称为DDX58)可以在它的5’端感应到三磷酸,这也是免疫监控的基本要素。由于闭合环状结构,circRNA被认为能够从终端监控系统中逃逸。然而,最近的研究表明,一些外源性circRNA的入侵仍然会导致强有力的先天免疫反应,从而对病毒感染起到保护作用,而内源性circRNA会形成16-26 bp不完全配对的RNA双链以抵抗天然免疫中的双链RNA(dsRNA)活化蛋白激酶(PKR)。这里有一种解释来描述免疫系统如何将内源性和外源性circRNA相区分,即免疫系统通过m6A修饰来区分内源性和外源性circRNA。
Y. Grace等人的研究显示,由ZKSCAN1内含子产生的circRNA(circSELF),不同于circFOREIGN,不能进行自动剪接,它的产生与WTAP和KIAA1429(m6AWriter)以及YTHDF2和HNRNPC(m6AReader)相关。进一步的研究发现,这两个circRNA中存在不同水平的m6A修饰,高丰度的m6A修饰存在于circSELF中。circSELF可以通过YTHDF2介导的抑制来逃避先天免疫监视,这与最近的一项研究结果一致,该研究表明YTHDF蛋白可以募集m6A修饰的RNA,并通过其N端无序结构域来诱导其进入相分离凝析油中。这些结果表明人circRNA可以被共价m6A标记,这对于逃避先天免疫监视是至关重要。
3.4 m6A修饰的circRNA在肿瘤中的作用
由于m6A和circRNA都与肿瘤密切相关,很自然地推测,m6A修饰可能调节多种肿瘤中circRNA的功能。在此,作者简要回顾了m6A修饰的circRNA与肿瘤相关的最新研究。
作为全球发病率第三和死亡率第二的恶性肿瘤,大肠癌是人类健康的主要威胁,尤其是在中国。临床上,大肠癌的肝转移是最常见的器官转移,会导致5年以上的预后不良。最近,Chen等人发现,circNSUN2的m6A修饰通过促进其胞质输出并形成circNSUN2 / IGF2BP2 / HMGA2 RNA-蛋白质三元复合物来稳定HMGA2 mRNA,从而促进大肠癌的肝转移。HMGA2,一种高迁移族AT-hook 2,已被广泛证实与大肠癌的发展相关。这些结果阐明m6A修饰可以影响circRNA和RBP之间的相互作用。
宫颈癌是妇科常见的癌症,预后相对较差,几乎所有的宫颈癌都是由致癌型人乳头瘤病毒(HPV)引起的。circE7是由HPV产生的一种可编码癌蛋白的circRNA,它与CaSki宫颈癌细胞的体内外生长密切相关。有趣的是,m6A修饰被检测到并证实它是circE7蛋白编码的必要基序,这与上述提及m6A修饰促进circRNA翻译和帮助外源circRNA逃避免疫监视的观点相一致。此外,circE7并不是m6A修饰的特殊例子。另一项研究在人类胚胎干细胞(hESC)中鉴定了1000多种经m6A修饰的circRNA,同时表明在HeLa细胞中m6A修饰的circRNA也很丰富,这表明m6A修饰具有广泛的调控作用。
除了直接修饰circRNA,m6A还可以通过改变下游分子的甲基化状态来影响circRNA功能。作为Hippo途径下游的主要效应因子,YAP与各种肿瘤的发生和发展密切相关。在肝细胞癌中,circ_104075可以吸附miR-582-3p,从而减轻其对YAP的抑制,进而促进肿瘤的发生。YAP 3‘-UTR的m6A修饰可以促进其与miR-382-5P的相互作用,进而抑制YAP表达。之后,circ_104075对肝细胞癌的促进作用被抑制。此外,m6A水平、IRES和开放阅读框(ORF)组合的生物信息学预测可以表明,circPVRL3在胃癌中的蛋白编码潜力。
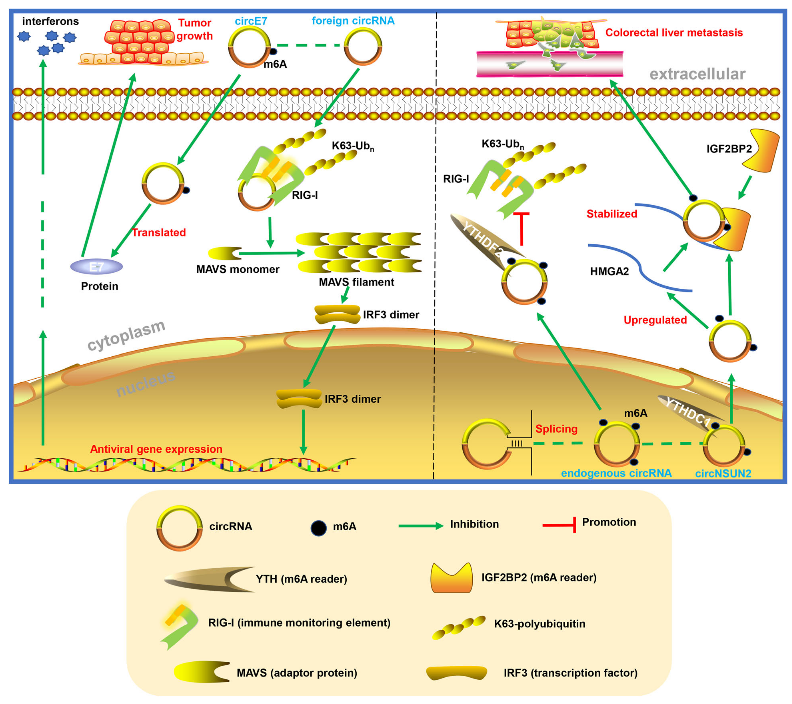
图4 m6A修饰的circRNA在先天免疫和肿瘤中的作用
4 m6A修饰的circRNA应用及未来发展方向
考虑到circRNA结构的稳定性和保守性,它作为诊断生物标志物和治疗靶点的潜力是毋庸置疑的,近年来越来越多的circRNA相关研究也支持了这一点。然而,表观遗传修饰和circRNA功能之间的关系在很大程度上仍不清楚。作为最丰富的RNA修饰之一,m6A为我们提供了一种中间机制,通过该机制,circRNA被上游分子调节,并使我们能够预测和干扰circRNA失调引起的疾病进展。毫无疑问,这将极大地扩展我们对circRNA的理解并推动其应用。
值得注意的是,在大多数已发现的circRNA中尚未检测到它的特定生物学功能,这也是首次发现的circRNA被视为剪接副产物的原因之一。考虑到带注释的功能性circRNA普遍存在m6A修饰,作者推测它可能与circRNA的组织和发育阶段特异性有关。也就是说,只有在特定组织、发育阶段和亚细胞位置中,特定的circRNA才被特定的分子机制(例如m6A)激活,呈现出差异表达。为了验证这一推测,m6A Hi-Res芯片和RNA-seq的联合分析将有助于进一步研究m6A修饰circRNA的生物学功能和临床应用。
参考文献
[1]:Zhang L, Hou C, Chen C, et al. The role of N6-methyladenosine (m6A) modification in the regulation of circRNAs. Mol Cancer. 2020;19(1):105. Published 2020 Jun 10. doi:10.1186/s12943-020-01224-3
.png)