
来自宾夕法尼亚大学Wei Guo教授的研究团队最近在Nature上在线发表了题为“Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response”研究论文,提出黑色素瘤细胞会分泌PD-L1阳性的外泌体到循环血液中,与CD8 T细胞表面的PD-1结合,抑制T细胞的增殖和细胞毒性能力,削弱机体的抗肿瘤免疫,促进肿瘤的生长,而PD-1抗体疗法有可能抑制这种PD-L1/ PD-1结合方式。循环中的外泌体PD-L1水平与IFN-γ水平成正相关,而且在PD-1抗体治疗过程中,对抗体反应好的患者,其外泌体PD-L1水平有明显的上调,可能是肿瘤细胞应对T细胞“复苏”的反馈机制,可用于临床上预测临床预后和区分抗体治疗响应好的患者,以指导临床用药。
研究意义:肿瘤细胞上调表面分子PD-L1的表达,PD-L1与T细胞表面的PD-1分子结合,抑制T细胞的抗肿瘤免疫反应,导致肿瘤细胞可以逃避免疫监视。最近PD-1抗体疗法在治疗很多类型的肿瘤(包括转移性黑色素瘤)中取得很好的治疗效果,但不幸的是,还是约有70%的肿瘤患者对该药没有反应。所以作者想对PD-L1介导的免疫逃避的机制有更深入的研究,以预测患者的药物响应和提高治疗效应。
胞外囊泡可由大多数细胞分泌,包括外泌体(直径大小约为30-150nm)和微囊泡(直径大小约为150-1000nm)。外泌体广泛存在于细胞培养上清以及各种体液(血液、淋巴液、唾液、尿液、精液、乳汁)中,携带有细胞来源相关的多种蛋白质、脂类、DNA、mRNA、miRNA等,参与细胞间通讯、细胞迁移、血管新生和免疫调节等过程。在患有糖尿病、心血管疾病、艾滋病、慢性炎症疾病以及各种癌症患者血浆中都发现外泌体水平的升高,提示它们很有可能成为这类疾病的诊断标志物,因此,对外泌体和其包含蛋白分子进行准确的定性和定量研究显得尤为重要。
分离微囊泡的方法是16,500g 高速离心 45 min。而分离外泌体的经典方法(差速离心法)就是在去除微囊泡的基础上,再100,000g 超速离心70min。分离更高纯度的外泌体的方法就是通过蔗糖或者沙丁胺醇为介质的密度梯度离心法。
1. 黑色素瘤细胞来源的外泌体表面会表达PD-L1分子,而且其水平受IFN-γ调节
首先对转移性黑色素瘤细胞WM9细胞来源的外泌体进行电镜鉴定其双层膜包裹的形态(a),NTA分析鉴定分离到的外泌体的直径大小约为97.1nm(b);通过基于抗体的定量蛋白质组学技术——反相蛋白芯片RPPA,对多种原发和转移性黑色素瘤细胞系分泌的外泌体表面的PD-L1分子的表达情况进行了分析,发现转移性黑色素细胞系得外泌体的PD-L1分子的表达水平要更高点(c),所以接着通过WB检测了四种转移性黑色素细胞系总蛋白和外泌体中PD-L1的蛋白水平,发现外泌体上PD-L1水平要高于细胞总蛋白中的(d)。基于PD-L1抗体的免疫电镜,观察到PD-L1分子存在WM9细胞来源的外泌体表面(e);
ELISA法检测外泌体PD-L1的示意图:利用包被了人PD-L1抗体的ELISA板子,捕获表达PD-L1分子的外泌体,再通过biotin-PD-L1抗体和SA-HRP连接,最后通过TMB底物显色检测外泌体中PD-L1分子的表达情况; ELISA法检测,发现经过IFN-γ刺激后,WM9或者WM164细胞分泌的外泌体会表达更高水平的PD-L1分子(f),和对不同处理后细胞分泌的外泌体PD-L1浓度进行了统计分析(g);而且作者通过WB检测,也证明了IFN-γ刺激会增加WM9或者WM164细胞总蛋白或者外泌体蛋白中PD-L1的蛋白水平,而不影响CD63的蛋白水平(i);利用包被了人PD-L1抗体的ELISA板子,捕获表达PD-L1分子的外泌体,再通过biotin-PD-1抗体和HRP连接,最后通过TMB底物显色检测外泌体中PD-L1与PD-1的结合情况,结果发现经过IFN-γ刺激后,WM9细胞或者WM164细胞分泌的外泌体中PD-L1与PD-1的结合能力随外泌体浓度增加而增强,但是这个效应会被PD-L1抗体阻断(h)。
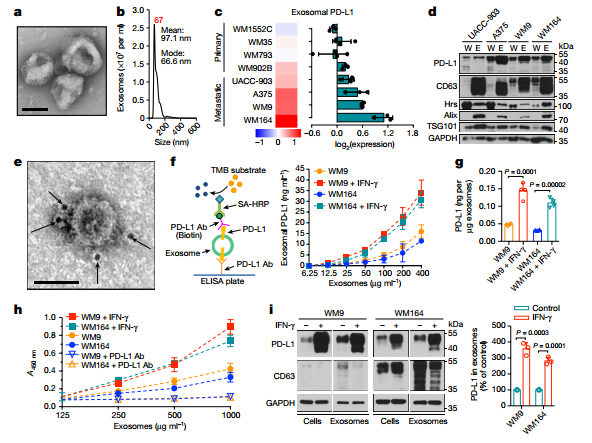
2. 血液循环中外泌体PD-L1分子水平可用于区分健康人和患有转移性黑色素瘤的病人
作者人黑色素瘤细胞异体移植到裸鼠上,成瘤后基于人PD-L1抗体的ELISA特异性检测人黑色素瘤分泌的外泌体,而不会检测到鼠外泌体(a),发现人黑色素瘤异体移植的裸鼠血浆外泌体中PD-L1分子水平明显上调,而且外泌体PD-L1分子水平与肿瘤体积大小成正相关(b-c);同时作者也对健康人群和黑色素瘤病人血浆样本中的PD-L1水平进行分析,发现黑色素瘤病人血浆外泌体PD-L1水平明显上调,total PD-L1水平也上调,但是extracellular vesicle (EV)-excluded PD-L1水平没有显著性差异(d-f);ROC曲线对各个指标统计分析,说明在这几个指标中,外泌体PD-L1分子的水平最适合用于区分健康人和黑色素瘤病人(g).
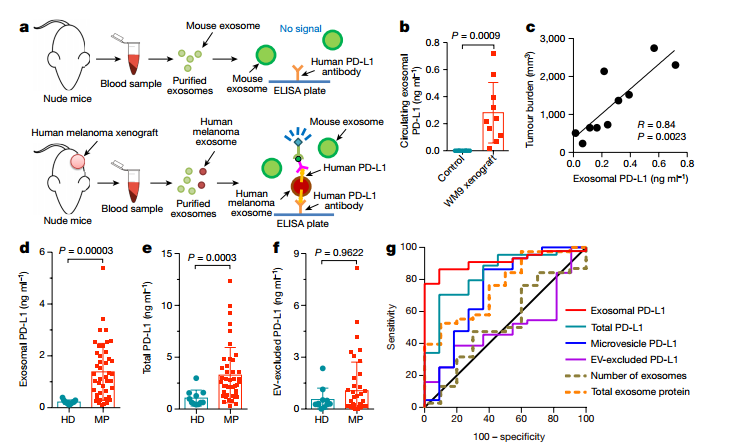
3. 外泌体PD-L1在体外和体内抑制CD8 T细胞功能和促进黑色素瘤发展
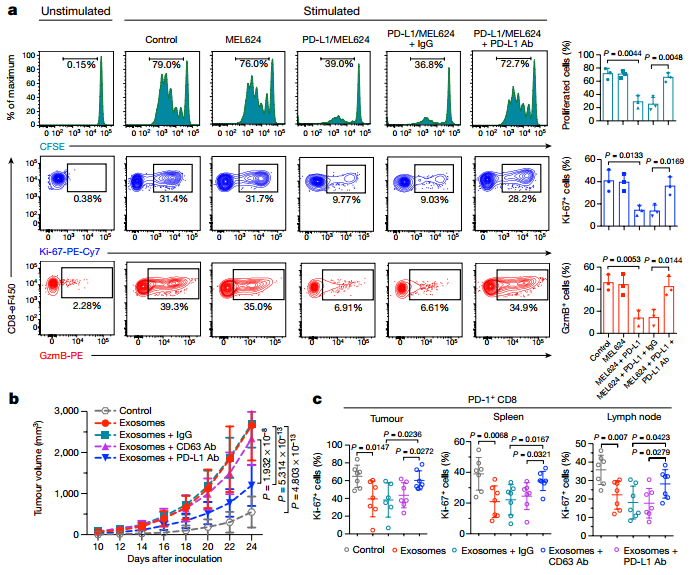
体外实验:CFSE标记的人外周血CD8 T细胞体外经过CD3和CD28抗体刺激24h活化后,再给予不同来源的外泌体(MEL624:无内源性PD-L1的外泌体;PD-L1/MEL624:表达外源性PD-L1的外泌体;PD-L1/MEL624+ PD-L1 Ab:表达外源性PD-L1的外泌体被PD-L1抗体封闭)共孵育48h后,流式检测CD8 T细胞的增殖和细胞毒性情况,发现表达外源性PD-L1的外泌体明显抑制T细胞的增殖和GzmB的分泌,而PD-L1抗体可以抵消这个效应(a);
体内小鼠成瘤实验:PD-L1(KD)B16-F10 细胞皮下成瘤的同时,尾静脉给予不同处理的外泌体,观察成瘤大小,发现母系B16-F10 细胞来源的表达PD-L1外泌体(exosomes组)可以明显促进PD-L1(KD)B16-F10 细胞皮下成瘤,但是PD-L1抗体预处理的外泌体(Exosomes + PD-L1 Ab组)明显抑制成瘤效应,另外IgG和CD63抗体却没有抑制作用(b);同时对小鼠肿瘤组织、脾脏和淋巴结中的PD-1+ CD8 TILs肿瘤浸润性淋巴细胞的增殖情况进行分析,发现B16-F10 细胞来源的外泌体(exosomes组)明显降低了Ki-67+PD-1+ CD8 TILs的比例,而PD-L1抗体预处理的外泌体(Exosomes + PD-L1 Ab组)明显上调了Ki-67+PD-1+ CD8 TILs比例(c),以上结果提示外泌体PD-L1分子可以抑制PD-1+ CD8 TILs的增殖,抑制抗肿瘤免疫,而PD-L1抗体可以大部分抵消这个抑制效应。
4. 血液循环外泌体PD-L1水平可用于识别对pembrolizumab(keytruda)抗体有反应的患者,以便更好地指导临床用药和预测临床预后
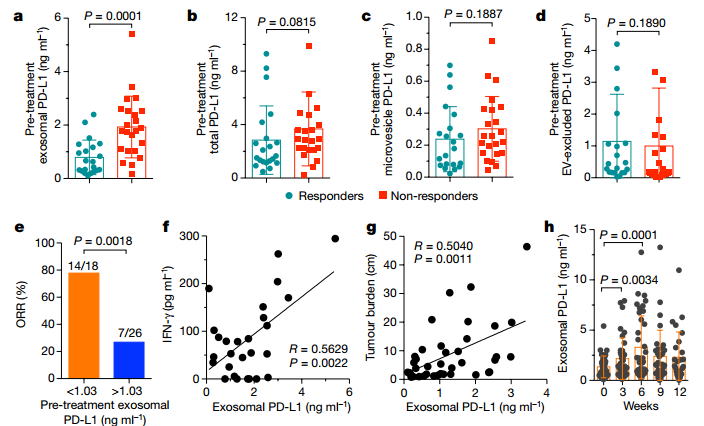
患者在接受PD-1抗体治疗前后,循环中胞外囊泡PD-L1水平是怎么变化的?在PD-1抗体治疗前期,对药物有反应的患者血浆中的外泌体PD-L1水平明显低于对药物无反应的患者的,而其他指标(total PD-L1、微囊泡 PD-L1和EV-excluded PD-L1)无明显差异(a-d);PD-1抗体治疗前期,患者血浆中的外泌体PD-L1水平(大于1.03)越高,患者的药物反应越差,临床预后也越差,这可能和高水平的外泌体PD-L1耗竭T细胞,导致T细胞无法被PD-1抗体疗法恢复功能有关(e)。患者血浆中的外泌体PD-L1水平与血浆中的IFN-γ水平和肿瘤体积大小成正相关,也提示外泌体PD-L1的高水平与临床预后差有关(f-g)。
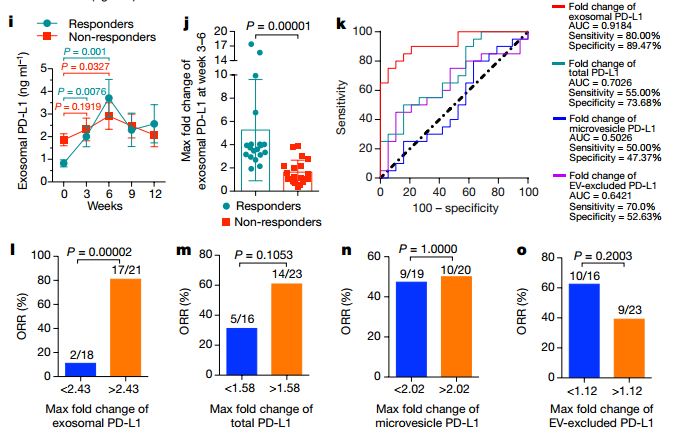
接下来,作者对已经开始接受PD-1抗体治疗的患者循环中外泌体PD-L1水平进行分析。患者在接受治疗后,循环中外泌体PD-L1水平逐渐升高,在第六周达到峰值,随后其水平逐渐降低(h);对抗体治疗反应好的患者,第三周和第六周的外泌体PD-L1水平差异越来越明显,而对抗体治疗无反应的患者,只有在第六周的外泌体PD-L1水平才与治疗前的水平有差异(i);与对抗体治疗无反应的患者相比,对抗体治疗反应好的患者的外泌体PD-L1水平在治疗的第3-6周上调的水平要明显增加(j);而且ROC曲线分析,也说明了外泌体PD-L1水平在治疗的第3-6周增加最大倍数大于2.43的患者对pembrolizumab反应好(k);相比于其他指标(total PD-L1、微囊泡 PD-L1和EV-excluded PD-L1)在治疗的第3-6周增加最大倍数,在治疗的第3-6周增加最大倍数大于2.43的外泌体PD-L1水平指标可以更好地区分抗体治疗反应好和坏的患者(l-o)。
总结:该研究发现黑色素瘤细胞分泌PD-L1阳性胞外囊泡到肿瘤微环境和血液循环中,外泌体PD-L1与T细胞表面的PD-1结合,抑制T细胞增殖和细胞毒性功能,从而抑制抗肿瘤免疫,而这个抑制效应很有可能会被PD-1抗体疗法抵消掉,这也是之前未发现的PD-L1/PD-1结合阻断疗法的可能机制之一。IFN-γ可以上调胞外囊泡PD-L1水平,PD-L1主要存在外泌体上,少部分存在微囊泡和其他胞外囊泡组分中,外泌体PD-L1主要靶向经过抗原递呈的会分泌IFN-γ的PD-1+ CD8 T细胞,抑制其功能。外泌体PD-L1的发现也证明肿瘤与免疫系统的相互作用的例子,允许肿瘤细胞抵抗免疫细胞发挥的效应作用。
PD-1抗体治疗前后,病人血浆外泌体PD-L1水平反应了机体不同的抗肿瘤免疫状态。抗体治疗前,外泌体PD-L1水平越高,抗体治疗反应越差,临床预后也越差,可能是高水平的外泌体PD-L1耗竭T细胞,导致T细胞无法一下恢复其功能。在抗体治疗过程中,外泌体PD-L1的水平逐渐升高,在第六周达到峰值,可能是由于PD-1抗体治疗促进T细胞功能的复苏,机体抗肿瘤免疫能力增强,而PD-L1水平升高可看成是一种负反馈,临床上可通过该指标检测病人对PD-1疗法的反应和预后预测。作者也提到对抗体疗法无反应的患者,外泌体PD-L1水平无明显升高,可能是由于机体无增强响应的T细胞免疫,或者肿瘤细胞对IFN-γ的反应下调,以避免抗原递呈增加和IFN-γ诱导的抗肿瘤增殖效应。
总之,该研究提示了在PD-1抗体治疗过程中,循环外泌体PD-L1水平可作为临床预后好坏的指标,也解释了PD-1疗法对许多病人无效的可能原因和机制。
参考文献
1. Chen G, Huang AC, Zhang W, et al. Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature. 2018 Aug 8. doi: 10.1038/s41586-018-0392-8.
.png)