在发达国家中,缺血性心脏病是导致心力衰竭的主要原因,也是2013年全球范围内死亡的根本原因,占所有死亡人数的15.7%。来自24项关于心力衰竭的包括43000例患者的多中心试验的数据,显示在62%的患者中,冠心病是导致心力衰竭的根本原因。而且这个百分比可能被低估了,因为在所有试验中没有系统地评估心力衰竭的原因。
发生急性心肌梗塞MI后,左心室心肌发生多个解剖学变化,包括瘢痕形成(置换性纤维化),梗死区扩张,反应性纤维化,左心室肥大和远端区扩张。 这些解剖变化使壁应力保持在最小和左心室收缩功能得以保存。但是随着病情的发展,这些补偿机制可能会耗尽,导致进一步的左心室重塑和功能障碍,从而导致二尖瓣装置的变形和二尖瓣关闭不全[1]。

最近来自美国费城天普大学的研究人员在Nature Communications期刊上在线发表了题为“Circular RNA CircFndc3b modulates cardiac repair after myocardial infarction via FUS/VEGF-A axis”的研究,揭示了在发生心肌梗死MI的小鼠心脏中表达出现明显下调的circFndc3b,体内和体外结果均显示circFndc3b过表达有助于减轻心肌细胞和内皮的凋亡,改善心肌功能。进一步的机制研究,证明circFndc3b并不作为miRNA的海绵而发挥功能,而是与RNA结合蛋白FUS相互结合,正向调控VEGF-A的表达,从而改善梗死后心肌的功能和重建[2]。
发生心肌梗死MI后心脏circRNA的表达谱
circRNA芯片分析假手术组和心肌梗死组心脏circRNA的表达情况,检测到1723种circRNAs,其中82种出现差异表达(心肌梗死组中41种表达上调,41种表达下调)。RT-qPCR验证这些circRNAs,包括在心肌梗死组中表达明显下调的circFndc3b。而且在心肌梗死随后的6周内,circFndc3b表达水平逐渐出现下调。为精确了解哪种心脏细胞可表达circFndc3b,分离心脏各种细胞后发现,在内皮细胞和心肌细胞,而不是成纤维细胞中的circFndc3b表达出现明显下调。结合临床样本,作者进一步发现在患有缺血性心肌病的患者左心室组织中,与人同源性达86%的circFndc3b表达水平也出现了明显的下调,这些结果提示了circFndc3b对于心肌梗死的病情发展可能有重要的影响。
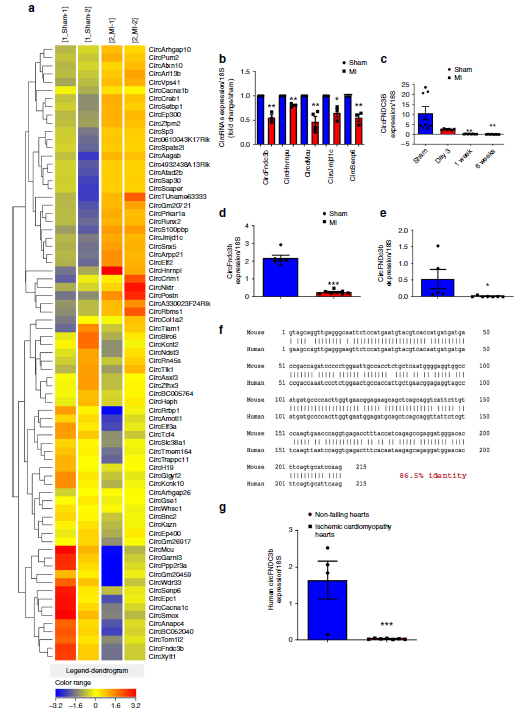
图1 正常和梗死心肌的circRNA表达情况
设计circFndc3b过表达载体
作者在构建circFndc3b过表达载体时,在靠近反向剪接位点的circFndc3b外显子中插入了简短的序列,以区分内源性生成的circFndc3b。体外细胞中过表达circFndc3b后,发现内源性和外源性circFndc3b表达水平都出现了明显的上调,而且这种外源性过表达并不影响线性Fndc3b mRNA的表达水平。
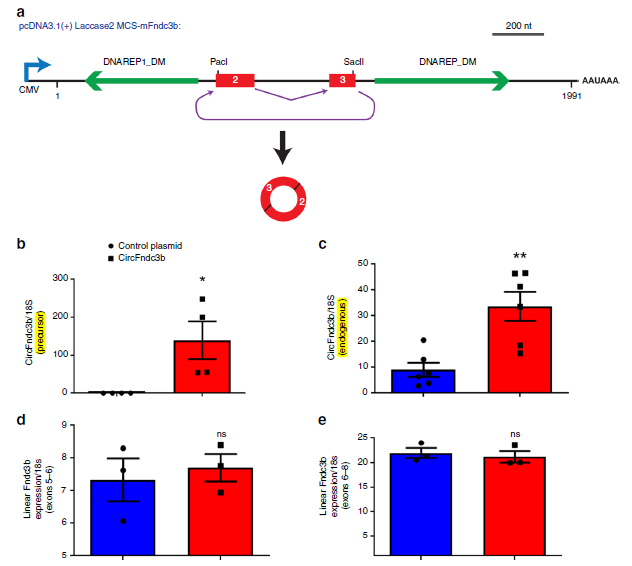
图2 构建circFndc3b过表达载体
过表达circFndc3b增强内皮细胞功能和减轻心肌细胞凋亡
RT2 ProfilerTM PCR小鼠血管生成芯片分析显示,过表达circFndc3b会调控多种基因的表达。RT-PCR实验验证了过表达circFndc3b可明显上调VEGF-A的表达。由于VEGF-A是心脏的关键保护因子,所以作者评估了circFndc3b在小鼠心脏内皮细胞(MCECs)中的作用。在过氧化氢诱导MCECs凋亡的条件下,过表达circFndc3b可明显减少TUNEL阳性的细胞数目,减轻细胞的凋亡情况。因为VEGF-A有助于调节血管生成,作者利用血管形成实验评估了circFndc3b的作用,发现过表达circFndc3b可明显促进HUVECs的血管形成。
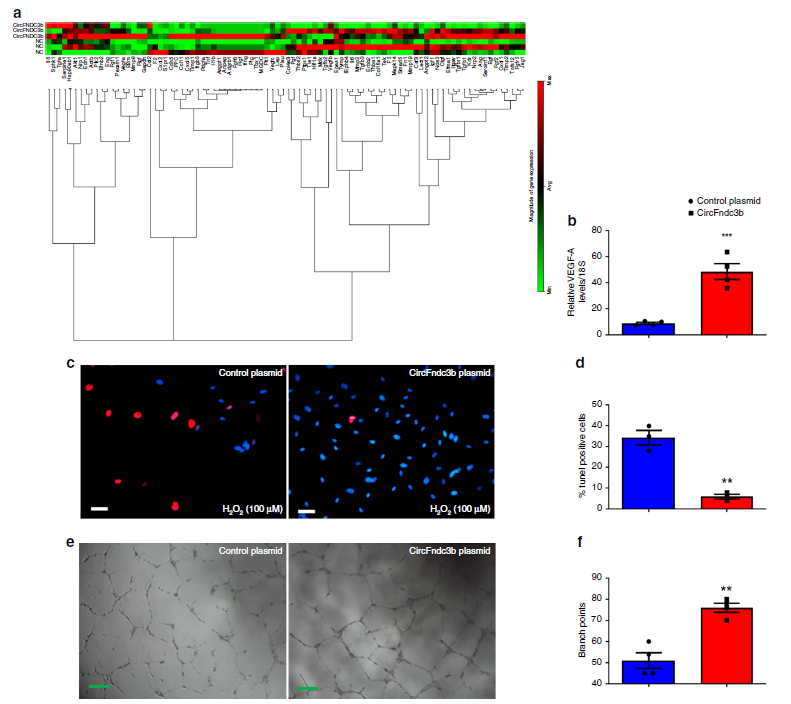
图3 体外过表达circFndc3b增强内皮细胞的功能
CircFndc3b改善小鼠心肌梗死后的左心室功能障碍
作者在通过冠状动脉左前降支LAD结扎诱导心急梗死后,立即注射携带circFndc3b过表达载体的腺病毒,心肌梗死8周后收集左心室组织,通过RT-qPCR验证内源性和外源性circFndc3b确实可以过表达,而线性CircFndc3b mRNA表达水平并无变化。超声心动图评估显示,在心肌梗死后第2,4,8周,过表达circFndc3b可以明显提高了梗死心脏的射血分数EF和缩短分数FS百分比。同时评估发生心肌梗死后的心脏发生收缩(LVIDs)和舒张(LVIDd)时的左心室内直径时,作者发现过表达circFndc3b可明显减少左心室内直径,改善和重建心肌形态功能。
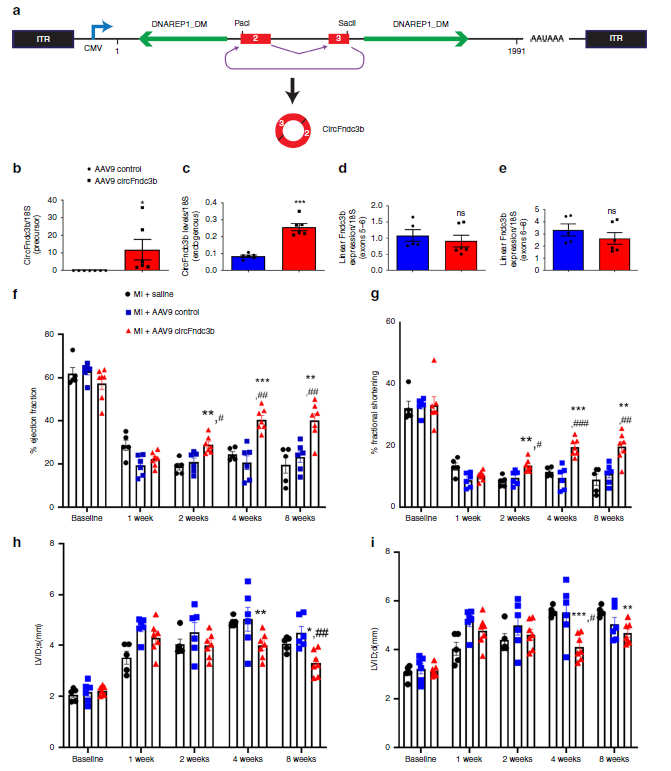
图4 腺病毒诱导的circFndc3b体内过表达明显改善心肌功能
心肌梗死后过表达circFndc3b可促进新心血管生成和减轻纤维化
circFndc3b过表达组小鼠在发生心肌梗死8周后,心脏切片显示circFndc3b过表达可显著地增加毛细血管密度(红色)和小动脉数目(绿色),即促进心脏新血管生成。为进一步确定增加的血管数目是否可改善心脏梗死纤维化后重塑的情况,作者通过Masson’s trichrome染色评估了心脏梗死面积,发现circFndc3b过表达也可减少心脏梗死面积。
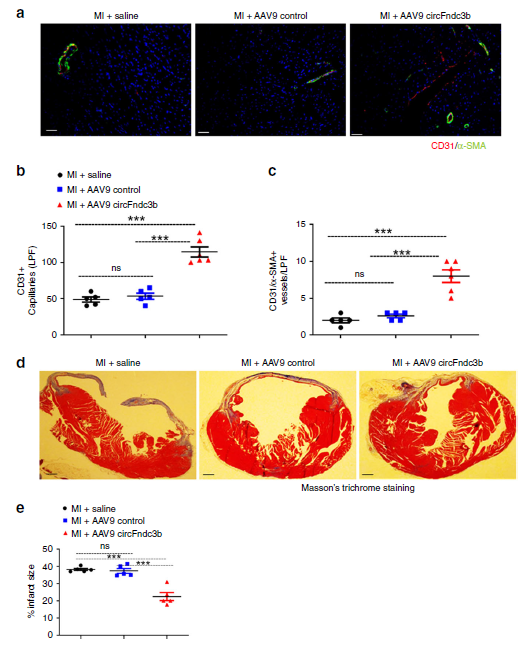
图5 体内过表达circFndc3b促进新血管生成和减轻心肌纤维化的情况
circFndc3b不通过作为miRNAs sponge而发挥功能
通过数据库预测了可能与circFndc3b相互结合的miRNAs后,luciferase 报告基因实验验证了miR-298-5p, miR-412-3p,和miR-93-3p有很大的可能性可与circFndc3b相互结合,而且在发生梗死心肌中着三种miRNAs的表达水平出现明显上调。为了明确circFndc3b发挥功能的相关机制,作者构建含有与这三种miRNAs结合的突变位点的circFndc3b过表达载体,在缺氧或者无血清诱导H9c2心肌细胞凋亡的条件下,TUNEL实验证明分别过表达WT和突变circFndc3b均可以减轻细胞凋亡的情况。另外分别过表达WT和突变circFndc3b均可以减少MCECs细胞凋亡情况,也可增强器血管形成能力。
体内数据也证明,发生心肌梗死的小鼠心脏中,无论是过表达WT circFndc3b,还是突变的circFndc3b,都可以减轻细胞凋亡的数目,进一步提示circFndc3b中的miRNAs结合位点对于其功能的发挥无重要影响,circFndc3b并不通过海绵miRNAs发挥效应。
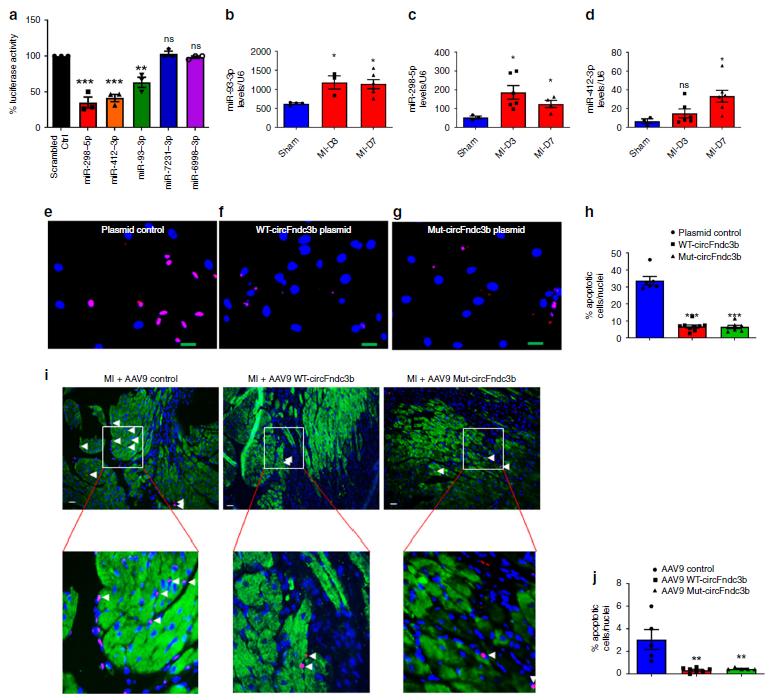
图6 circFndc3b的miRNA结合位点突变不影响其功能发挥
circFndc3b-FUS-VEGF-A通路参与调节心脏内皮细胞功能
circFndc3b除了通过作为miRNAs sponge,还会与RNA结合蛋白结合而发挥功能。为验证这个可能性,circInteractome预测了circFndc3b可能与AGO2和FUS蛋白结合,而RIP结果显示FUS抗体才可以富集circFndc3b,进一步提示circFndc3b不太可能通过海绵miRNAs而发挥功能。WB实验结果显示,过表达circFndc3b可明显下调FUS蛋白水平,而上调VEGF-A的蛋白水平。
那circFndc3b是否通过FUS调控VEGF-A的表达?敲低circFndc3b或者过表达FUS,可以明显抑制VEGF-A的表达,促进内皮细胞MCECs的凋亡,抑制内皮细胞的迁移能力。而过表达circFndc3b可促进VEGF-A的表达,抑制内皮细胞MCECs的凋亡,提高内皮细胞的迁移能力;当同时过表达FUS或者敲低FUS表达,则相应地起到拮抗或者协同促进的生物学效应,提示circFndc3b很有可能通过FUS调控VEGF-A的表达,发挥生物学功能。同时心肌梗死模型的体内数据显示,circFndc3b过表达的左心室组织中FUS表达水平明显下调,而VEGF表达水平出现上调。
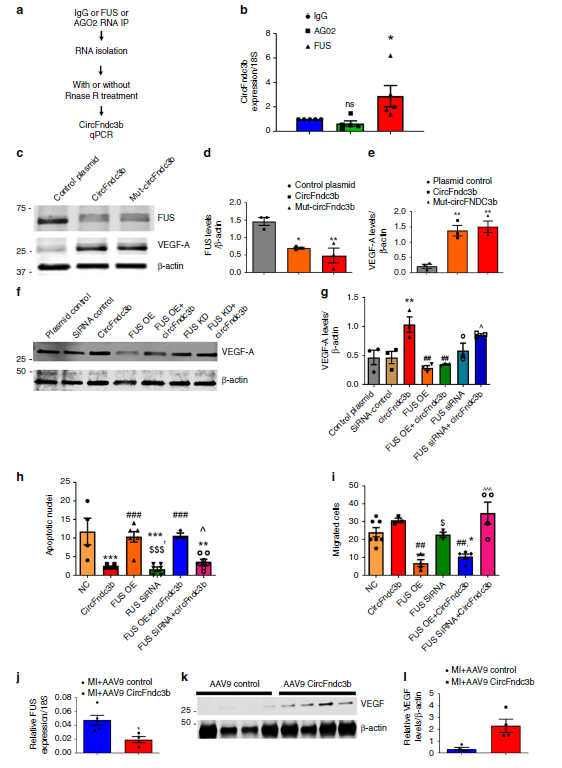
图7 CircFndc3b-FUS-VEGF-A信号通路调控心脏内皮细胞的功能
总结:作者从发生心肌梗死组织的circRNA表达谱中挖掘到表达明显下调的circFndc3b(芯片测序只用到一部分组织,故测序得到的circRNA种类并不完全),临床上在心肌缺血性患者中,与其同源的circFndc3b表达水平也出现一致性的下调,提出了circFndc3b对于心肌梗死病情发生发展有着重要影响的猜测。接着通过体外过表达circFndc3b(设计过表达载体可区分内源性和外源性circFndc3b,这点很有趣),减轻应激诱导内皮细胞的凋亡情况和促进其血管形成;体内利用腺病毒过表达circFndc3b后,可明显促进心血管形成,减少心肌梗死面积和改善左心室的功能障碍。最后机制探究时,发现circFndc3b不像大多数circRNAs通过海绵miRNAs来发挥效应,而是通过结合RNA结合蛋白FUS,来靶向调控VEGF-A的表达,从而影响心肌梗死的进程。这是一种circRNAs通过结合RNA结合蛋白发挥功能的例子,以供同行参考学习。
通讯作者

Raj Kishore博士,美国天普大学药理学教授,转化医学中心教授
转化医学中心干细胞治疗计划主任
研究方向:在Kishore实验室的研究集中在几个特定的领域,提出心血管疾病机制的新见解和在相关生理模型中机械研究的转化整合。目前研究的主要焦点包括干细胞治疗梗死后心肌和其他缺血组织修复和再生的多个方面。目前,该实验室正在大力开发新的策略,以提高干细胞治疗(成人和胚胎/ iPS细胞)的治疗效益,特别是它们的存活、功能和分化,以及在体外和生理相关的心肌损伤体内模型。其中一些策略包括表观遗传修饰、纳米生物材料的使用以及与抗炎细胞因子的联合治疗。该实验室还在开发无细胞、干细胞来源的外泌体,作为细胞疗法的可行替代品。Kishore实验室的另一个主要研究领域是描述白细胞介素-10介导的心血管损伤和炎症减轻的机制。这些研究的重点是了解炎症在损伤后心肌功能和组织修复中的作用。(信息来源:https://medicine.temple.edu/raj-kishore)
参考文献
- Bax JJ, Di Carli M, Narula J, Delgado V. Multimodality imaging in ischaemic heart failure. Lancet. 2019 Mar 9;393(10175):1056-1070. doi: 10.1016/S0140-6736(18)33207-0.
- Garikipati VNS, Verma SK, Cheng Z, et al. Circular RNA CircFndc3b modulates cardiac repair after myocardial infarction via FUS/VEGF-A axis.Nat Commun. 2019 Sep 20;10(1):4317. doi: 10.1038/s41467-019-11777-7.
.png)