5月23日,Nature子刊Cell Death & Differentiation杂志在线发表了加拿大多伦多大学杨柏华教授为通讯作者的文章,介绍发现乳腺癌中circ-Ccnb1能够抵消p53突变的效应,发挥抑制肿瘤的作用[1]。

circ-Ccnb1由CCNB1基因的第四和第五外显子反向拼接形成,作者发现circ-Ccnb1在乳腺癌中特异性的降低。基于RNA Pull-down筛选相互作用蛋白,最终发现了circ-Ccnb1可以通过H2AX与p53或Bclaf1相互作用相互作用,并且突变型的p53中,circ-Ccnb1可通过H2AX与Bclaf1相互作用,发挥抑癌相关的基因转录功能。体内模型中也证明稳定过表达或直接注射circ-Ccnb1过表达质粒均可显著抑制肿瘤生长,未来或许可以开发出基于circ-Ccnb1的肿瘤治疗策略。下面就让我们一起详细学习一下这篇文章是如何一步步探索相关的机制和功能的吧:
作者如何发现circ-Ccnb1的?
作者首先基于芯片分析三例乳腺癌和对应的癌旁组织中差异明显的circRNA分子,结果表明其中只有少数几个circRNA的差异超过两倍。
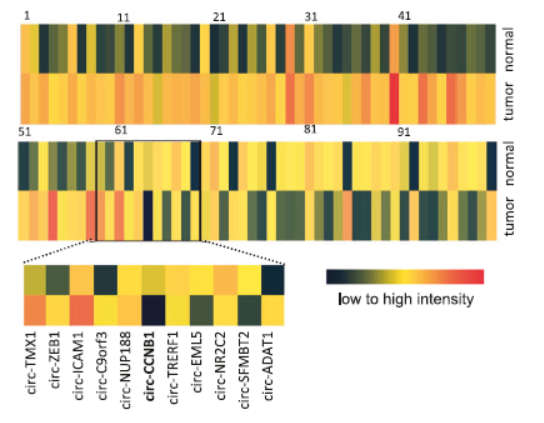
图1 乳腺癌中差异表达circRNA鉴定 (来自[1])
这些差异表达的circRNA所对应的母基因如果是已知的在肿瘤发生发展等过程中油重要作用的,进一步研究的价值可能会更高。基于这一出发点,作者聚焦到来自CCNB1基因的一个circRNA分子:circ-Ccnb1。CCNB1基因主要在有丝分裂的M期发挥作用,很多的研究表明该基因在肿瘤中存在明显的高表达,其中也包括乳腺癌。
circ-Ccnb1来自CCNB1基因的第4和5外显子。进一步在66对癌组织和癌旁组织中进行QPCR分析也表明circ-Ccnb1在乳腺癌中明显低于癌旁组织。正常的乳腺组织中circ-Ccnb1的表达也显著高于乳腺癌标本,而母基因CCNB1的表达却恰恰相反,在正常的乳腺组织中明显低于乳腺癌标本。circ-Ccnb1和CCNB1的表达也没有明显的对应关系。在多种细胞系中鉴定结果也表明肿瘤细胞中circ-Ccnb1表达明显低于非肿瘤的细胞。
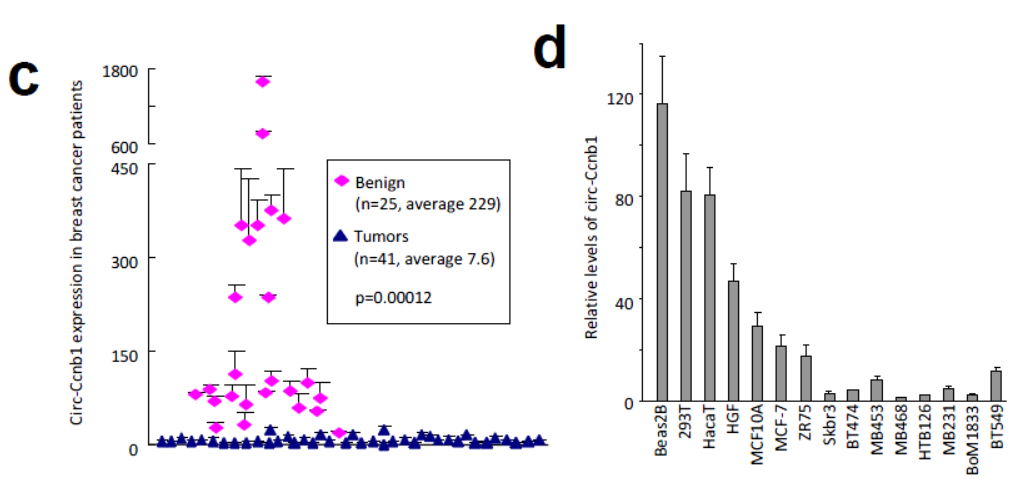
图2 乳腺癌中circ-Ccnb1表达显著下降 (来自[1])
这些现象暗示乳腺癌中存在一种未知的机制(肿瘤微进化的选择压力?)使得circ-Ccnb1表达显著下降。如果circ-Ccnb1的确是对乳腺癌生存不利的因素,能否借助过表达circ-Ccnb1实现抑制乳腺癌的作用?如果有这样的作用,circ-Ccnb1是通过什么途径发挥作用的?
在乳腺癌细胞HTB126中过表达circ-Ccnb1可抑制细胞增殖,增加凋亡比例。
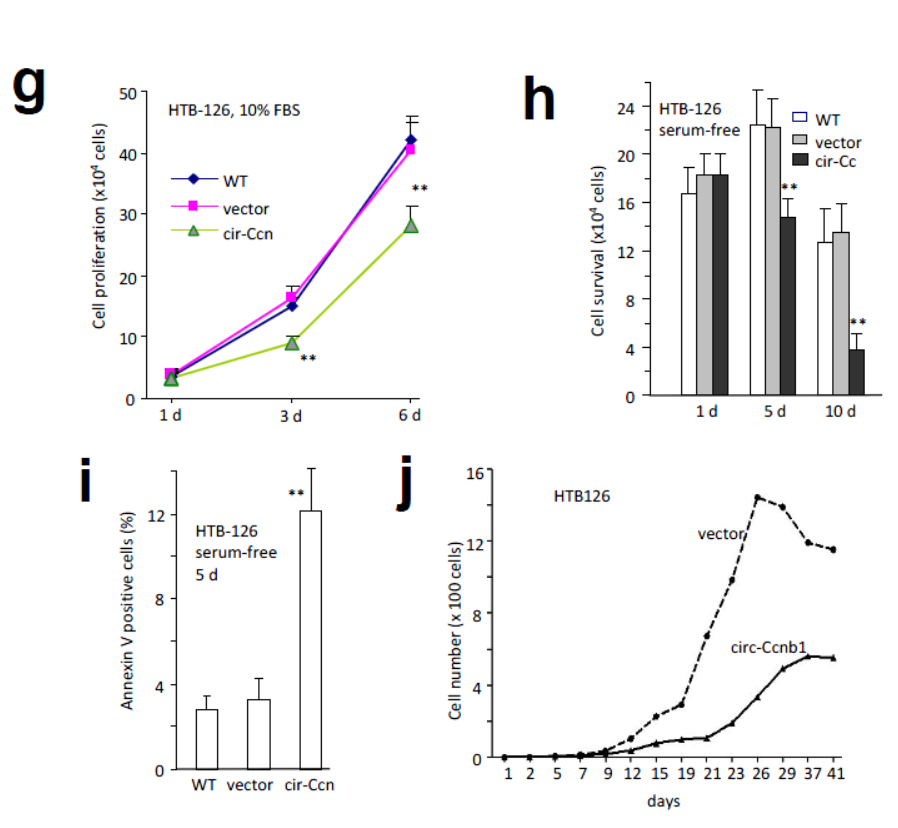
图3 过表达circ-Ccnb1抑制乳腺癌细胞增殖(来自[1],排列略有改动)
在MB-231乳腺癌细胞中干扰circ-Ccnb1则促进细胞增殖,但干扰其母基因CCNB1则抑制细胞增殖。但在非肿瘤细胞系293T中干扰circ-Ccnb1则抑制细胞增殖。

图 4 MB-231中干扰circ-Ccnb1则促进细胞增殖,293T中无此效应 (来自[1])
circ-Ccnb1相互作用蛋是怎样鉴定的?
上述分析表明circ-Ccnb1可以在乳腺癌中特异性的发挥抑制细胞增殖的作用,那么circ-Ccnb1发挥作用的分子机制是怎样的呢?作者初步的研究表明有相当比例的circ-Ccnb1分子定位在细胞核内,竞争性结合miRNA的作用模型似乎不能有效的解释circ-Ccnb1的作用机制。因此作者采用特异性靶向circ-Ccnb1的核酸探针进行RNA Pull-down进行互作蛋白的捕获分析。
在捕获的蛋白分子中,作者发现了一个有趣的现象:只有Beas2B细胞中能捕获到p53蛋白,而只有在HTB126细胞中捕获到Bclaf1蛋白,但两种细胞中都可以捕获到H2AX蛋白。Beas2B为p53野生型的细胞,HTB126为p53突变型的细胞。
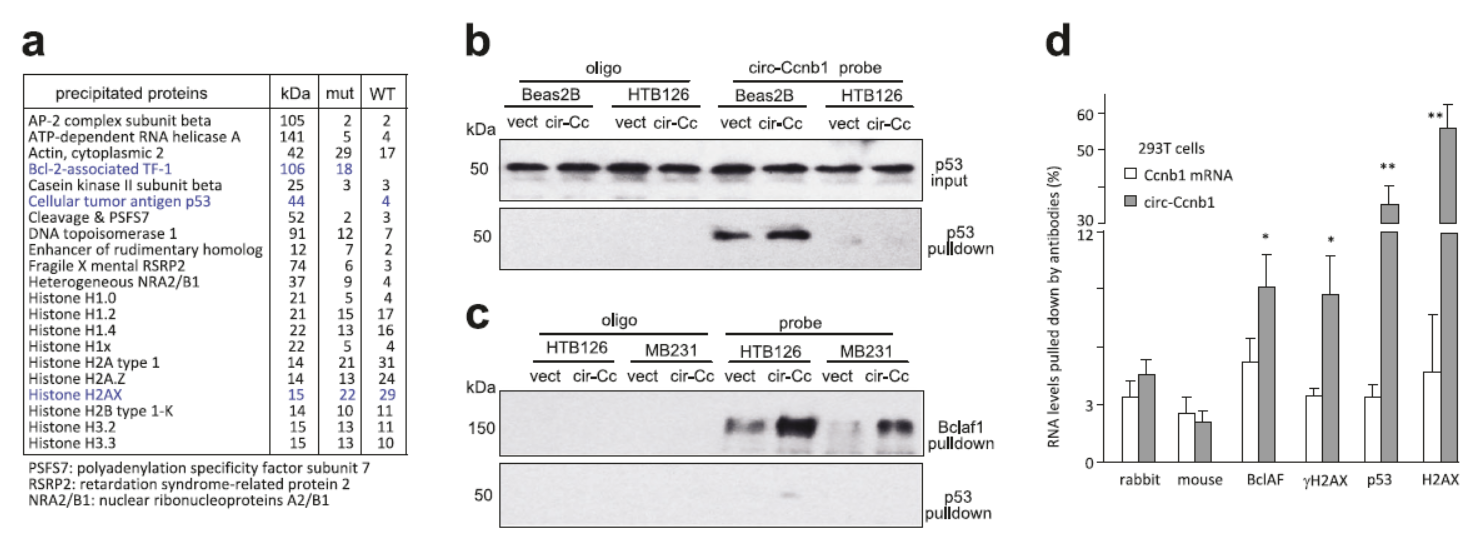
图5 RNA Pull-down分析circ-Ccnb1互作蛋白 (来自[1])
为什么会出现上述的诡异现象?已知H2AX可以与p53或Bclaf1蛋白相互作用,一个合理的假设是circ-Ccnb1并不是直接与p53或Bclaf1相互作用,而是直接与H2AX相互作用。在p53野生型的Beas2B细胞中,p53直接与H2AX相互作用,从而在实验过程中被捕获。而在p53突变的HTB126细胞中,p53因为突变而不能结合到H2AX上,Bclaf1得以与H2AX相互作用而被捕获。
在同样是p53突变的MB231细胞中也有是只能捕获Bclaf1。进一步,作者通过抗H2AX、 γH2AX、p53和Bclaf1的抗体分别在293T细胞中进行RIP实验,进一步证实了这些相互作用。
已知Bclaf1可以通过H2AX介导实现抑癌相关的基因转录调控作用。基于上述的实验结果,一个合理的假设模型是:circ-Ccnb1与H2AX相互作用可促进H2AX与野生型p53的相互作用,而在p53突变的情况下,p53无法与H2AX正确相互作用,但当存在circ-Ccnb1时,circ-Ccnb1与H2AX相互作用能促进H2AX与Bclaf1相互作用,并进一步促进Bclaf1介导的抑癌相关的基因转录活动。
作者在293T中干扰H2AX,看circ-Ccnb1探针Pull-down结果。干扰H2AX并不明显影响相关基因的表达,但却明显影响circ-Ccnb1探针捕获p53和Bclaf1。说明circ-Ccnb1不是直接作用于p53和Bclaf1的。
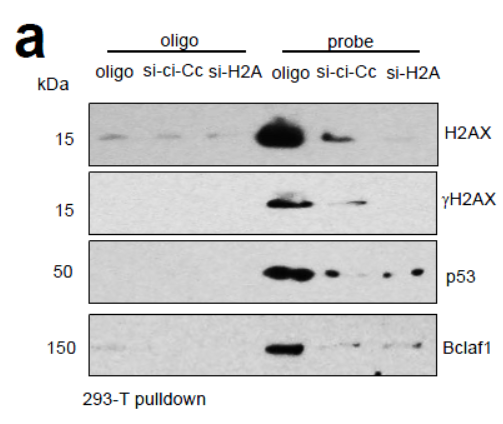
图6 干扰H2AX影响circ-Ccnb1探针捕获p53和Bclaf1 (来自[1])
干扰H2AX也能明显降低抗p53抗体和抗Bclaf1抗体捕获circ-Ccnb1。干扰p53并不影响抗H2AX抗体捕获circ-Ccnb1,并且还会增加circ-Ccnb1探针捕获Bclaf1的效率。干扰H2AX可以抑制细胞增殖,增加细胞凋亡敏感性
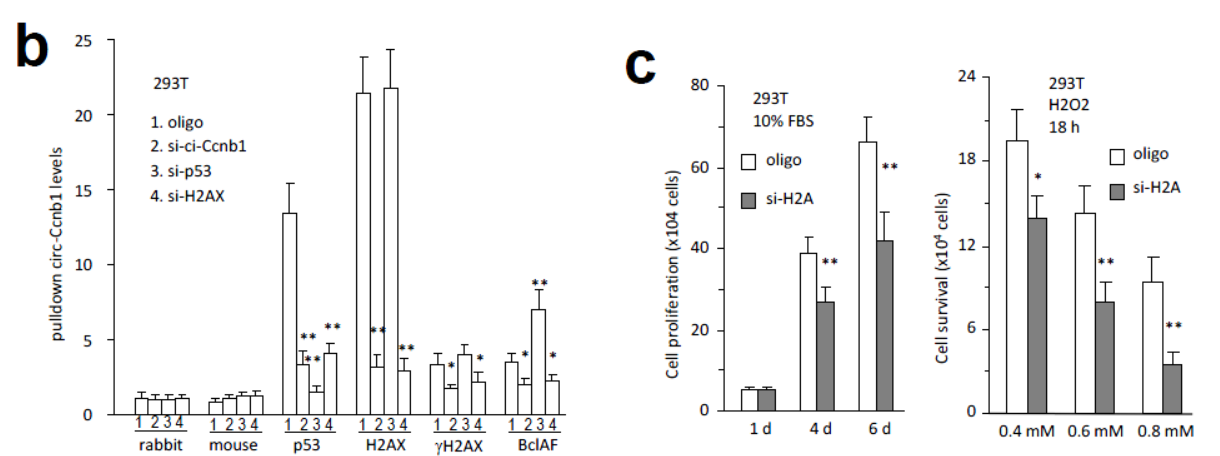
图7 H2AX,p53和Bclaf1与circ-Ccnb1相互捕获关系 (来自[1])
在p53突变的HTB126细胞中,干扰p53并不影响抗H2AX,γH2AX和Bclaf1的抗体捕获circ-Ccnb1的效率。说明突变的p53不参与circ-Ccnb1相互作用。但干扰H2AX则显著影响抗Bclaf1的抗体捕获circ-Ccnb1的效率。
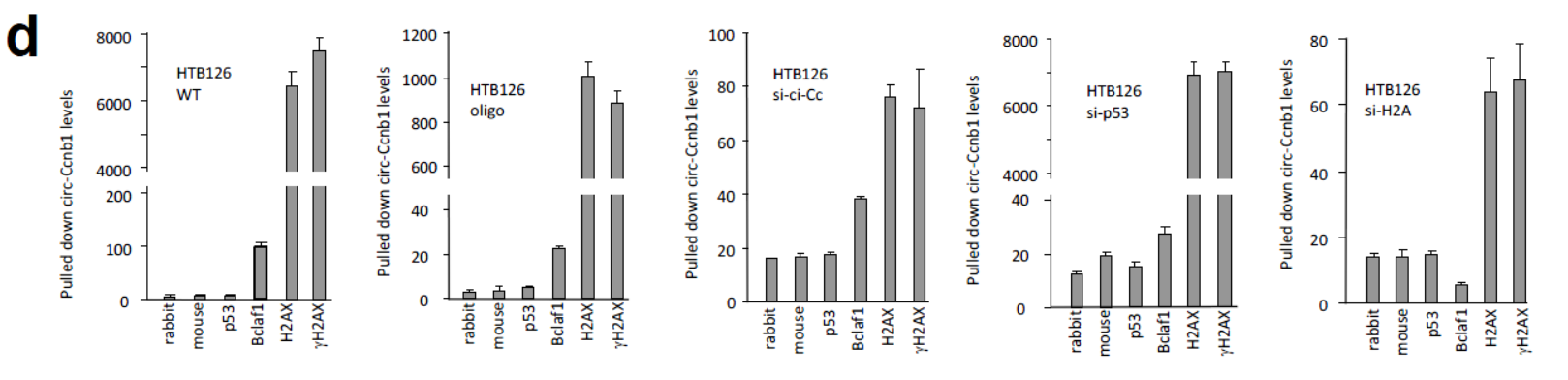
图8 突变的p53不参与circ-Ccnb1相互作用 (来自[1])
在HTB126细胞中过表达circ-Ccnb1后,分别干扰p53,circ-Ccnb1和H2AX。结果表明干扰H2AX明显降低抗Bclaf1的抗体捕获circ-Ccnb1的效率,而干扰p53则不会有这种影响。CLIP结果也表明抗H2AX 或γH2AX的抗体可以直接捕获circ-Ccnb1。干扰H2AX也能显著抑制circ-Ccnb1探针捕获H2AX,γH2AX或p53的效率。
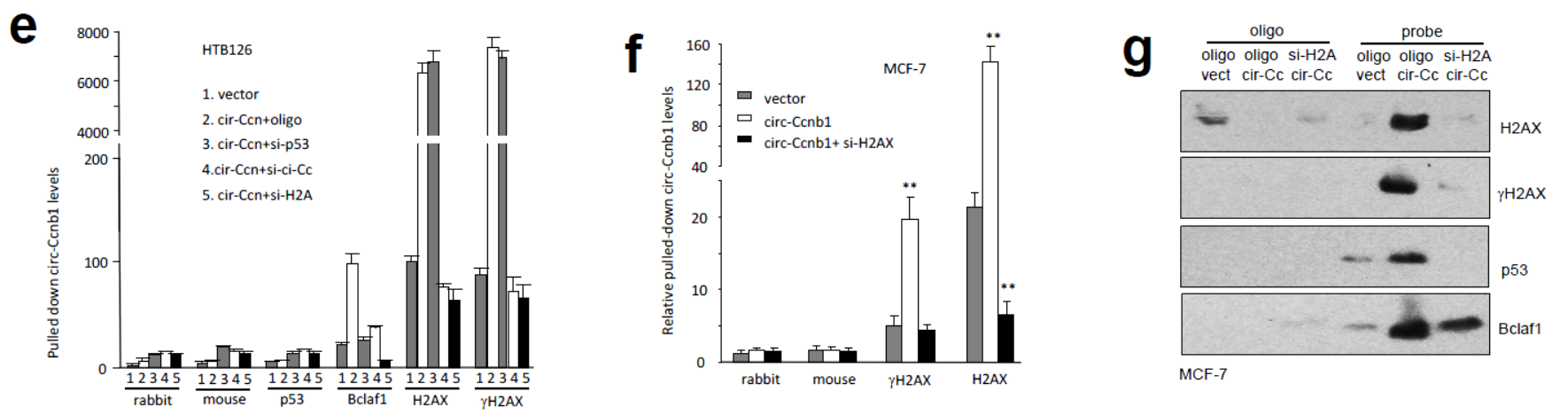
图9 H2AX,p53和Bclaf1与circ-Ccnb1相互捕获关系 (来自[1])
作者也基于计算机模拟,circ-Ccnb1二级结构预测及Docking分析了circ-Ccnb1与H2AX相互作用的模型。
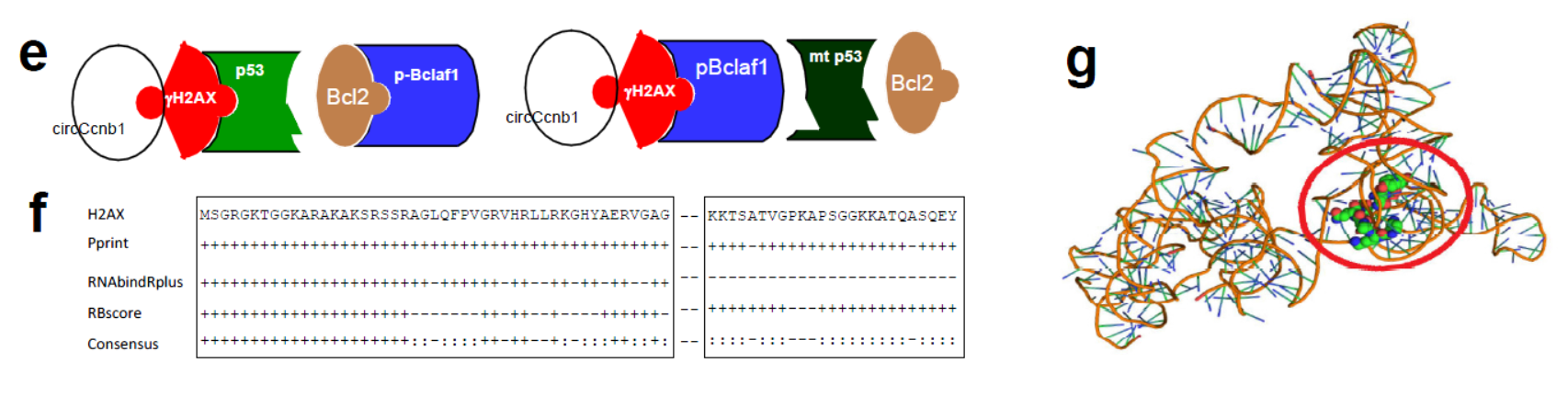
图10 circ-Ccnb1互作蛋白机制 (来自[1])
circ-Ccnb1与H2AX相互作用带来怎样的效应?
基于计算机模拟分析的结果,作者预测了circ-Ccnb1与H2AX相互作用的关键位点,并构建了对应的突变体。首先在293T细胞中进行RIP验证,结果表明所设计的位点突变后显著影响了circ-Ccnb1与H2AX的相互作用。针对预测的位点设计的反义核苷酸也能得到相同的结果。
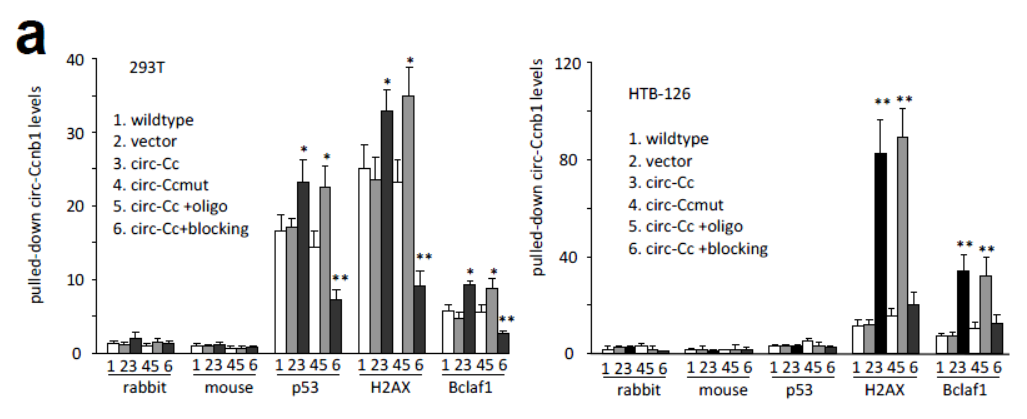
图11 circ-Ccnb1与H2AX相互作用的关键位点验证 (来自[1])
进一步,作者通过探针法进行RNA Pull-down验证。在HTB126细胞中,相关位点突变或反义核苷酸均可显著降低circ-Ccnb1探针捕获H2AX和Bclaf1蛋白的效率。293T细胞中也相应的明显降低了捕获p53,H2AX和Bclaf1蛋白的效率。并且,在293T细胞中, circ-Ccnb1突变体或反义核苷酸能显著降低H2AX与p53的相互作用,正反向IP实验均得到一致的结果。说明H2AX与p53的相互作用是由circ-Ccnb1介导的。
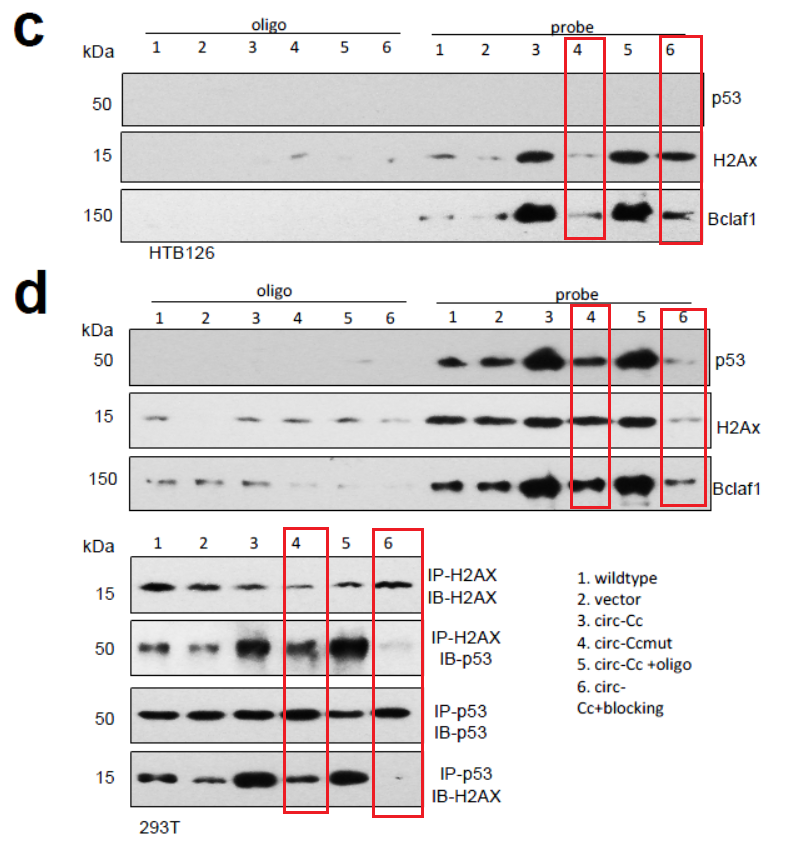
图12 circ-Ccnb1介导H2AX与p53的相互作用 (来自[1])
过表达circ-Ccnb1突变体或反义核苷酸后,过表达所导致的细胞增殖和凋亡相关的效应随之减弱。
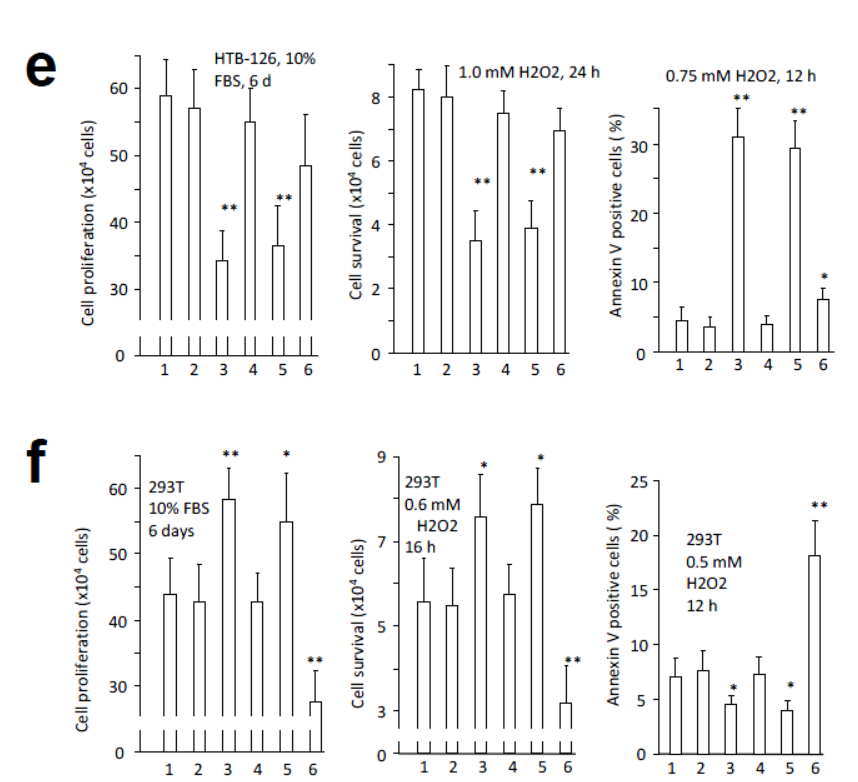
图13 circ-Ccnb1突变体或反义核苷酸不再影响细胞增殖和凋亡 (来自[1])
通过上述的研究结果,表明突变的p53不参与circ-Ccnb1的相互作用。那么野生型和突变型p53情况下circ-Ccnb1是分别如何发挥作用的?作者在293T细胞中构建了过表达野生型和突变型p53的模型。结果表明过表达野生型p53能增加circ-Ccnb1表达量,突变型不能。过表达突变型p53或干扰野生型p53则促进γH2AX的表达。
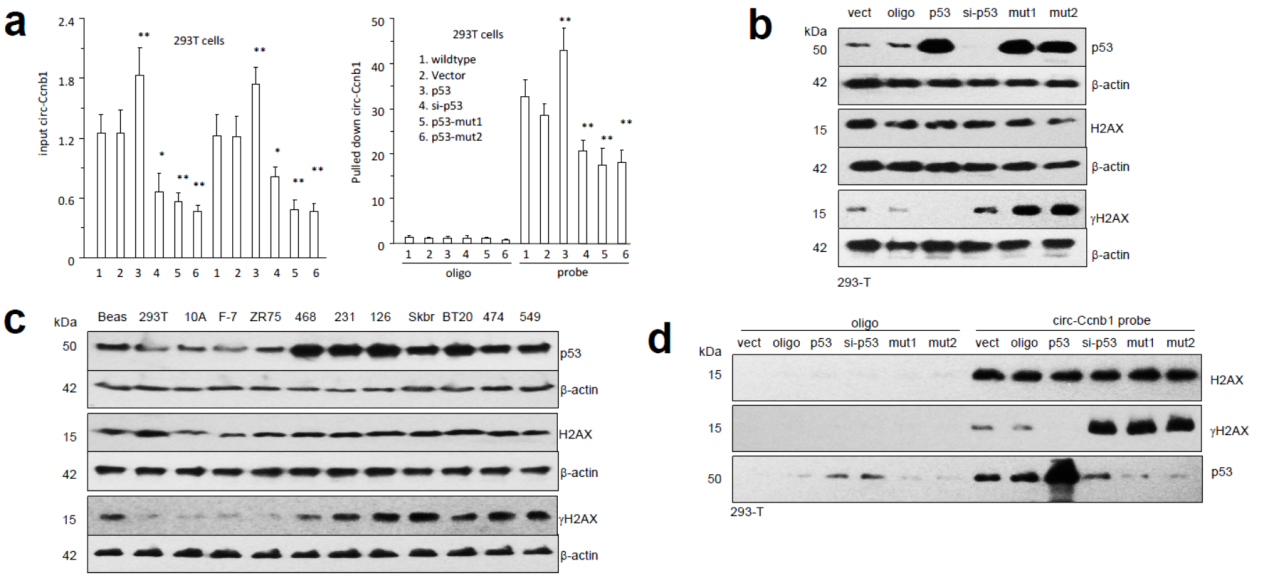
图14 p53突变与circ-Ccnb1和γH2AX表达的关系 (来自[1])
在293T细胞中,干扰p53促进H2AX捕获Bclaf1,而在HTB126细胞中是否干扰p53并不影响H2AX捕获Bclaf1。
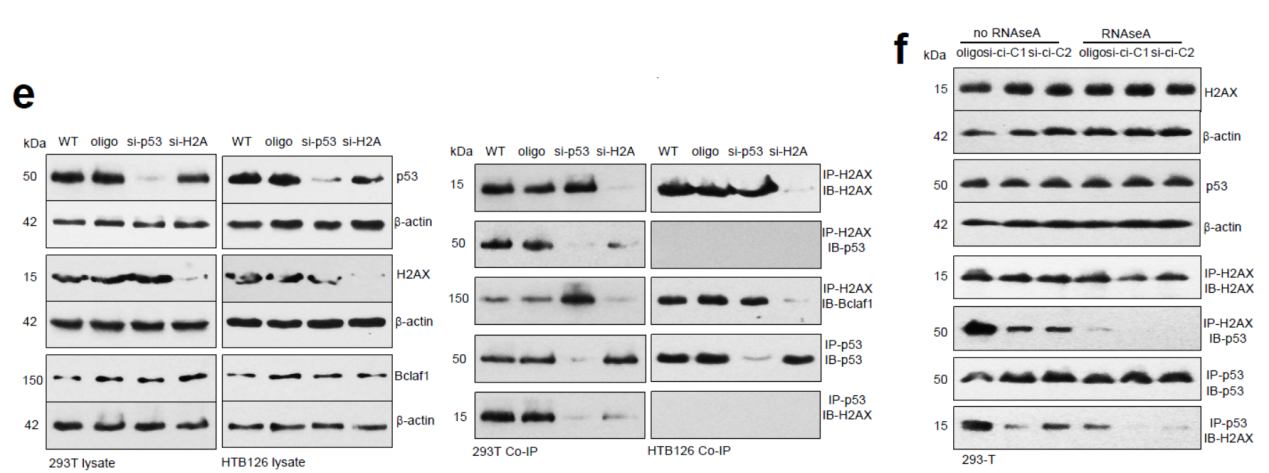
图15 p53突变与Bclaf1的关系 (来自[1])
在不表达内源p53的4T1细胞中重复上述实验,相互作用关系的相关结果与293T中一致。唯一不同的是在4T1细胞中过表达野生型或突变型p53并不影响circ-Ccnb1的表达。为进一步分析野生型和突变型p53对circ-Ccnb1表达量的影响,作者在64例乳腺癌临床标本(作者从中鉴定到17例p53突变型的标本)进行分析,结果表明野生型p53的标本中circ-Ccnb1表达量明显高于突变型标本。
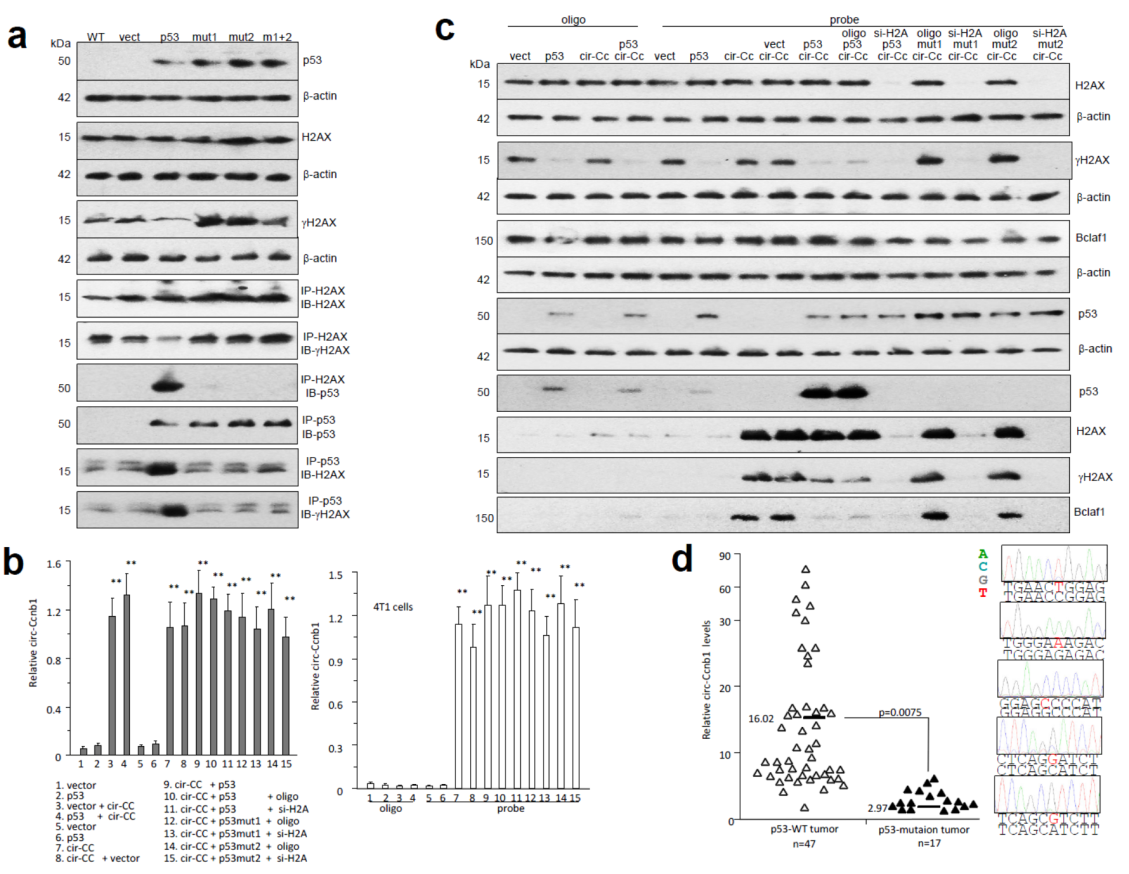
图16 不表达p53的4T1细胞中验证相关结果 (来自[1])
circ-Ccnb1在体内模型中的作用
为进一步探索circ-Ccnb1在乳腺癌中的功能,作者在皮下注射的裸鼠模型中分析过表达circ-Ccnb1的影响。结果表明稳定过表达circ-Ccnb1的细胞肿瘤生长速度远小于对照组。更有趣的是,作者还通过直接注射过表达circ-Ccnb1的质粒分析了它对肿瘤生长的影响,结果表直接注射circ-Ccnb1过表达质粒也可以显著降低肿瘤生长的速度,结果与稳定过表达circ-Ccnb1的细胞株基本一致。这初步表明过表达circ-Ccnb1的质粒或许可以直接作为肿瘤治疗的药物。
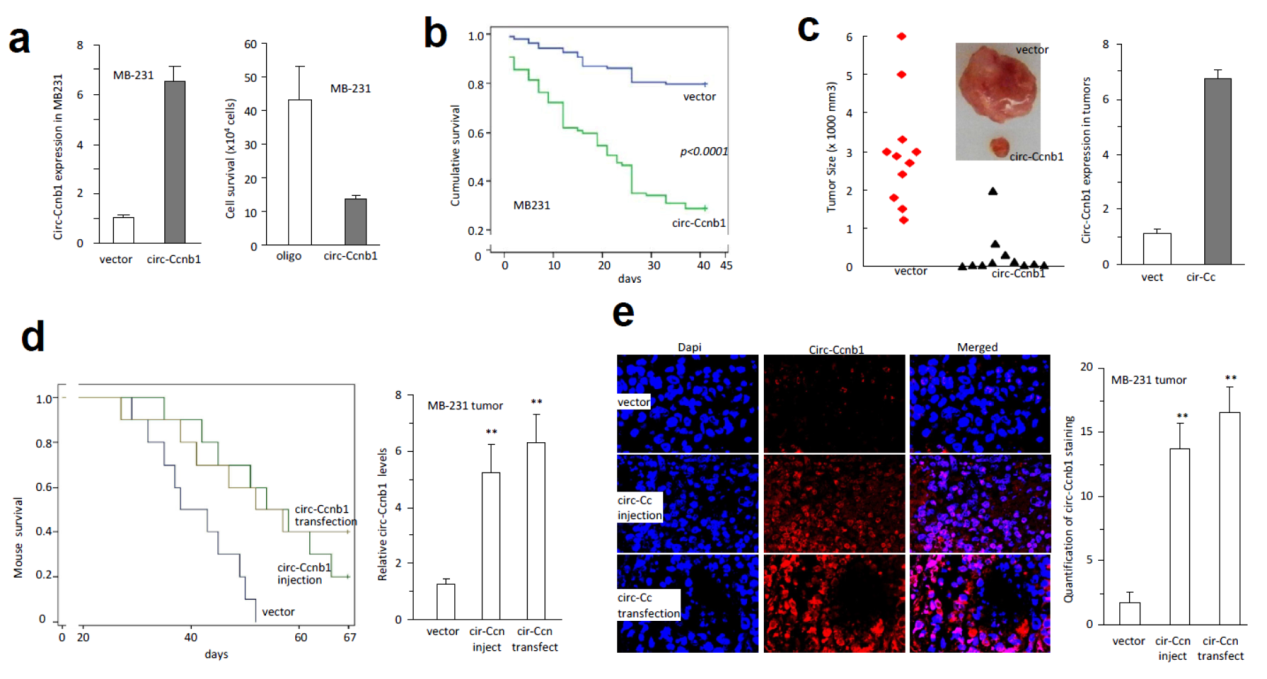
图17 体内模型证明过表达circ-Ccnb1显著抑制肿瘤生长 (来自[1])
本文深入分析了circ-Ccnb1在乳腺癌中作用的分子机制,证明了circ-Ccnb1具有抑癌作用。通过分析相互作用蛋白,找到了明确的circ-Ccnb1作用机制,为circRNA的功能研究提供了非常有价值的参考。
参考文献:
1. Ling Fang, W.W.D., Juanjuan Lyu, Jun Dong, Chao Zhang, Weining Yang, Alina He, Yat Sze Sheila Kwok, Jian Ma, Nan Wu, Feiya Li, Faryal Mehwish Awan, Chengyan H, Bing L. Yang, Chun Peng, Helen J. MacKay, Albert J. Yee, Burton B. Yang, Enhanced breast cancer progression by mutant p53 is inhibited by the circular RNA circ-Ccnb1. Cell Death & Differentiation, 2018.
.png)