外周神经损伤(PNI)是一种常见的临床问题,主要由外伤和手术干预引起,会造成长期残疾和增加治疗经济成本方面,导致严重的社会负担。众所周知,受伤的外周神经有内在的轴突再生能力,但其功能恢复能力却很差。因此,对周围神经损伤的有效治疗有待进一步的研究。目前,对周围神经损伤的临床前研究主要是在动物模型中进行的,而坐骨神经损伤(SNI)模型是研究周围神经损伤最常用的实验模型。通过使用SNI模型进行了许多实验,试图寻找能在周围神经损伤后促进神经再生和功能恢复的合适靶标。然而,现有的神经治疗方法无法达到该目的,部分原因是对创伤后细胞和分子机制的理解不够。
已有很多研究,发现非编码RNA对于外周神经损伤有很重要的影响,如miRNA和lncRNA。而且,环状RNA(circRNAs)作为一种新型的内源性非编码RNA,有其稳定性和多种多样的功能,如促进滚环翻译、调节母系基因的转录、有助于形成剪切mRNA和作为miRNA的sponges。circRNAs被大量研究报道,作为miRNA的sponges,调节基因的表达,在疾病的发生发展过程中发挥着重要的作用。可是,circRNAs对外周神经损伤的影响还是有很多未知的。

来自上海第二军医大学附属长征医院的朱磊研究团队最近在Mol Ther Nucleic Acids杂志在线发表了题为“Silencing of circRNA.2837 Plays a Protective Role in Sciatic Nerve Injury by Sponging the miR-34 Family via Regulating Neuronal Autophagy”的研究,通过大鼠坐骨神经损伤模型筛选到了表达水平下调程度最大的circRNA.2837,在体内和体外实验中,敲低circRNA.2837的表达水平会明显上调神经元细胞的自噬水平,机制上circRNA.2837可作为miR-34家族的sponge,调节miR-34下游的自噬通路,从而减轻坐骨神经损伤后的反应。
虽然该研究发表在不是很高分或者很有影响力的杂志,但是和之前解读的文章一样,都提供了想做circRNA研究的新手不错的研究套路,接下来我们解读一下。
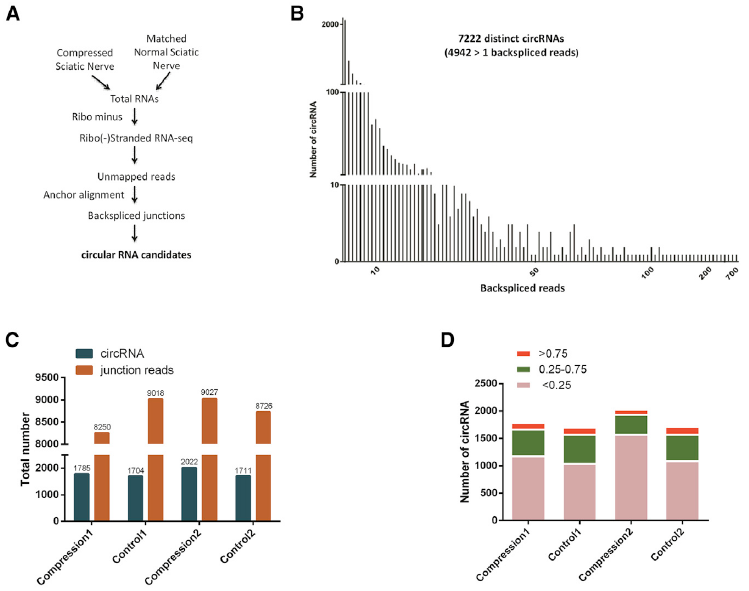
- 作者首先对大鼠坐骨神经损伤组织和正常组织进行RNA-seq分析circRNA表达差异情况,对RNA-seq的测序结果进行了circRNA种类分析、表达上调和下调的基因所占比例及其在各个染色体的位置分布统计、circRNAs来源哪些基因序列的分析、大鼠circRNA与人源circRNA同源保守序列对比分析、差异表达的circRNAs的GO及其涉及到的KEGG通路归类分析,而且通过qRT-PCR、特异性引物、Sanger测序验证了上调或者下调水平最高的20种circRNA,它们与circRNA-seq表达水平趋势一致,最终作者筛选到了下调程度最大(大于6.49倍)的circRNA.2837。circRNA.2837是由大鼠Slc25a16基因编码的,该基因定位在染色体20:27278618-27279990(-)。
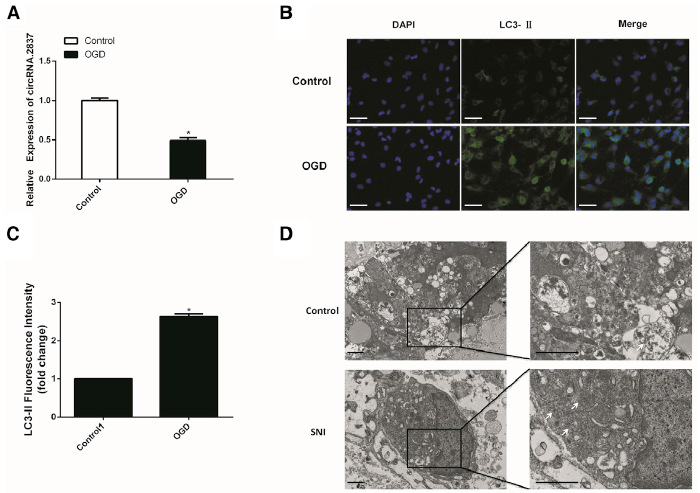
- circRNA.2837与自噬的联系
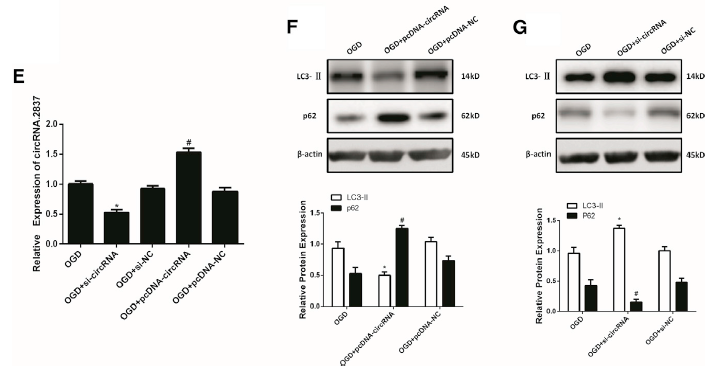
体外利用OGD刺激模拟体内坐骨神经损伤模型,诱导脊髓神经元细胞损伤后,circRNA.2837表达水平明显下调(A);confocal荧光成像发现OGD刺激会增加神经元的LC3-II的荧光表达水平(B);电镜成像发现大鼠受损的坐骨神经组织中存在大量的双层膜包裹的自噬体(D),说明脊髓神经损伤后自噬水平明显上调。通过转染si-circRNA和pcDNA-circRNA到原代脊髓神经元后,抑制circRNA.2837的表达水平,可以明显上调LC3-II的蛋白水平,而下调p62的蛋白水平;而促进circRNA.2837的表达水平后,可以明显下调LC3-II的蛋白水平,而上调p62的蛋白水平(F-G),进一步证明了在脊髓神经元损伤时,circRNA.2837会负调控自噬水平。
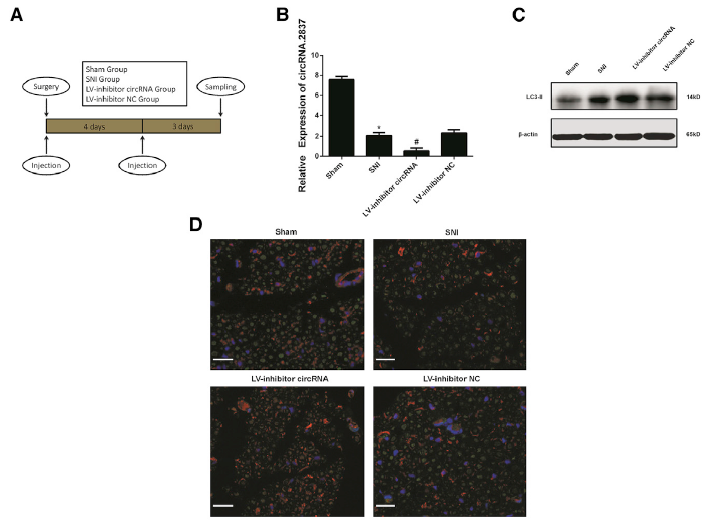
- circRNA.2837在体内坐骨神经损伤模型中是否会影响自噬水平?
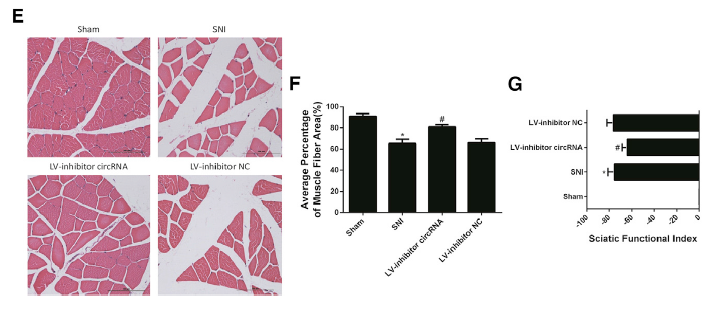
在Sprague-Dawley大鼠上建立坐骨神经损伤的技术路线(A);在体内模型中,应用慢病毒敲低circRNA.2837表达水平后的qRT-PCR验证(B),同时明显上调LC3-II的蛋白水平和荧光强度,而下调p62的蛋白水平,说明体内敲低circRNA.2837表达也会增加了神经元细胞的自噬水平(C, D);HE染色分析,发现敲低circRNA.2837表达水平会明显增加腓肠肌肌纤维面积,而脊髓损伤对照组,肌纤维面积急剧减少,同时大鼠移动功能恢复情况(SFI值)分析,说明敲低circRNA.2837表达水平会增加大鼠SFI值,促进大鼠肌肉功能恢复(E-G),这些结果都说明,体内敲低circRNA.2837表达水平会明显诱导自噬,从而减轻坐骨神经损伤。
- circRNA.2837通过什么机制诱导自噬?
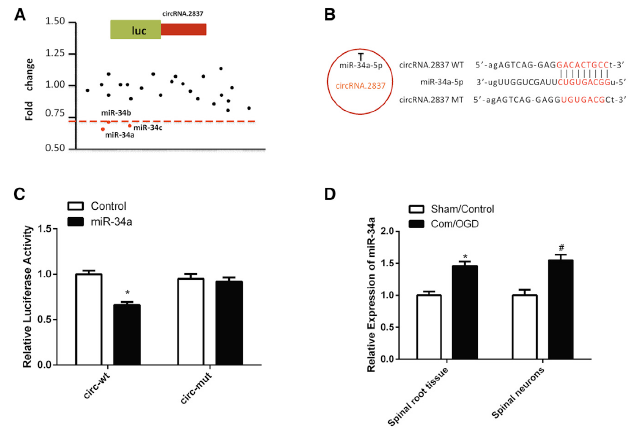
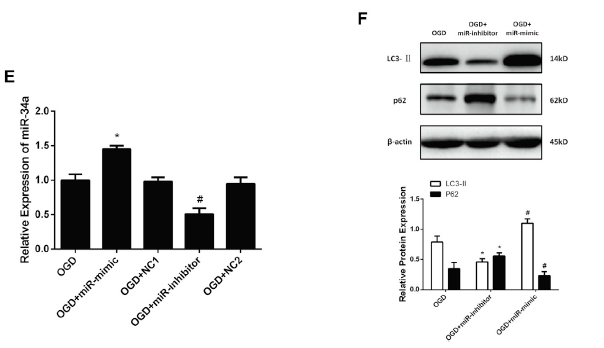
作者猜测circRNA.2837可以靶向miRNA,调节其下游基因的功能,通过miRanda和TargetScan数据库筛选到了25种miRNA可以结合到其3’UTR。接着利用荧光素酶报告基因实验验证它们的直接结合到circRNA.2837的3’UTR能力,发现miR-34a、miR-34b、miR-34c模拟物转染可以将荧光素酶活性表达降低了30%(A);miR-34a与circRNA.2837的3’UTR序列的比对情况(B);但是miR-34a无法影响含有circRNA.2837的3’UTR突变序列的荧光素酶报告基因表达(C),再次佐证了miR-34a特异性地结合circRNA.2837的3’UTR序列。体外OGD刺激模拟损伤和体内诱导坐骨神经损伤后,发现miR-34a的表达水平明显上调,这与相应下调的circRNA.2837水平呈负相关(D);接着在脊髓神经元细胞通过载体过表达或者敲低miR-34a的表达水平,相应的细胞自噬水平会明显上调或者下调,这也与circRNA.2837表达水平呈负相关(E-F),这提示circRNA.2837很有可能作为miR-34家族的sponge,从而影响miR-34靶基因的功能。
- 那circRNA.2837是否通过靶向miR-34a影响到了自噬通路?
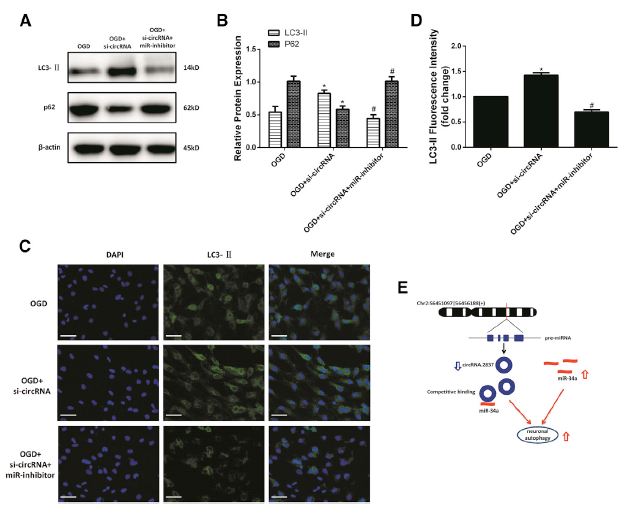
转染si-circRNA到原代脊髓神经元后,LC3-II 的蛋白水平、mRNA水平和荧光强度明显增加,而 p62蛋白水平和mRNA水平会明显降低,说明si-circRNA促进细胞自噬水平,而miR-34a抑制剂预处理会逆转之前的效应,而是抑制细胞自噬水平,这提示circRNA.2837靶向miR-34a调节神经元的自噬水平(A-D)。
参考文献
- Zhou ZB, Niu YL, Huang GX, et al. Silencing of circRNA.2837 Plays a Protective Role in Sciatic Nerve Injury by Sponging the miR-34 Family via Regulating Neuronal Autophagy. Mol Ther Nucleic Acids. 2018 Jul 25;12:718-729. doi: 10.1016/j.omtn.2018.07.011.
.png)