3月19日,Molecular Cell杂志在线发表了一项环状RNA的研究,报道RNA环化后并不诱发TLR/RIG-I介导的免疫反应,并且环化的RNA还能更有效的在小鼠组织中翻译蛋白,提示环状RNA可能是一个比较有效的蛋白表达工具,有可能用于疾病治疗[1]。

2017年Molecular Cell杂志就曾经发表一篇研究论文,报道细胞可以通过RIG-I通路识别内源生成的circRNA和外源的circRNA(Title: Sensing Self and Foreign Circular RNAs by Intron Identity)[2],这篇文章的假设是内源生成的circRNA从一开始就结合了很多蛋白,这些蛋白保护其不被RIG-I识别,体外合成的circRNA不具备这些结合蛋白,因此能够激活RIG-I介导的细胞免疫效应。本文的结论是外源的circRNA并不引起细胞的免疫效应。那么本文是通过什么实验和证据否定了之前的结论呢?环状RNA是否是一种安全有效的转基因载体?
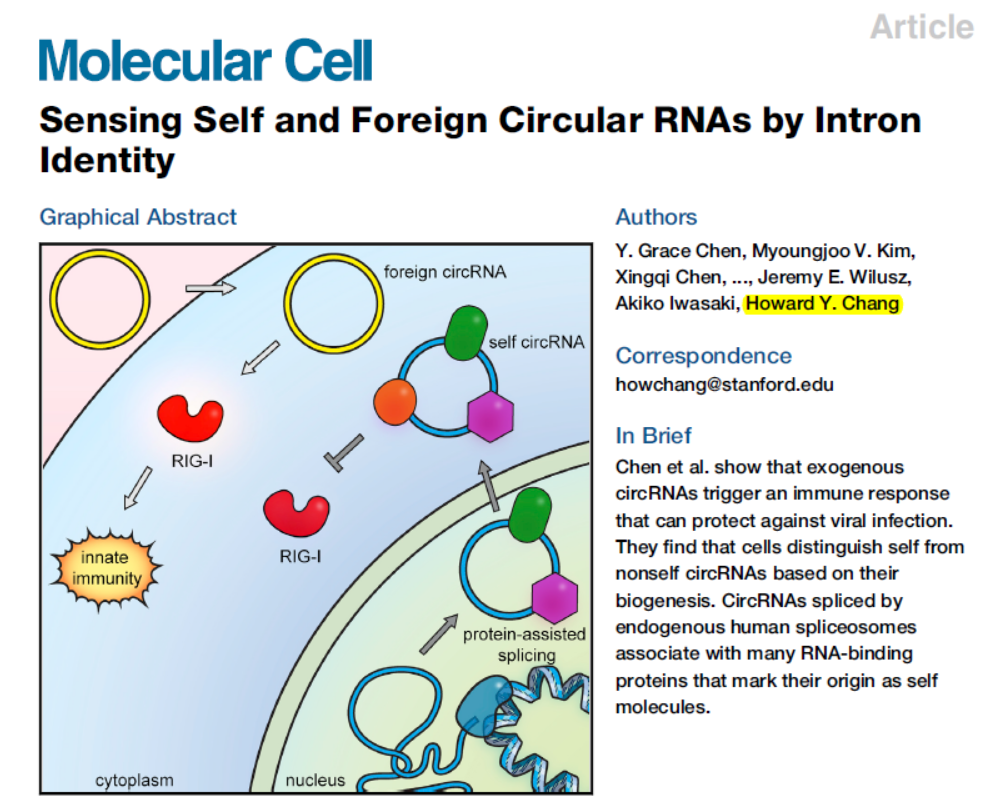
自然界中存在很多的RNA病毒,机体为有效抵御这些病毒的感染,进化出了复杂的免疫系统,其中针对RNA分子的识别受体是激活相关免疫机制的触发器。已知RNA感受器包括RIG-I,TLR-3/7/8等分子,它们可以识别不同的RNA或其降解产物。在利用长链RNA进行外源基因导入和表达的实验中,常引入特殊的RNA修饰以降低这些RNA感受器分子介导的免疫效应,这些修饰包括假尿苷修饰,N1-甲基假尿,5-甲氧基尿苷(5moU)修饰等等[1]。circRNA相对于线性RNA更稳定,是非常好的表达蛋白的工具,之前的报道表明外源的circRNA可能会引起RIG-I介导的细胞免疫效应,那么该如何降低或避免这个副作用呢?
体外高效获得环形RNA的工具
Wesselhoeft, R.A.等曾报道基于I型自剪切内含子设计的高效RNA环化工具[3]。本文中使用的环化载体中终产物circRNA包含了柯萨奇病毒的IRES元件(CVB3 IRES),Gaussia荧光素酶(GLuc)和Anabaena pre-tRNA的I型内含子,将其拆分后设计在待环化序列的两侧。在GTP和镁离子存在的条件下,能通过酯交换反应实现自动环化。
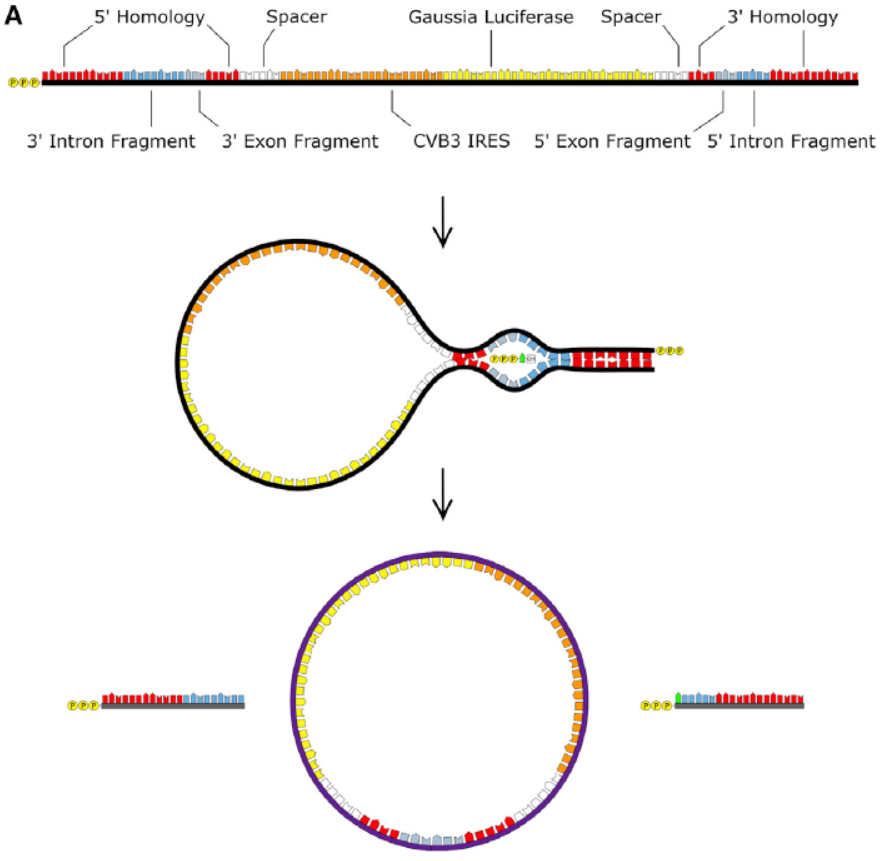
图1 基于I型内含子的RNA环化载体 ([1])
体外获得的circRNA纯度与细胞免疫效应的关系
为分析体外环化的circRNA分子表达荧光素酶和诱导免疫效应的情况,作者设计了多种对照和纯化条件进行分析,包括不环化的对照,环化产物分别基于RNase R预处理,HPLC纯化,RNase H处理,磷酸酶处理。结果表明经过磷酸酶处理后的产物对细胞的毒性作用最小,诱导免疫反应相关的细胞因子变化也最小。

图2 不同纯化条件的circRNA产物对细胞增殖和免疫效应因子的影响 ([1])
尽管作者已经竭尽全力争取得到最纯的circRNA分子,但从电泳质检的结果来看,始终有小部分的线性杂质存在,那么是不是这些线性的副产物导致了细胞的免疫效应?于是作者设计实验分析了环化过程中不同线性产物对免疫效应的影响情况。结果表明非环形的中间产物和副产物都有较强的诱导免疫反应的作用。

图3 不同环化过程产物对细胞免疫效应的影响 ([1])
假尿苷,N1-甲基假尿等化学修饰能够有效降低线性RNA诱导的免疫效应,那么这些修饰有没有可能帮助circRNA降低免疫效应,促进蛋白翻译效率呢?基于前述的自剪切环化载体,没法得到N1-甲基假尿修饰的circRNA,于是作者采用了基于T4-RNA连接酶I的替代方法,能获得40%左右纯度的带修饰的circRNA产物。但这种N1-甲基假尿修饰的circRNA转染细胞后无法检测到翻译产物。但这类化学修饰的circRNA分子和线性的RNA分子均不引起免疫效应,但对应的不修饰的线性RNA分子能诱导很强的免疫效应。内源circRNA的m6A修饰可促进ORF的翻译,作者因此设计将IRES替换为富A的序列,结果表明改造后的载体环化效率有所下降,在本文的实验体系中也没有检测到m6A修饰促进的外源circRNA的翻译。

图4 化学修饰对circRNA免疫性和翻译效率的影响 ([1])
circRNA对TLR受体的影响分析
TLR-3,7,8分别对病毒来源的双链RNA颈环和单链RNA其效应,体外合成的circRNA是否也能够影响TLR从而诱导免疫效应通路?作者设计了不同的线性和环形产物,分析结果表明体外环化的高纯度circRNA可以逃避激活TLR受体。

图5 circRNA对TLR的影响 ([1])
体外环化的circRNA可在体内翻译
为分析高纯度的体外环化circRNA能否在体内被有效翻译,作者在小鼠体内进行了分析。作者构建了环化的人促红细胞生成素的circRNA和带N1-甲基假尿修饰的线性mRNA,体外细胞实验表明两者翻译效率相当。注射小鼠后分析血清中游离分子的半衰期,表明circRNA存在的时间更持久。小鼠体内能够检测到注射体外环化的circRNA的翻译产物,表明高纯度的体外环化circRNA可以在体内实现有效,稳定的蛋白表达。作者最后还尝试脂质体进行体外环化circRNA的包裹和体内给药,结果表明体外环化的高纯度circRNA能够兼容纳米脂质体载体。

图6 体外环化circRNA可在小鼠体内稳定表达蛋白 ([1])
本文的结论有力的支持了circRNA作为蛋白表达工具的可行性,只要解决了纯度的问题,就可以成为很好的蛋白表达工具。
参考文献:
1. R. Alexander Wesselhoeft, P.S.K., Frances C. Parker-Hale, Yuxuan Huang, Namita Bisaria, and Daniel G. Anderson, RNA Circularization Diminishes Immunogenicity and Can Extend Translation Duration In Vivo. Molecular Cell, 2019.
2. Chen, Y.G., et al., Sensing Self and Foreign Circular RNAs by Intron Identity. Mol Cell, 2017.
3. Wesselhoeft, R.A., P.S. Kowalski, and D.G. Anderson, Engineering circular RNA for potent and stable translation in eukaryotic cells. Nat Commun, 2018. 9(1): p. 2629.
.png)