
非编码RNA序列,包括长链非编码RNAs,小核仁RNAs和非翻译mRNA区域,通过与RNA结合蛋白(RBPs)直接相互作用,实现许多不同的功能。最近的研究已经证实成百上千种新的RBPs缺乏已知的RNA结合域,表明了RNA—蛋白复合物的复杂性和多样性。研究RNA-蛋白质相互作用的方法有很多种,主要分为两大类:第一种是以感兴趣的RNA为中心,寻找与该RNA相互结合的蛋白质;第二种是以感兴趣的蛋白质为中心,寻找与该蛋白质相互结合的RNA。 每种方法都有独特的优势和局限性,因此选择最佳方法来解决相应的生物学问题是非常重要的。
RNA和蛋白质是可以相互作用的生物分子,两者通过物理性相互作用,调节彼此的生命周期和功能。mRNA编码序列指导蛋白质和一些调节序列的合成,而mRNA的非翻译区域通过调控蛋白质的翻译、定位和与其他蛋白质的相互作用,影响编码蛋白的命运。另一方面,从RNA合成到降解的过程中,蛋白质反过来可以结合和调控RNA的表达和功能。RNA与蛋白质的相互作用对于维持细胞稳态是非常重要的,而干扰两者的相互作用会造成细胞功能失调和相关疾病的发生。
这篇综述概述最新研究和鉴定RNA与蛋白质相互作用的方法,有望帮助科学家选择解决特定研究问题的最佳方法。虽然每个领域都有几种方法,但是本文聚焦在具有实质性概念和技术进步的最新研究方法。
- 新的研究方法有助于扩大结合RNA的蛋白组学
经典的RBPs一般包含RNA结合区域,但是最近的研究进展表明,新发现的RBPs并不包含已知的RNA结合区域。因此,如果只依靠蛋白序列和结构信息,是无法准确预测该蛋白是一种RBP。当利用UV交联法促进RNA与蛋白之间形成共价键,接着Oligo(dT)捕获poly(A)尾的蛋白,用于蛋白组分析以鉴定RBPs。但是这种方法局限在于只能鉴定结合含有poly(A)尾RNA的蛋白。后来的研究发展了一种click-chemistry-assisted RNA interactome capture (CARIC)研究方法,利用炔基尿苷类似物代谢性标记RNAs,可以捕获任意RNAs,而不局限于含有poly(A)尾的RNA。结合以上两种研究方法,大量的RBPs逐渐被发现,提示大约5%的人蛋白组属于RBPs。
- RNA-centric法:以感兴趣的RNA为中心,寻找与该RNA相互作用的蛋白质,分为以下三种研究方法:
- 体外RNA-centric法
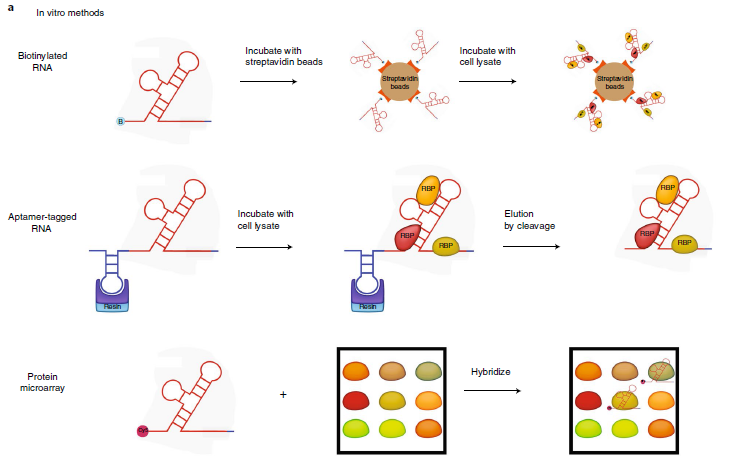
图1 体外方法: 顶部图, 合成5’或3’末端标记生物素的RNA并与链霉亲和素结合。重组蛋白或细胞提取蛋白与RNA结合。 洗涤后,将珠子煮沸以洗脱并鉴定与RNA结合的蛋白质;中间图表示适体(S1,Cys4)标记的RNA捕获方法。感兴趣的RNA是体外转录合成的带有RNA标签(蓝色),RNA标签将RNA(红色)结合到树脂支持物上,加入细胞提取物中的蛋白质与RNA结合。 洗涤步骤后,Cys4和S1适体方法分别用咪唑和生物素洗脱RNA复合物。 底部图,蛋白质微阵列的示意图。体外转录RNA并带上Cy5标记。 然后将RNA加入到包含大约9400种蛋白质点样的人蛋白芯片中。 洗涤步骤后,使用荧光检测和定量结合在微阵列斑点蛋白的RNA。
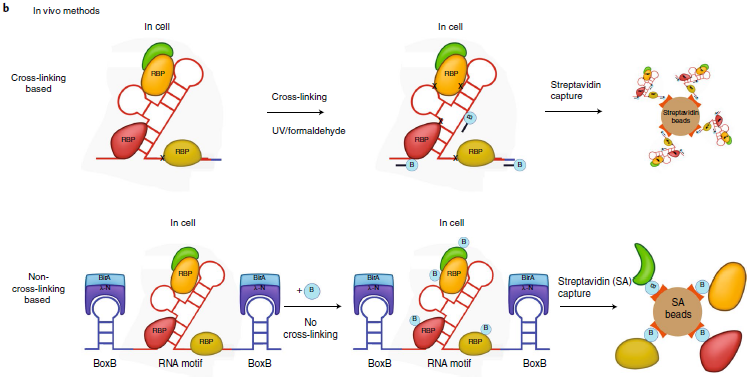
图2 顶部图,体内交联方法的示意图。 基于交联的方法使用UV(RAP,PAIR,MS2-BioTRAP,TRIP法)或甲醛交联(CHART,ChIRP法)。 生物素化的寡核苷酸探针与感兴趣的RNA杂交,最终纯化RNA和交联蛋白以用于下游分析。 底部图,体内非交联方法(RaPID法)的示意图。 BoxB RNA茎环(蓝色)位于感兴趣的RNA序列(红色)的侧翼。 RaPID(LN-HA-BirA *)融合蛋白与BoxB位点结合,导致生长在含有生物素的培养基中的活细胞中与插入RNA序列相关的蛋白发生生物素酰化。链霉亲和素珠子用于捕获生物素化的蛋白。
- 体内交联法
研究人员可通过RNA-蛋白质交联鉴定体内两者的相互作用,原理是在变性情况下,排除非共价结合的相互作用,纯化RNA,接着只提取发生交联的蛋白以用于鉴定。
甲醛是一种小的双功能交联剂,可以很容易地渗透细胞并交联2Å距离内的大分子,包括蛋白质—蛋白质,蛋白质—DNA和蛋白质—RNA复合物,形成可逆的共价连接,导致很难区分蛋白质—蛋白质,蛋白质—RNA交联情况下的蛋白。 甲醛更倾向于促进亲核赖氨酸残基发生交联。ChIRP和CHART法的原理都是基于甲醛交联法,研究RNA与蛋白的相互作用。
UV光则以零距离和不可逆的共价键形式促进蛋白质与核酸发生交联,有轻度的尿苷交联倾向性,而不会促进蛋白质—蛋白质交联,这点比甲醛交联法更特异,但对于双链RNA的交联效果偏差,对于蛋白的交联效果取决于氨基酸。RAP、PAIR、MS2-
BioTRAP和TRIP法的原理都是基于UV交联,但是具体的实验步骤不一样。
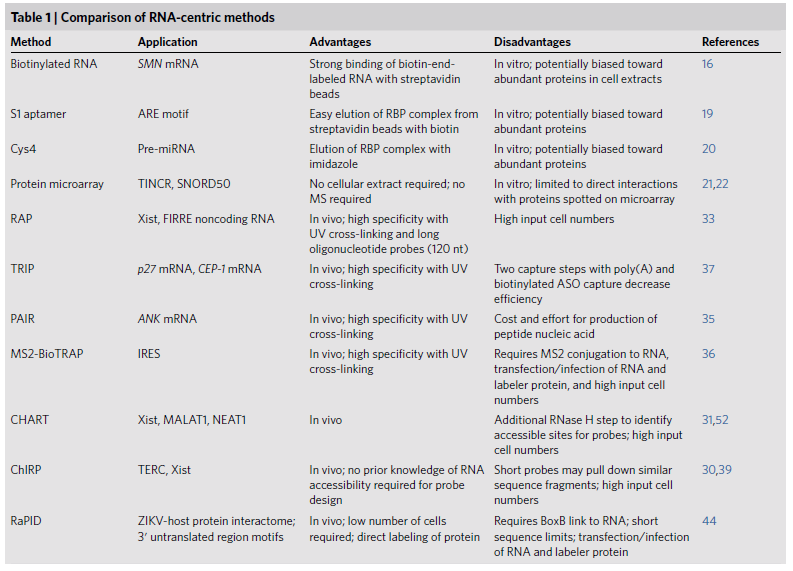
表1 各种RNA-centric法的优点、缺点和应用范围
- 体内非交联法
近来,不要分子交联研究内源蛋白相互作用的技术,邻近蛋白质组学(Proximity proteomics)也被用于活细胞内以RNA为研究中心的RNA-蛋白质相互作用的研究。生物素连接酶‘Promiscuous’可将生物素转化为活性的biotin-5-AMP,其可共价标记附近的赖氨酸残基,基于这一特性,Promiscuous被用于蛋白-蛋白相互作用的研究。胞内环境是处于还原性状态的,biotin-5-AMP被释放后在20nm距离内会发生淬灭而变成失活的。所以相比于其他蛋白,20nm距离内的蛋白会优先被标记上生物素。RaPID方法用于检测RNA–蛋白相互作用,其原理在于利用这种空间检测限制来检测RBPs,通过用BoxB适体标记感兴趣的RNA,招募λ-N和‘Promiscuous’生物素连接酶的融合蛋白。生物素“传播者”通过λ-N域结合BoxB适体,标记与RNA结合的蛋白。
- 蛋白组学分析
对于大多数RNA-centric方法的后续分析,一般采取定量质谱MS来挖掘新的RBPs。定量质谱技术又分为标记和无标记质谱法两种 。质谱标记分析法包括SILAC 和iTRAQ,适用于甲醛交联法和体外RNA-centric法,但是这些分析方法的特异性较差,其结果容易被非特异结合的蛋白所干扰,技术要求高,耗费昂贵。无标记质谱分析法的局限性在于无法区分和RNA真正结合的蛋白与非特异结合的蛋白。SAINT分析工具用于分析非定量质谱来源的光谱计数数据,有效地评分RNA-蛋白的真正相互作用的可能性。建议设置两个以上的重复样本,提高说服力和避免非定量质谱分析中出现的假阳性。
四、如何选择合适的RNA-centric方法
通过上面对各种RNA-centric方法的介绍,那么如何选择最优的研究方案应用于特定的研究问题?主要考虑到三个因素:
1. 首先决定选择体内还是体外方法来研究。一般来说,体外RNA-centric方法用于验证已知的RNA-蛋白的相互结合,而体内RNA-centric方法用于发现新的RNA-蛋白的相互结合;
2. 第二个考虑的因素是RNA丰度。细胞内的RNA丰度越高,用于体内研究RNA-蛋白的相互结合所需的细胞数量越少;
3. 第三个考虑的因素是研究的RNA-蛋白相互作用的强度,主要影响到交联研究方法的选择。
五、蛋白-centric方法:以感兴趣的蛋白为中心,寻找与该蛋白相互作用的RNAs
蛋白-centric方法的原理,要么直接纯化蛋白,在寻找与之相关的RNAs;要么在某种程度上取决于RNA与感兴趣的蛋白质相关,使用选择性化学修饰的RNA。最常见的研究方法是利用大约254nm UV光照射后,体内蛋白可以化学性地交联核酸,接着纯化感兴趣的蛋白,高通量测序鉴定与之结合的RNAs,这种方法也叫交联免疫沉淀法—高通量测序(CLIP-seq)。但是这种方法局限性在于无法免疫纯化到足够的交联RNA。
1. 作者重点介绍了不同CLIP-seq实验流程,从免疫沉淀纯化蛋白与RNA复合物到PCR扩增检测的过程。
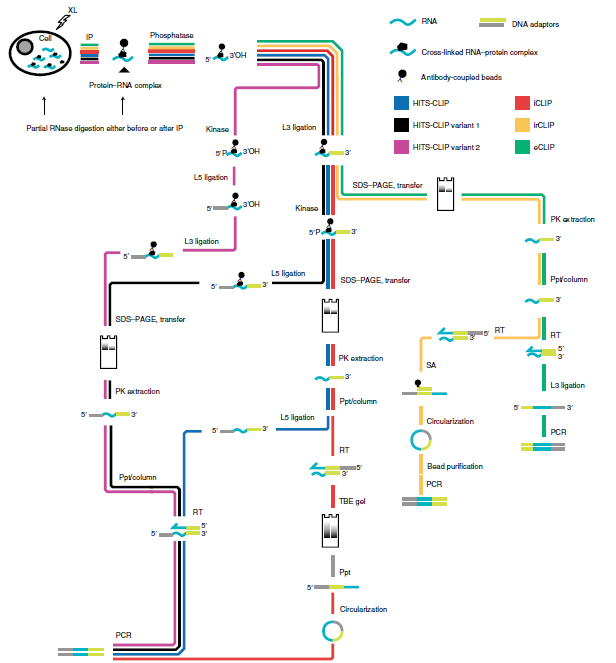
图3 CLIP实验方案图,从免疫沉淀到PCR。重点介绍了代表性的不同类型CLIP-seq的实验步骤。 并非所有步骤都包含在内。 XL,UV交联; IP,免疫纯化; phosphatase,去除3’磷酸基团; kinase,用于添加5’磷酸; RT,逆转录; L3, RNA或DNA3’端连接适体; L5,5’端适体连接; PK提取,蛋白酶K从硝酸纤维素膜中提取;Ppt /柱,乙醇沉淀或过柱清除核酸; TBE,Tris-borate-EDTA; SA,链霉亲和素。
2. 基于CLIP-seq原理研究与感兴趣蛋白结合的RNAs的不同研究方法的具体优点和缺点
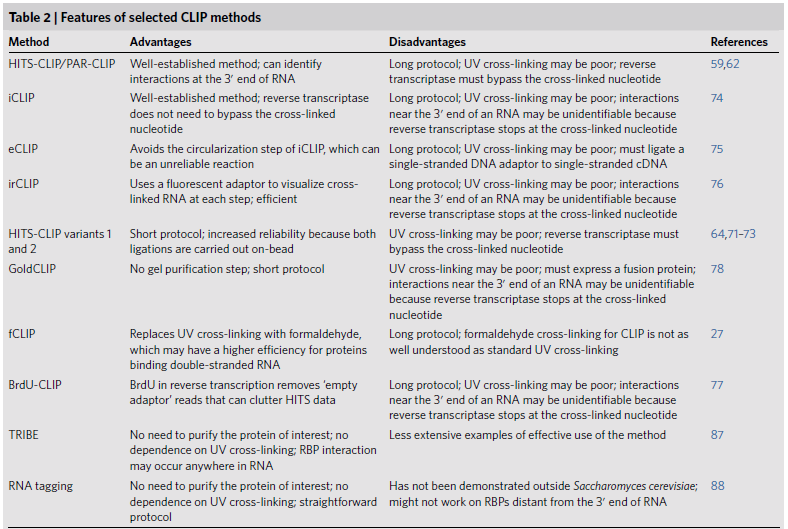
表2 鉴定与感兴趣蛋白结合的RNA的研究方法的优点和缺点(前8种方法基于交联后免疫沉淀的原理,而最后两种方法基于非蛋白纯化,而是依赖于RNA的两种不同化学修饰的原理,鉴定与RBP结合的RNAs)
3. CLIP-seq数据的分析方法
目前还没有通用标准用于CLIP-seq数据分析,这主要取决于研究目的和背景。分析过程中最大的问题在于对CLIP-seq数据的定量。

表3 用于分析CLIP-seq数据的统计方法
小结:非编码RNA包括lncRNAs、snRNAs、circRNAs等,通过直接与RBPs相互作用,发挥其相应的生理功能。虽然circRNA被报道最多的功能是作为miRNA的sponge,但也有研究发现circRNA也可以结合并海绵蛋白,发挥调控疾病发生发展的功能。本文介绍了研究RNA与蛋白相互作用的各种方法,RNA-centric方法是以感兴趣的RNA为中心,寻找与之结合的蛋白,可以分为体内和体外两类研究方法;protein-centric方法则是以感兴趣的蛋白为中心,寻找与之结合的RNAs,可以分为基于CLIP和非CLIP原理的两类研究方法。这为研究circRNA与蛋白的相互作用提供了一定的研究思路。
参考文献
1. Ramanathan M, Porter DF, Khavari PA, et al. Methods to study RNA-protein interactions. Nat Methods. 2019 Mar;16(3):225-234. doi: 10.1038/s41592-019-0330-1.
.png)