图片摘要:众所周知,circRNA可以被m6A修饰,本文发现circRNA也能调控总RNA的 m6A修饰。
RNA m6A修饰是近期的热点方向之一,各种RNA都会存在m6A修饰,如mRNA, lncRNA,circRNA,rRNA,miRNA等等。目前已发表的circRNA m6A修饰的文章主要探讨了circRNA的m6A修饰状态和相关的功能机制,circRNA是否参与调控总RNA的 m6A修饰还很少研究。近期,Biological Psychiatry杂志(IF=11.501)发表了一项有趣的工作,发现circSTAG1可以通过结合ALKBH5阻止其入核,影响总RNA的m6A修饰,从另一个角度探讨了circRNA与m6A修饰的关系([1])。文章的通讯作者是东南大学的姚红红教授。

作者发现circSTAG1可以结合ALKBH5,抑制其入核,进而改变总RNA的m6A修饰,提高了包括FAAH mRNA等RNA的m6A修饰水平。CUS抑郁症小鼠海马区的circSTAG1表达显著降低,通过ALKBH5改变了FAAH mRNA的m6A修饰,最终导致抑郁症表型([1])。
CircSTAG1在严重抑郁症(MDD)小鼠模型和病人标本中低表达
为分析circRNA在MDD中的作用,作者利用高通量测序分析了CUS模型小鼠的海马区的全转录组,分析到了217种显著差异的circRNA分子,其中18种circRNA是人和小鼠高度保守的。经过QPCR检测,circDOCK4-1, circSTAG1, circKALRN 及circDOCK4-2与测序的变化趋势一致,四种circRNA分子在CUS模型中均显著下调。血浆检测结果则显示,这四种circRNA分子中,只有circSTAG1在人和小鼠的血浆标本中有相同的变化趋势,因此选择该分子进行下一步的研究。
circSTAG1由STAG1基因的2-5外显子反向剪切形成。相对于对照组,CUS模型小鼠的海马区,血浆和全血中circSTAG1均明显降低,但STAG1基因的mRNA变化不明显。circSTAG1似乎是脑组织特异性表达的分子,在心脏,肝脏,脾脏,肺和肾脏中表达都很低。MDD患者血清和全血中circSTAG1表达丰度均显著下降,ROC分析的AUC值可达0.763。circSTAG1的表达与评估抑郁症的几种指标均表现出显著的 负相关。
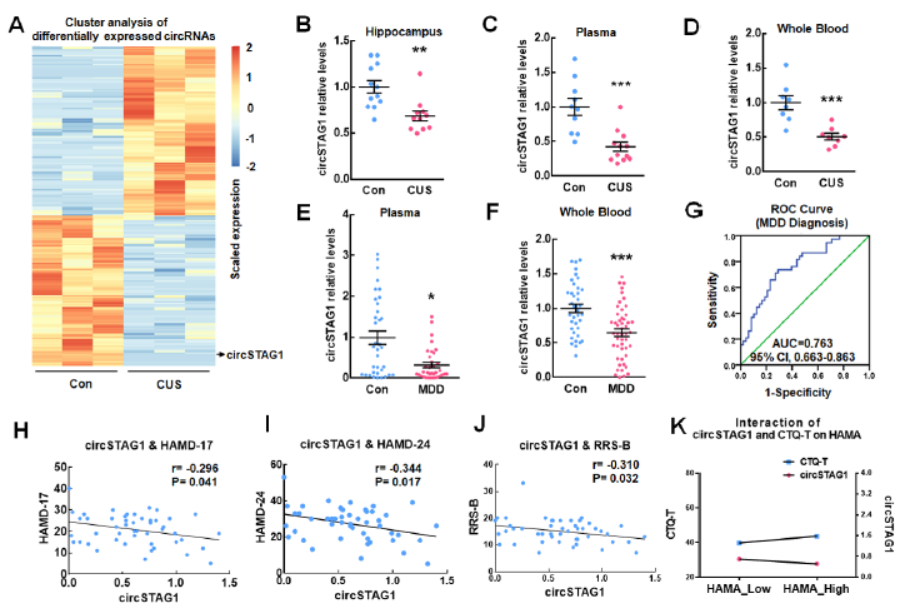
图1 严重抑郁症(MDD)小鼠模型和病人标本中circSTAG1显著降低 ([1])
过表达circSTAG1可改善抑郁样行为
通过海马区注射过表达circSTAG1的AAV载体,作者分析了circSTAG1在CUS抑郁症模型小鼠体内的作用。结果显示,过表达circSTAG1能够显著改善抑郁症样行为。
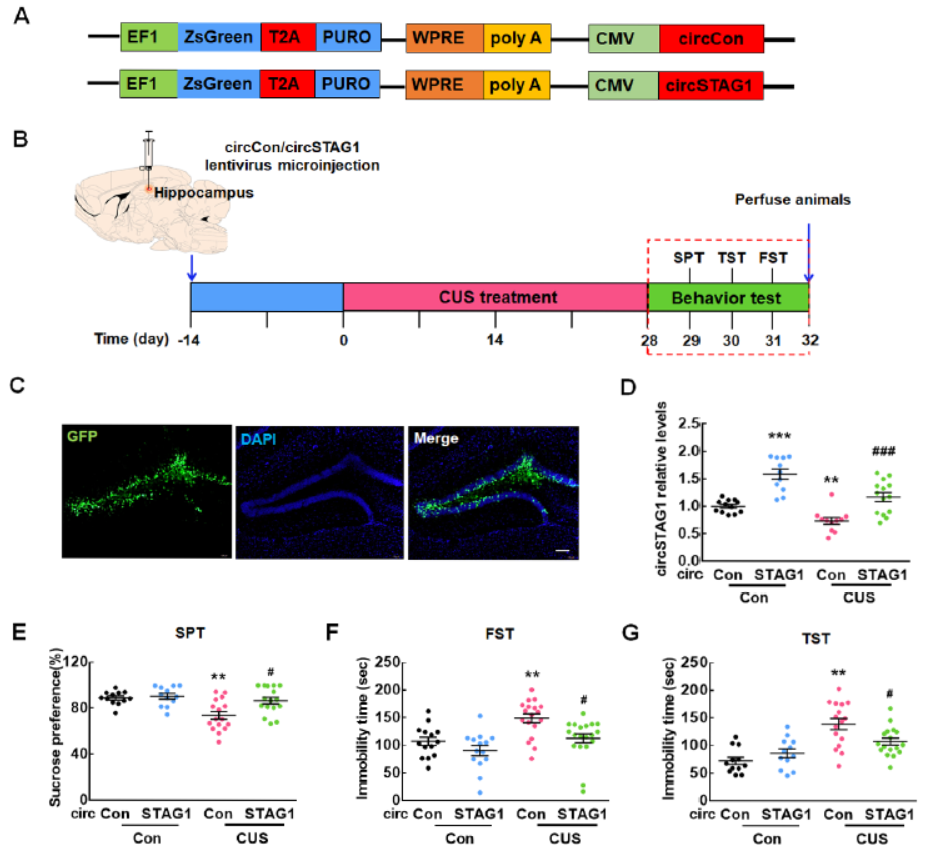
图2 体内过表达circSTAG1可改善抑郁症样行为 ([1])
过表达circSTAG1可缓解CUS模型小鼠海马区星型胶质细胞的功能障碍
基于表面标志物分离CUS模型小鼠海马区的神经元,星型胶质细胞和小胶质细胞,分析了它们的circSTAG1表达状况,结果表明,CUS模型小鼠海马区的星型胶质细胞中circSTAG1显著下降,其他细胞类型的表达略有下降,但变化不显著。FISH原位杂交也证明了这一现象。已知CUS模型小鼠带有神经炎症,会导致星型胶质细胞的功能障碍。于是作者分析了circSTAG1表达与星型胶质细胞功能障碍的关系。GFAP免疫组化分析表明CUS模型小鼠海马区的星型胶质细胞减少,但过表达circSTAG1可明显改善。星型胶质细胞分支水平分析也证明过表达circSTAG1可明显缓解星型胶质细胞的功能障碍。
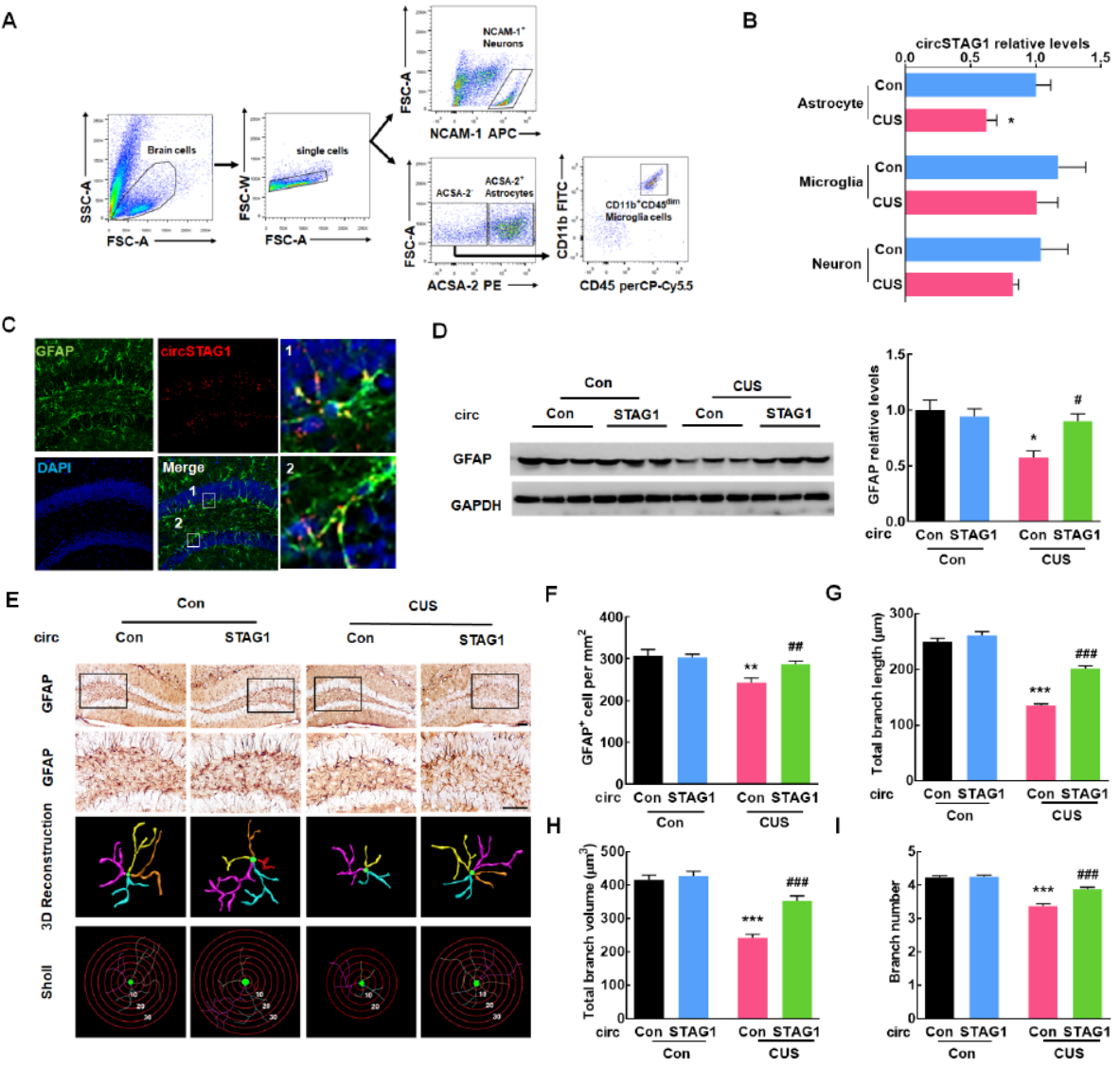
图3 过表达circSTAG1缓解星型胶质细胞的功能障碍 ([1])
circSTAG1结合ALKBH5,调控总RNA m6A修饰
已知RNA m6A修饰与抑郁症有关,作者首先分析了CUS模型小鼠海马区总RNA m6A修饰水平,结果表明CUS处理后总RNA m6A修饰显著下降,但过表达circSTAG1可抵消这一变化。过表达circSTAG1并不显著改变m6A修饰的Writer和Eraser蛋白。那么circSTAG1如何改变总RNA的m6A修饰的?是否通过与某种Writer和Eraser蛋白的相互作用实现?于是作者利用RIP实验进行了分析,结果表明,METTL3,METTL14,WTAP及FTO均不能显著富集circSTAG1,但ALKBH5能够显著富集circSTAG1,但不会富集STAG1线性RNA及阴性对照circRNA (作者选了circHECW2)。RNA Pull-down实验也验证了这一现象。CatRAPID 算法可以预测circRNA与蛋白的相互作用位点。经过分析,ALKBH5的345-395aa可能是结合circSTAG1的区域。缺失345-395aa的ALKBH5不再能捕获circSTAG1。circSTAG1位点突变实验也证实了预测的结果。
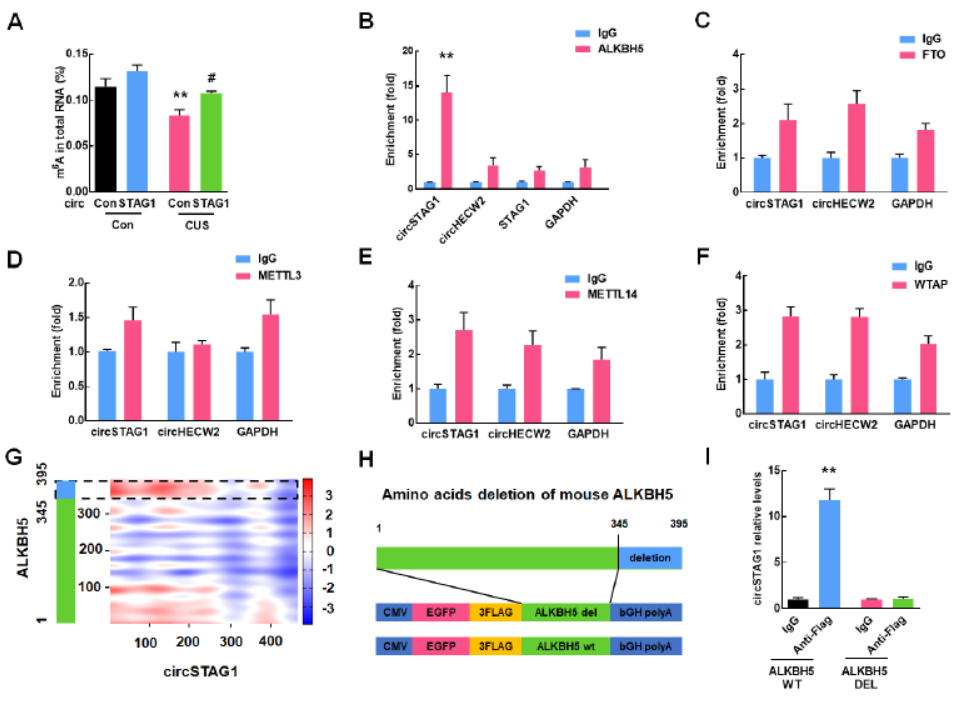
图4 circSTAG1可以结合ALKBH5([1])
CUS处理可改变ALKBH5的定位
CUS处理并不能改变ALKBH5的表达,过表达或干扰circSTAG1也不会改变。ALKBH5的定位是否受到影响呢?分离胞质和核组分后,作者证明了CUS处理后ALKBH5的胞质定位减少,核定位增多。过表达circSTAG1后ALKBH5的胞质定位增多,核定位减少。利用AAV载体在体内干扰ALKBH5也能诱导抑郁样行为。
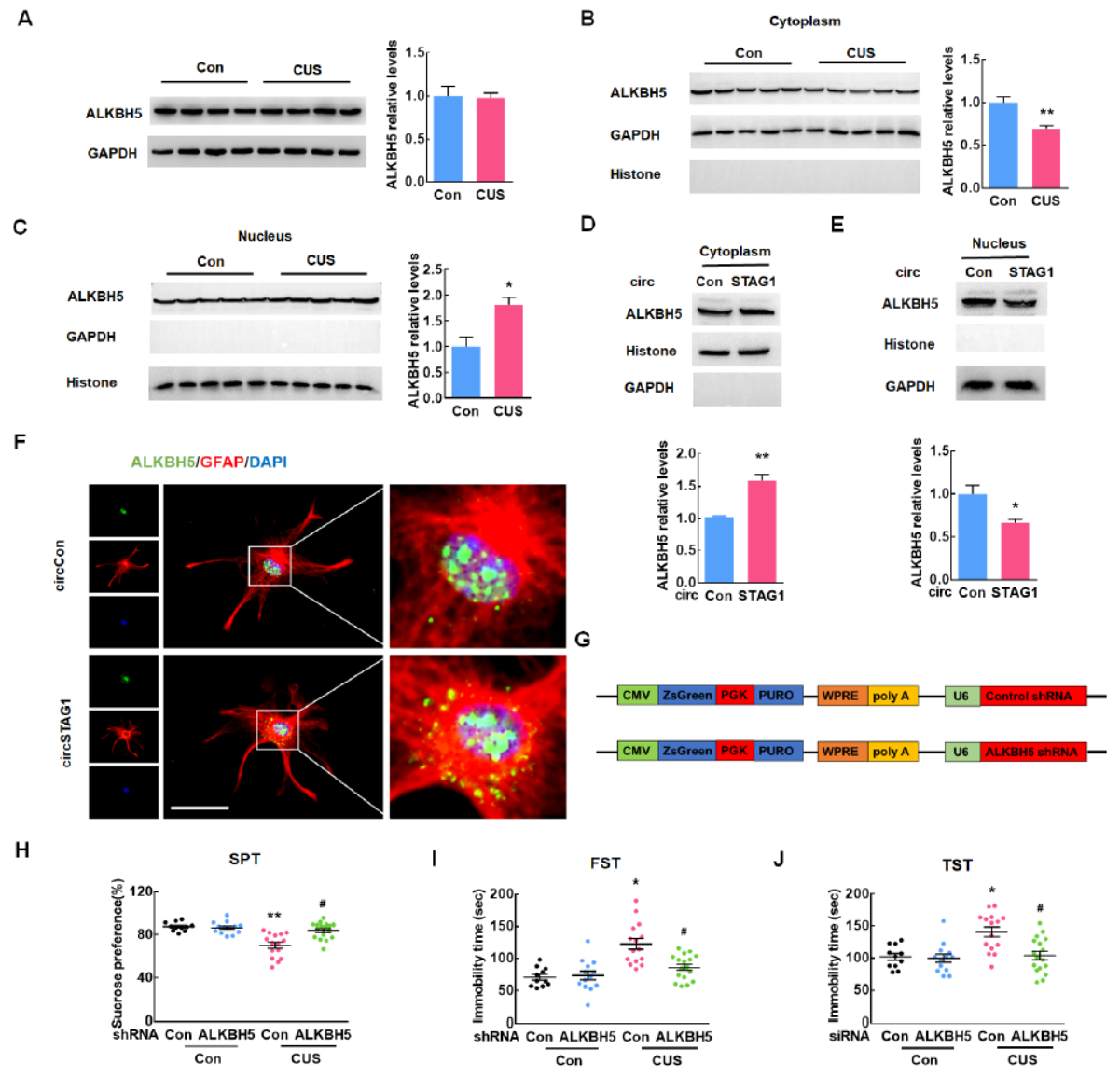
图5 CUS处理改变ALKBH5定位 ([1])
CUS处理后ALKBH5介导FAAH mRNA的m6A修饰
meRIP-seq分析表明,CUS处理后很多RNA的m6A修饰发生了变化。修饰位点集中在mRNA的ORF终止密码子和3’UTR区。针对修饰差异显著的基因进行通路分析。在富集分析的结果中,作者找到了FAAH基因,该基因存在两个m6A修饰 Peak,均在3’UTR区。SRAMP分析表明有四个潜在的m6A修饰位点,分别设计QPCR引物,然后分析meRIP后片段化产物丰度,结果显示,四个位点在CUS组均有显著下降。荧光素酶报告基因分析结果表明干扰ALKBH5后野生型序列的RNA会明显被降解,但m6A修饰位点突变后这一变化消失。
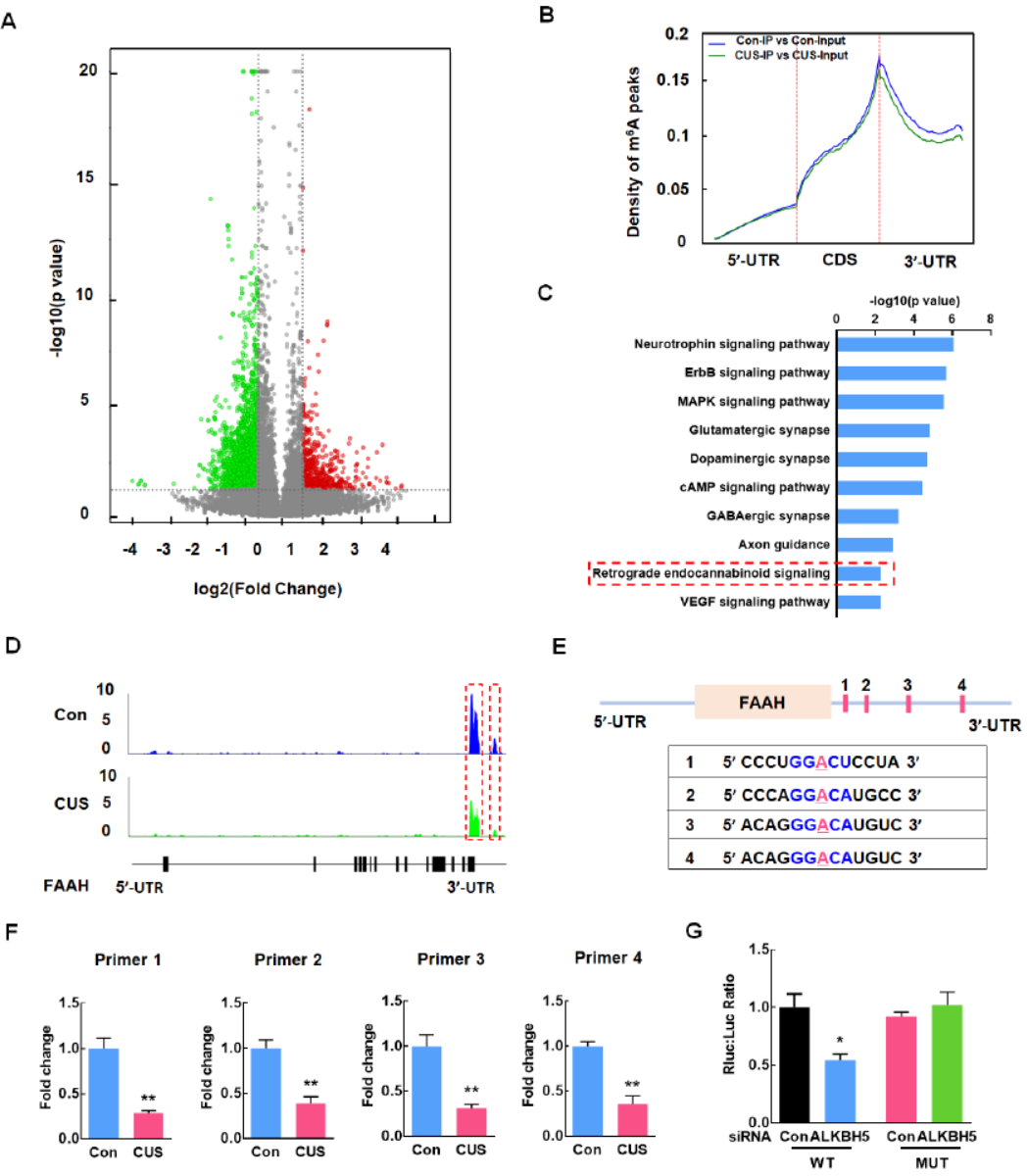
图6 CUS处理后ALKBH5介导FAAH mRNA的m6A修饰 ([1])
circSTAG1通过ALKBH5调控FAAH mRNA的m6A修饰
CUS处理小鼠的海马区FAAH 的mRNA和蛋白的表达均显著升高。星形胶质细胞中干扰ALKBH5后可降低FAAH的mRNA和蛋白水平。干扰circSTAG1后FAAH的mRNA和蛋白水平可以显著增高,但同时干扰ALKBH5,这一变化就抵消了。这表明circSTAG1可以通过ALKBH5调控FAAH的表达。皮质酮处理可显著抑制星形胶质细胞的增殖,但过表达circSTAG1后这一抑制作用被抵消。分别干扰circSTAG1,ALKBH5和FAAH也表明了上述通路在细胞内是存在的。
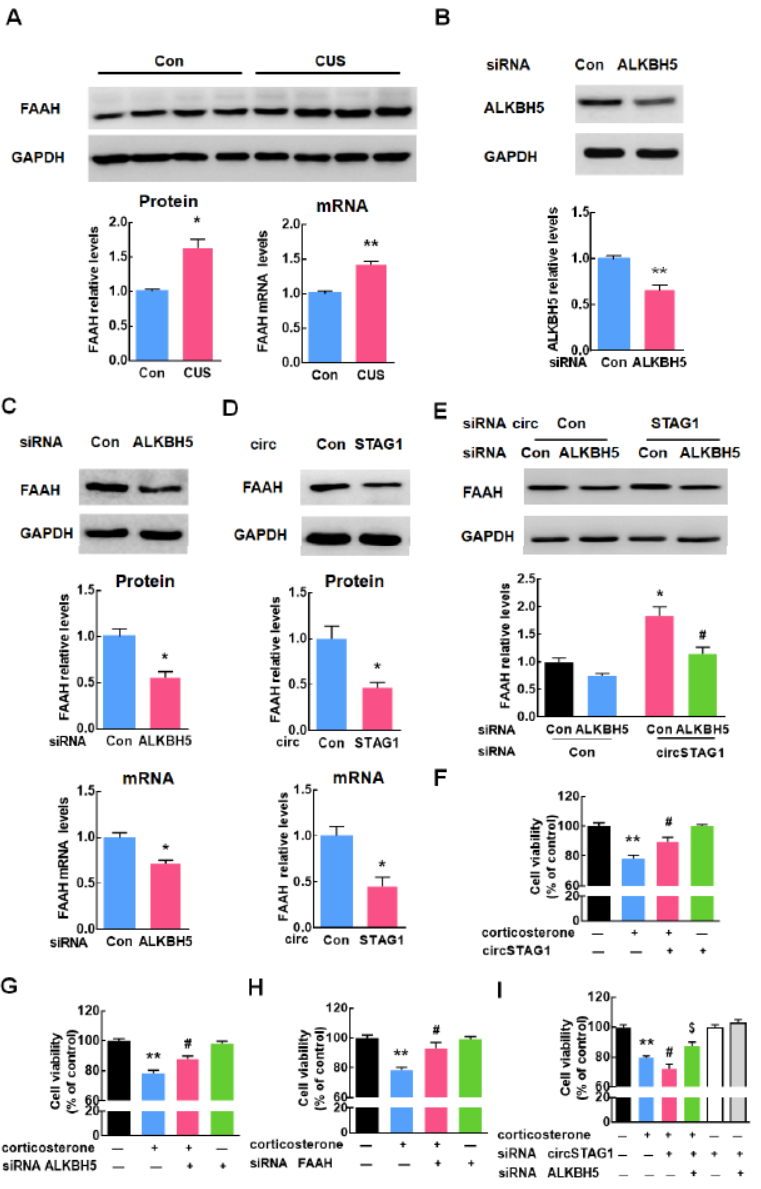
图7 circSTAG1通过ALKBH5调控FAAH mRNA的m6A修饰 ([1])
本文为分析circRNA和m6A修饰关系提出了新的角度,circRNA不仅能被m6A修饰,也可以通过结合m6A修饰的酶,实现对m6A修饰过程的调控作用。
参考文献
1. Huang, R., et al., N(6)-Methyladenosine Modification of Fatty Acid Amide Hydrolase Messenger RNA in Circular RNA STAG1-Regulated Astrocyte Dysfunction and Depressive-like Behaviors. Biol Psychiatry, 2020.
.png)