8月18日,血液学顶级杂志Blood发表了一篇circRNA的研究论文,报道在FLT3-ITD型急性髓系白血病(AML)中circMYBL2通过结合PTBP1促进FLT3蛋白翻译。文章的通讯作者是中山大学的陈月琴教授[1]。

FLT3-ITD是在FLT3基因中间的一段串联重复序列突变,该突变可导致Y591的自磷酸化,进而激发下游通路的过度激活,最终促进白血病的进程。FLT3-ITD突变型的AML病人预后较差且容易复发。FLT3的抑制剂可缓解这类白血病患者病情,但往往会因为FLT3基因的二次突变而导致耐药。因此,依然需要开发FLT3突变AML疾病新的治疗靶点。本文基于GEO数据分析,筛选到来自MYBL2基因的一个circRNA分子(circMYBL2),circMYBL2可以特异性的在FLT3-ITD阳性的AML细胞系中促进细胞增殖。机制方面,circMYBL2可通过结合PTBP1促进FLT3蛋白的翻译效率,进而促进疾病进程。有趣的是,作者的结果表明干扰circMYBL2对于FLT3抑制剂耐药的细胞也是有效的,说明circMYBL2是一个潜在的FLT3-ITD AML的治疗靶点。下面就让我们一起学习一下这篇文章:
如何发现circMYBL2的?
作者通过GEO数据分析了FLT3-ITD阳性和阴性的AML病人数据,发现了373种差异表达的circRNA分子,其中有28种分子的来源基因是已报道的与AML疾病发生发展有关的,其中便包括circMYBL2。circMYBL2来源于MYBL2基因的8-9外显子,QPCR表明circMYBL2在FLT3-ITD阳性病人中表达量显著高于阴性的患者,大约高出5倍左右。circMYBL2主要定位于胞浆,可耐受RNase R消化。
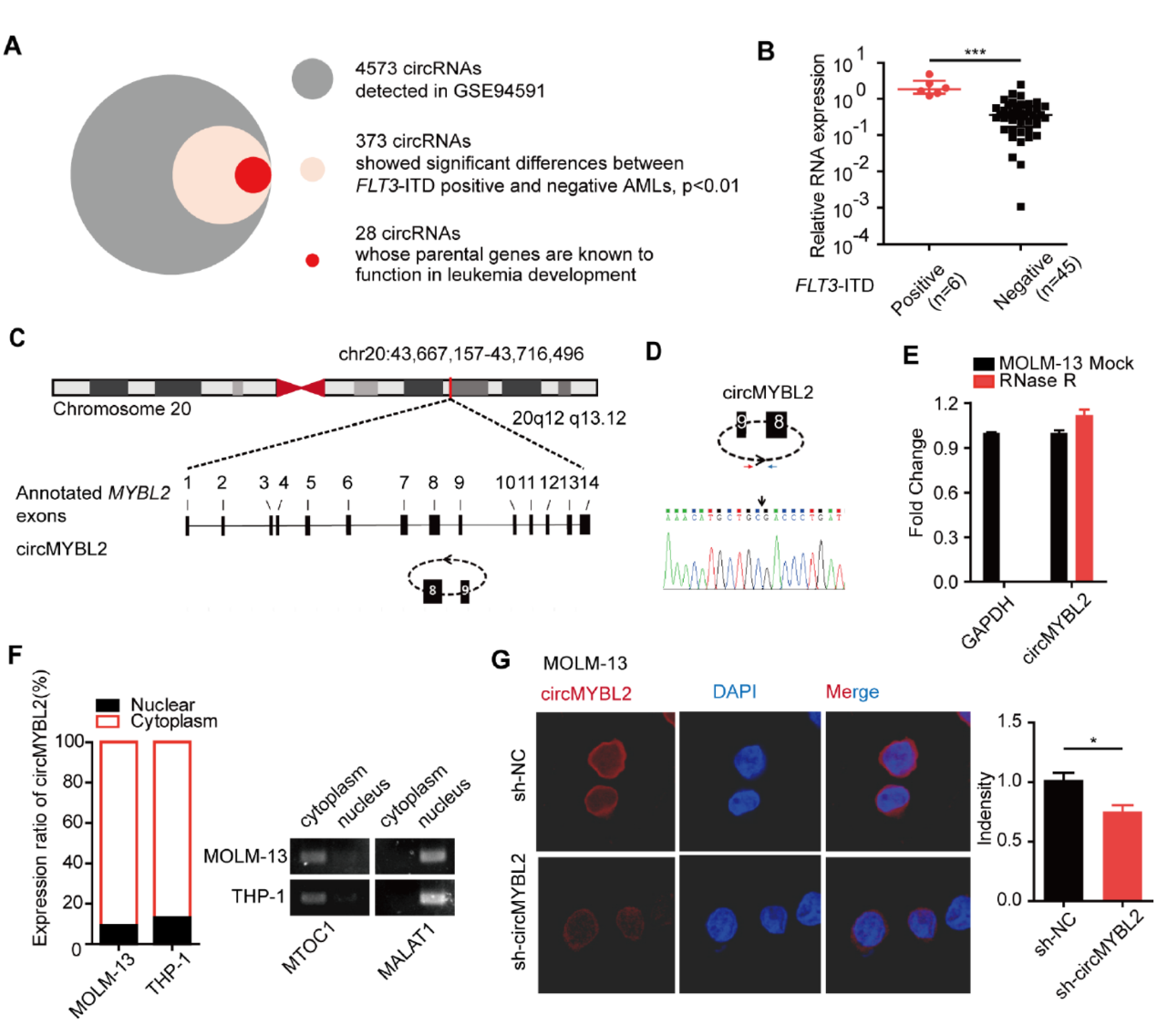
图1 circMYBL2在FLT3-ITD阳性AML中高表达 ([1])
敲降circMYBL2可特异性的抑制FLT3-ITD阳性AML细胞的增殖并可克服quizartinib耐药性
为分析circMYBL2在FLT3-ITD阳性和阴性细胞中的功能,作者设计了siRNA进行分析。所设计的siRNA仅能对circMYBL2起敲降作用,但对起来源基因MYBL2没有影响。circMYBL2敲降后对FLT3-ITD阳性的MOLM-13细胞和MV4-11细胞具有显著的抑制增殖功能,也可以促进其凋亡。但在FLT3-ITD阴性的THP-1,ML-2和HL60细胞中效应不明显。敲降circMYBL2也可显著抑制FLT3-ITD阳性患者AML细胞克隆形成,但对FLT3-ITD阴性的AML患者细胞克隆形成没有明显影响。说明circMYBL2仅在在FLT3-ITD阳性AML中特异性发挥作用。
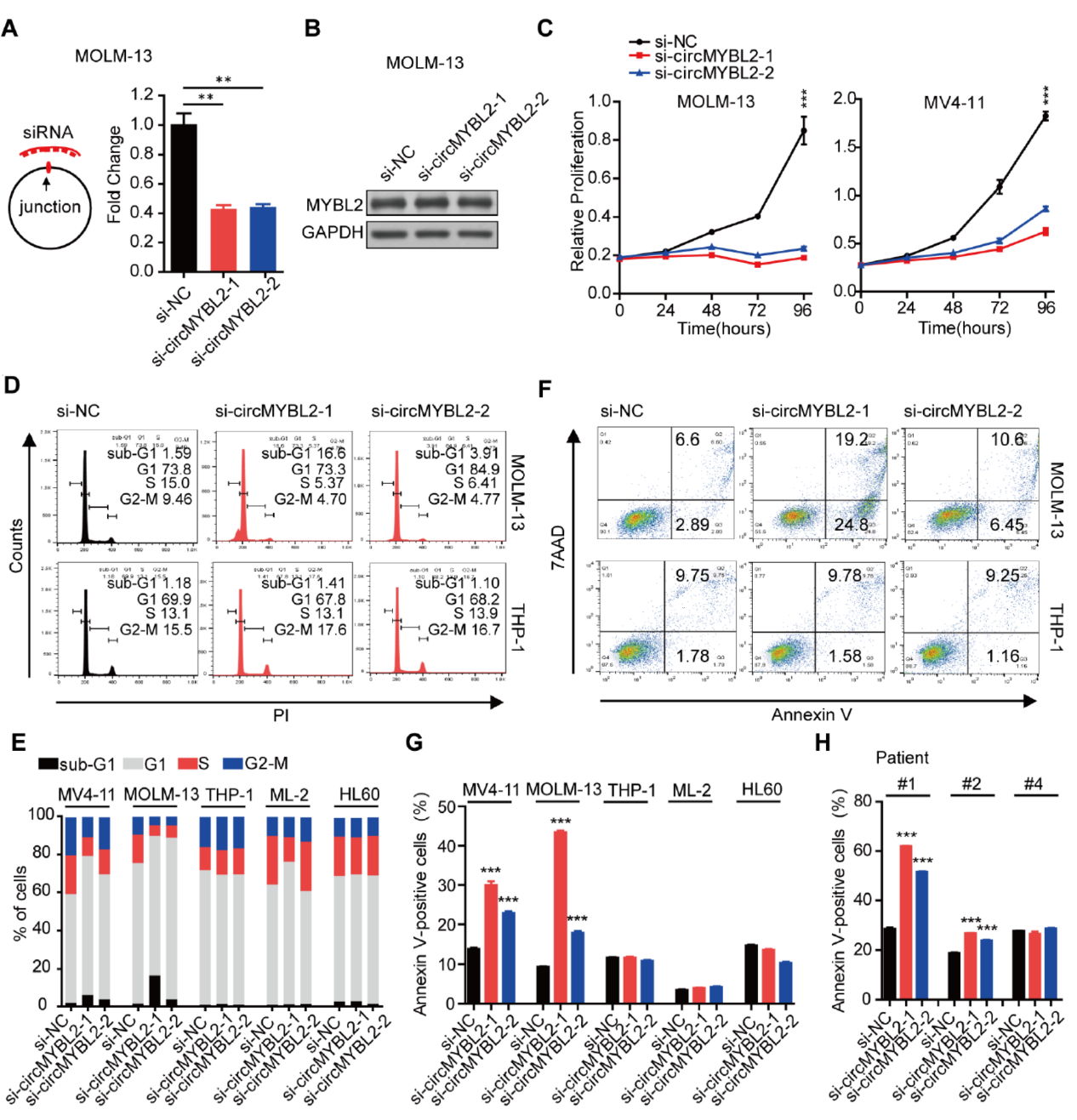
图2 circMYBL2特异性在FLT3-ITD阳性AML中起作用([1])
circMYBL2可特异性的在FLT3-ITD阳性AML细胞中促进增殖,那么在FLT3抑制剂耐药的细胞中该分子有没有可能成为治疗的靶点呢?作者通过诱导构建quizartinib耐药的细胞株(MOLM-13-RQ),然后分析敲降circMYBL2是否有效。结果表明在MOLM-13-RQ中敲降circMYBL2也可以与非耐药的MOLM-13细胞有相似的作用效果,说明敲降circMYBL2可以作为克服quizartinib耐药的治疗手段。
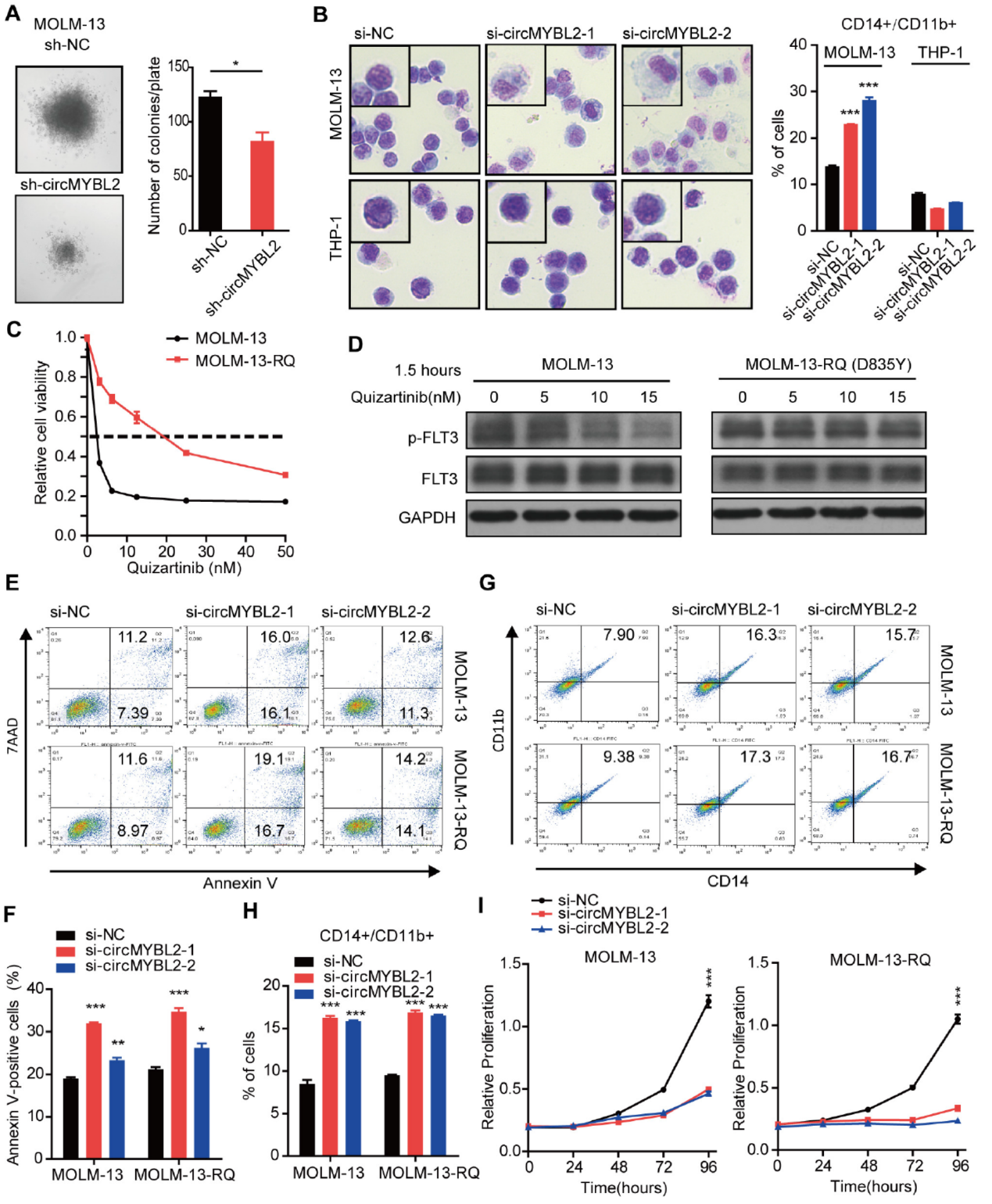
图3 敲降circMYBL2可克服quizartinib耐药 ([1])
circMYBL2调控FLT3的蛋白翻译
为分析circMYBL2是否与FLT3通路有关,作者分析了敲降circMYBL2后FLT3的总蛋白和磷酸化的状态,发现干扰circMYBL2后FLT3的总蛋白量呈现下降趋势,在FLT3-ITD阳性的病人细胞中也有相似的现象。但QPCR结果显示干扰circMYBL2并不影响FLT3的mRNA量,说明circMYBL2可能与FLT3的蛋白总量的调控有关。下游通路中STAT5的磷酸化状态,c-Myc的表达量也会伴随着干扰circMYBL2而下降。在一例FLT3-D835Y突变的病人中,干扰circMYBL2也可以下调FLT3的表达量,但不影响FLT3的mRNA水平。quizartinib耐药的MOLM-13-RQ中也有类似的现象。放线菌酮(CHX)处理后收取不同时间点的总蛋白可以分析蛋白的降解速率,作者发现干扰circMYBL2并不影响FLT3蛋白的半衰期,说明circMYBL2并不是通过影响FLT3蛋白的降解途径调控其蛋白量的。蔗糖密度梯度离心分离核糖体组分的结果表明,干扰circMYBL2后显著降低FLT3的mRNA中结合多个核糖体(polysome)的比例,说明干扰circMYBL2后可影响FLT3的mRNA翻译效率。
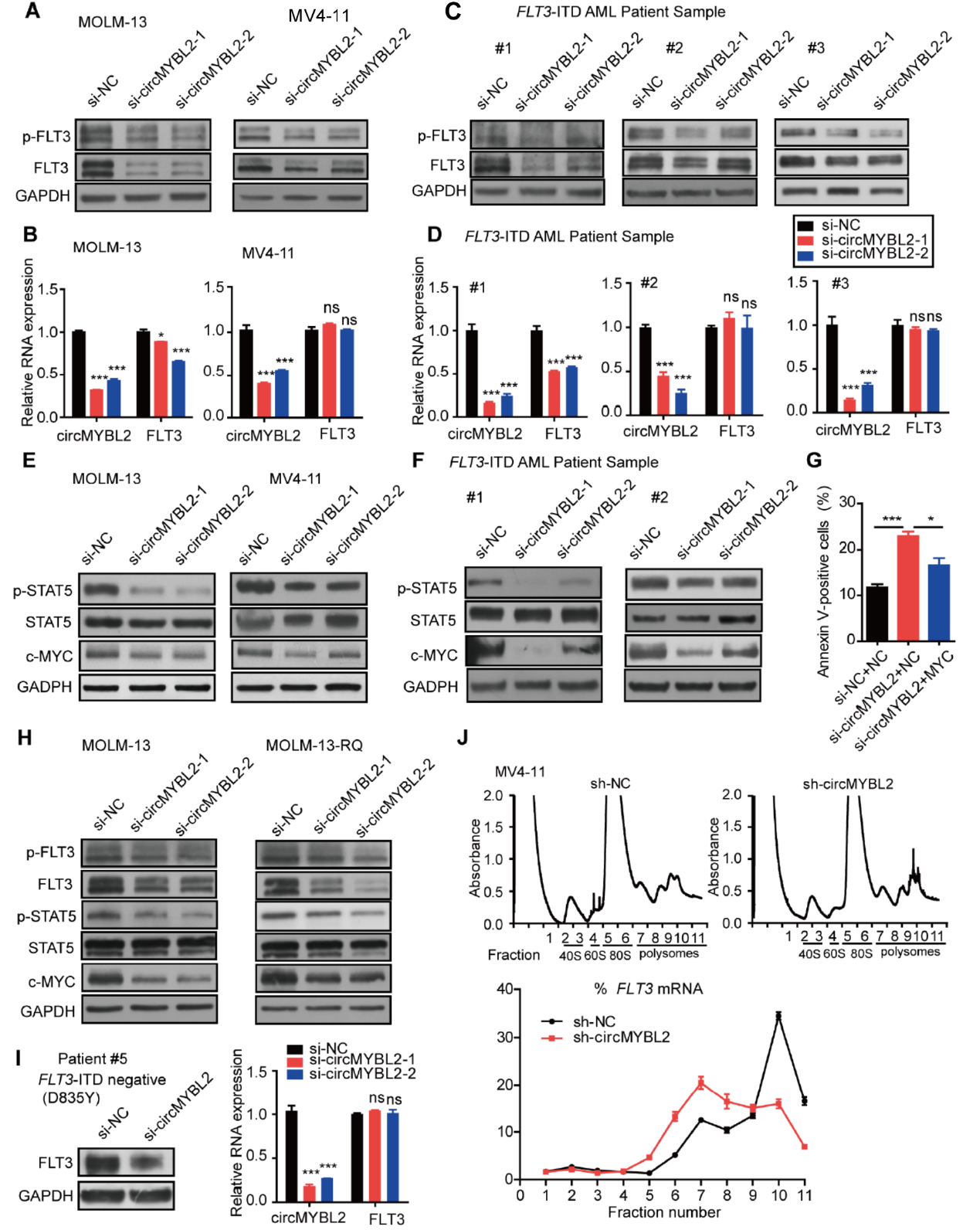
图4 circMYBL2调控FLT3的翻译 ([1])
circMYBL2与PTBP1相互作用
作者首先基于AGO2的CLIP数据分析,没有找到circMYBL2与AGO2相互做的证据,抗AGO2抗体的RIP实验也没有捕获circMYBL2,因此排除了circMYBL2作为miRNA竞争性结合分子的可能。为探索circMYBL2如何调控FLT3的翻译的,作者构建了circMYBL2拉直的过表达载体,在其一端添加了SA apatamer,通过SA Beads拉相互作用的蛋白,然后质谱分析。在这一体系中拉到的相互作用蛋白进行GO通路分析。作者共得到203种相互作用蛋白,其中有13种蛋白与蛋白翻译调控有关。其中PTBP1与circMYBL2的相互作用较强,进一步的WB验证也确认了circMYBL2与PTBP1的相互作用。不同的抗体进行RIP实验,也证明PTBP1是与circMYBL2和MYBL2 mRNA相互作用最强的分子。与干扰circMYBL2相似,干扰PTBP1也可以显著降低FLT3的蛋白水平和STAT5的磷酸化水平。
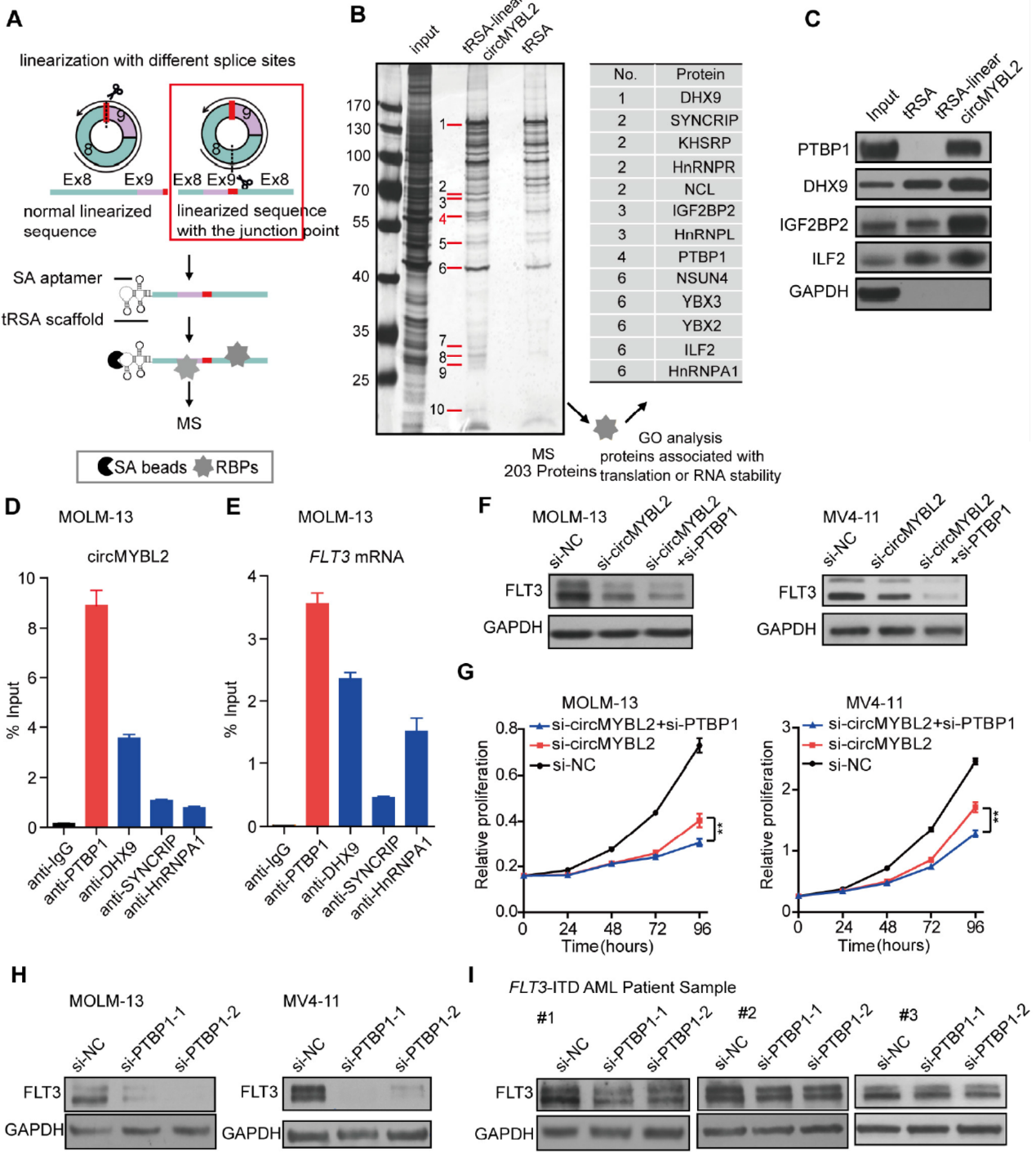
图5 circMYBL2与PTBP1相互作用 ([1])
MV4-11和HL60细胞中过表达circMYBL2或PTBP1均可增加FLT3的蛋白表达水平。MV4-11细胞中干扰PTBP1可降低FLT3结合多个核糖体的比例,说明PTBP1参与FLT3的蛋白翻译调控作用。293T细胞中分别过表达circMYBL2,PTBP1或两者一起共表达均可显著促进FLT3蛋白的丰度。抗PTBP1的抗体可同时捕获circMYBL2和MYBL2 mRNA,过表达circMYBL2可促进PTBP1的抗体捕获MYBL2 mRNA的效率。说明circMYBL2可促进PTBP1与MYBL2 的mRNA的结合效率。
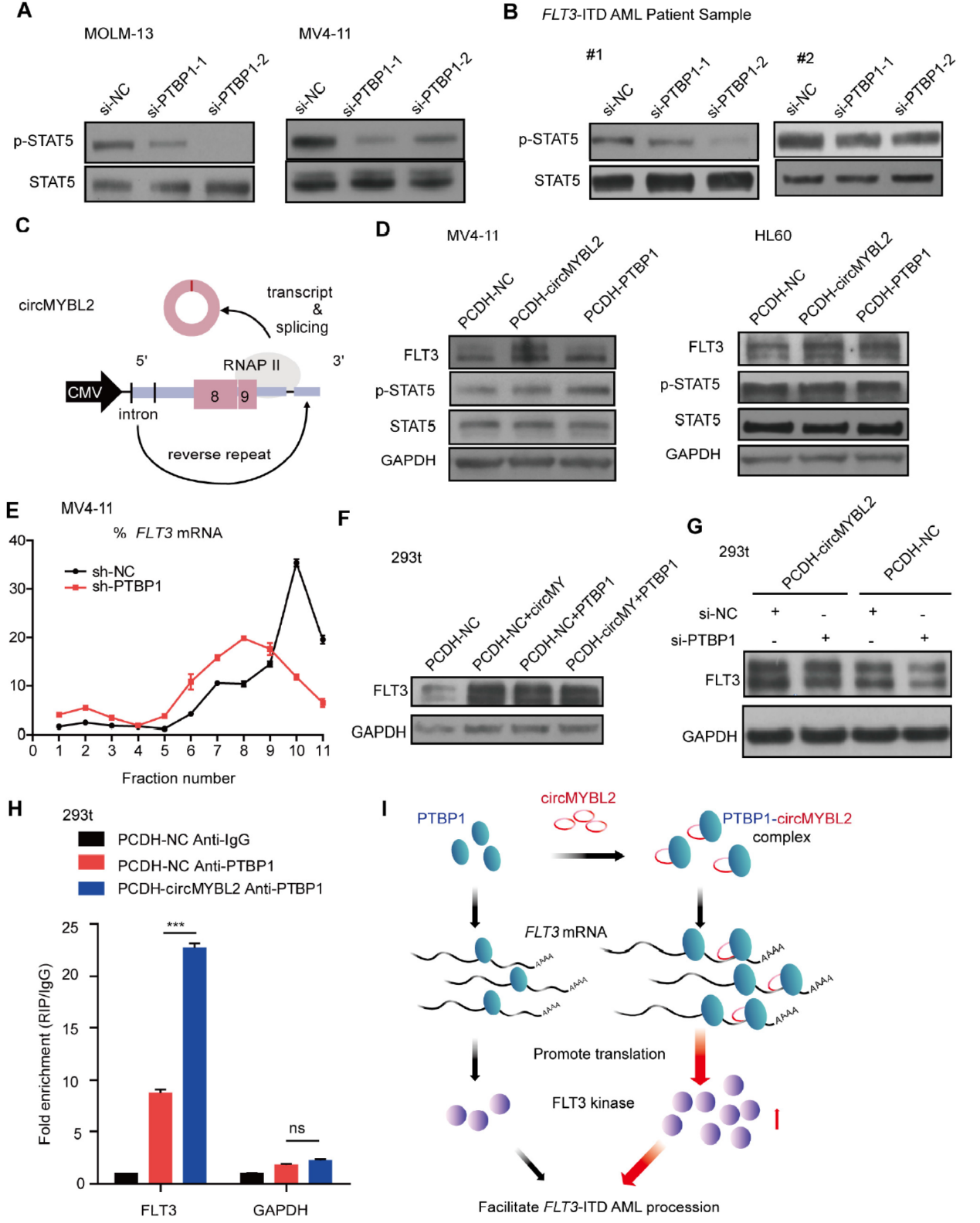
图6 circMYBL2促进PTBP1与MYBL2 mRNA的结合 ([1])
敲降circMYBL2抑制FLT3-ITD AML肿瘤发生和浸润
NOD-SCID小鼠分别通过尾静脉注射不同shRNA载体稳定感染的MOLM-13细胞,包括sh-NC和sh-circMYBL2。三周后分析骨髓和淋巴结转移的情况。sh-circMYBL2组淋巴结中转移的细胞显著低于sh-NC组。组织中,骨髓,脾脏和肝脏中转移的细胞数也远少于sh-NC组。sh-circMYBL2组CD11b和CD14显著增加,说明干扰circMYBL2有助于细胞分化。sh-circMYBL2组生存时间远高于对照组。
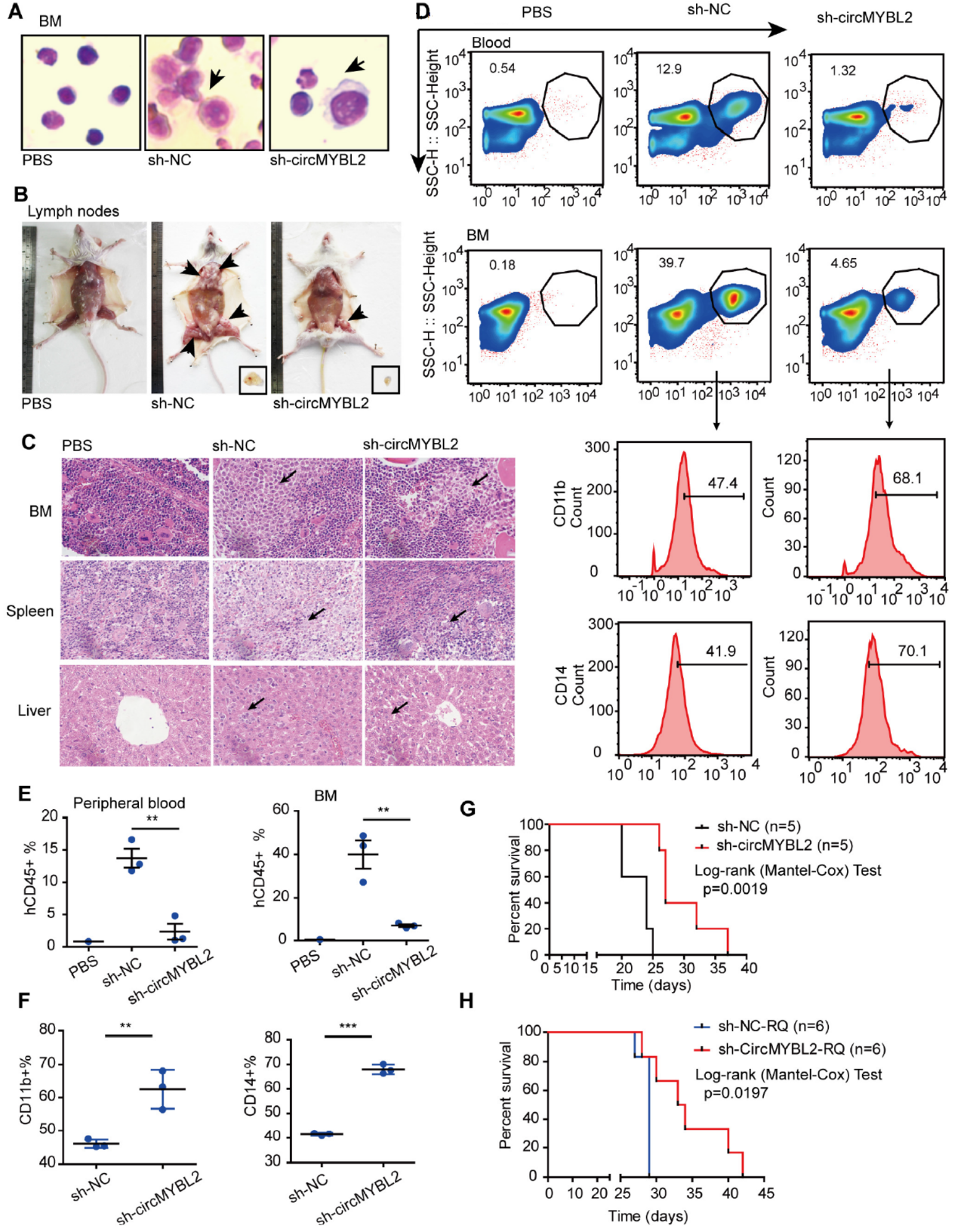
图7 体内实验 ([1])
本文的研究思路总体与其他circRNA的研究比较相似,但作者发现的circMYBL2 可以通过结合PTBP1促进FLT3的蛋白翻译机制对于FLT3-ITD阳性AML的致病机制有新的贡献,尤其是干扰circMYBL2仅显示出在FLT3-ITD 阳性AML中有作用,并且可以克服FLT3抑制剂(quizartinib)耐药性,这个对于FLT3突变尤其是使用quizartinib后二次突变复发的AML患者的治疗有重大意义。本文的工作也再次向我们展示了circRNA在生物医学领域的重要意义和价值,值得各位同仁借鉴。
参考文献:
1. Sun, Y.M., et al., CircMYBL2, a circRNA from MYBL2, Regulates FLT3 Translation by Recruiting PTBP1 to Promote FLT3-ITD AML Progression. Blood, 2019.
.png)