2020年4月28日,南通大学的鞠少卿副教授在Cancer Letters (IF=6.508)杂志上在线发表了一篇题为“Translatable circRNAs and lncRNAs: Driving mechanisms and functions of their translation products”的文章,阐述circRNA和lncRNA翻译起始机制,及其翻译产物在癌症中的功能。最后介绍了这些生物活性蛋白/肽的检测、验证和功能性研究的工具和方法([1])。

lncRNA是长度超过200个核苷酸的非编码RNA。circRNA是lncRNA中的一类,由编码蛋白质的外显子反向剪接产生的单链共价闭合环状RNA。最近,lncRNA和circRNA显示具有开放阅读框(ORF)并可以编码蛋白质/肽。已经在果蝇,小鼠和人成肌细胞以及不同的癌症如神经胶质瘤、肝细胞癌和结肠癌中鉴定出几种可翻译的circRNA和lncRNA。circRNA是通过内部核糖体进位点(IRES)或N6-甲基腺苷(m6A)来启动翻译。在本文中,作者回顾了circRNA和lncRNA翻译的机制和产物功能。此外,介绍可用于识别和验证这些生物活性蛋白/肽在生理和癌症状态下功能的研究方法和工具。
1 翻译起始的机制
1.1 帽子依赖性的翻译起始
RNA根据其编码蛋白质的能力被分为mRNA或ncRNA。mRNA作为模板,核糖体将其直接翻译成相应的蛋白质。帽子依赖性启动是真核生物翻译启动的主要机制。帽子结构由mRNA 5‘端的7-甲基鸟苷(m7G)组成,可被真核细胞翻译起始因子4E(eIF4E)识别。eIF4E与eIF4A和eIF4G相互作用,形成初始复合物eIF4F。随后,eIF4F复合物促进43S前起始复合物(PIC)的募集,PIC由小核糖体亚基(40S)、eIF1、eIF2、eIF3、eIF5和Met-tRNA组成。然后43S PIC连接到mRNA的5‘端,被eIF4F复合物预激活,并开始沿5’到3‘方向扫描。在这个过程中,被eIF5B激活的核糖体大亚基(60S)被招募形成80S起始复合物,该复合物启动了肽的合成。
1.2 IRES依赖的翻译起始
由于缺少5‘端的帽子结构,因此早先认为circRNA不具有编码蛋白质的能力。然而,IRES元件的发现对这一理论提出了质疑。最初,IRES元件是在某些病毒和细胞mRNA内被发现。40S亚基通过直接与IRES元件结合或首先在mRNA的5‘端结合,然后转移到IRES来介导翻译的起始,而不需要事先扫描。通常这些IRES元件需要IRES辅助因子(ITAF)的帮助来在mRNA上招募核糖体并启动翻译。IRES也可以应用于circRNA,体外合成了含有IRES元件的circRNA,环化后得到预测的蛋白产物。然而,没有IRES的circRNA不能直接合成蛋白质。事实证明,在体内含有IRES的circRNA也可以翻译成蛋白质。例如,由于IRES元件,果蝇中circMb1可以有效的翻译蛋白质。此外,Legnini等人发现circ-ZNF609的非翻译区(UTR)可以增强IRES依赖性翻译。这些进一步证明IRES通过招募核糖体来驱动circRNA的翻译,这种翻译不依赖于帽子结构。
下列标准可以确定IRES介导的circRNA翻译:(1)circRNA上有一段未翻译的RNA序列,称为IRES,它可以折叠成类似于起始tRNA的结构,并招募更多的核糖体。(2)正常情况下,IRES不与eIF结合,而是与一类称为ITAF的蛋白质结合。ITAF的作用是将核糖体募集到circRNA的内部结构,以启动蛋白质翻译。(3)可能存在IRES增强子,类似于circ-ZNF609的UTR元件。
有趣的是,当细胞处于压力状况下或帽子依赖性翻译被阻断时,翻译通过IRES元件启动,以对生理和环境应激状况做出反应,如缺氧、热休克或病毒感染。在这些情况下翻译的蛋白质通常对维持细胞在应激条件下的存活至关重要。
1.3 m6A依赖性的翻译起始
除了IRES外,含有m6A位点的短序列也可以启动circRNA的翻译。m6A是真核细胞中含量最丰富的RNA修饰,它是在RNA腺苷的N6位增加一个甲基。Yang等人在探索IRES介导circRNA的翻译中,发现起始密码子周围含有RRACH基序的阴性对照也可以启动翻译,原因是该基序可以被m6A修饰。因此,初步证实了m6A修饰在circRNA翻译中的重要性。通过分析甲基化RNA免疫沉淀测序(MeRIP-seq)数据,研究人员发现内源性circRNA确实包含m6A修饰位点,m6A倾向于出现在circRNA的较大外显子区域,并且更多地集中在外显子区域的上游和中部,显示出细胞特异性。m6A修饰是通过甲基转移酶3(METTL3)和甲基转移酶14(METTL14)参与。RNA免疫沉淀测序(RIP-seq)证实YTHDF1和YTHDF2参与circRNA翻译中m6A的识别。此外,除RIP外,交联免疫沉淀测序(CLIP-seq)和免疫共沉淀分析(CO-IP)还显示YTHDF3与翻译起始因子eIF4G2强烈的相互作用,从而促进翻译。综上所述,这些研究表明,起始转录因子eIF4G2和YTHDF1/2/3参与了m6A诱导的circRNA的翻译,并且这一过程被METTL3/14所增强。
下列标准可以确定m6A介导的circRNA翻译:(1)确认circRNA中存在m6A修饰。首先,可以进行序列分析来验证circRNA中是否存在m6A基序,然后可以使用meRIP-seq来直接筛选出m6A修饰的circRNA。(2)证明circRNA结合核糖体的能力,这可以通过多核糖体分析来实现。(3)确定与circRNA结合的核糖体是否正在翻译,RNA下拉实验可用于验证YTHDF1/2/3或其它翻译启动分子,以预测翻译启动。(4)circRNA翻译的蛋白质产物鉴定,可以使用专门制备的抗体或质谱进行western blotting来分析和鉴定翻译产物。
有报道阐述在热休克条件下,m6A介导的circRNA的翻译增加,这表明circRNA编码蛋白可以在应激反应中发挥作用。但是,在环境压力下m6A驱动的circRNA翻译启动还有待进一步研究。IRES和m6A都是circRNA的潜在翻译驱动因子。这两种机制在细胞应激反应、发育、凋亡和细胞周期调控中发挥重要作用,提示circRNA翻译产物也可能影响这些过程。
1.4 sORF依赖性的翻译起始
lncRNA一般指长度大于200nt的RNA,由于缺乏开放阅读框(ORF>100 aa),被认为是不可翻译的。然而,最近的研究发现,人体内各种短的或小的ORF(sORF或smORF)可以编码多肽。同时,在非编码区也发现了sORF,可以编码参与调节肌肉功能和细胞代谢的小功能肽。2011年,Ingolia等人使用核糖体图谱证明大的基因间非编码RNA(LincRNA)与翻译机制相关,这也已初步证明lincRNA具有编码潜力。2013年,Slavoff 等人通过多肽组学检测到体内大量的小肽,一部分是从lncRNA中衍生出来的,并通过功能实验进行了验证。2014年,Pauli等人发现在斑马鱼胚胎形成的早期阶段,由lncRNA产生的一种幼儿肽起到G蛋白偶联受体激活剂的作用,并促进胚胎的形成。研究人员命名了一种新肽短开放阅读框(DWORF),并表明它可以刺激控制肌肉收缩的钙通道。这一发现为增加肌肉收缩提供了一种途径,并且可能是治疗心脏病的替代方法。因此,这些新发现强调了一些小的生物活性蛋白/肽隐藏在基因组区域中,并由ncRNA编码,这些蛋白质/肽可能具有关键的功能,而不论其大小如何。
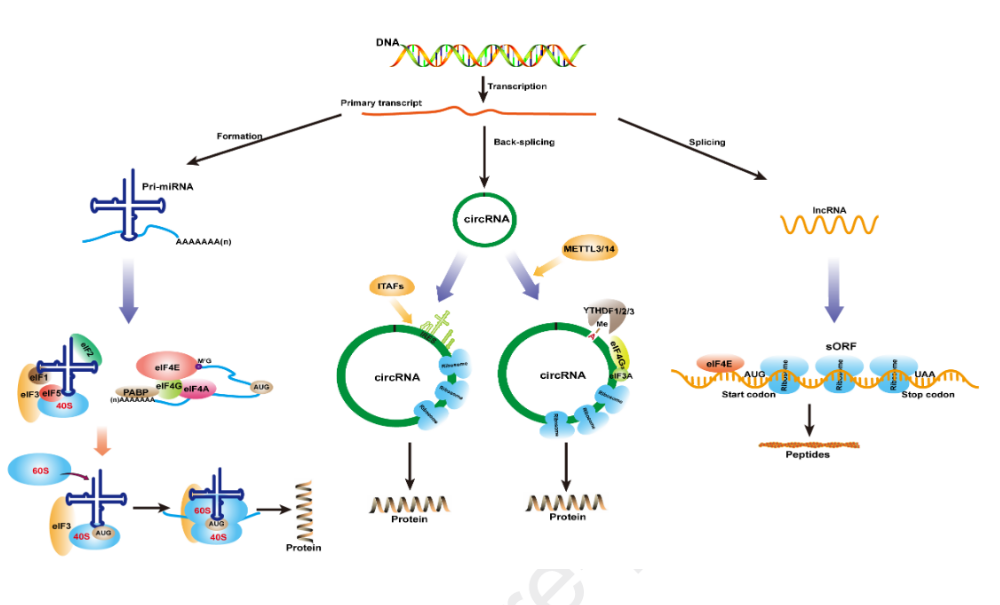
图1 circRNA和lncRNA的翻译机制
2 circRNA和lncRNA翻译的最新进展
2.1 circFBXW7、circSHPRH、circ-LINCPINT和circAKT3在胶质母细胞瘤中的作用
RNA-seq显示circFBXW7在人类神经胶质瘤中被下调,通过CircRNADb数据库分析了circFBXW7中的ORF,并使用双萤光素酶载体系统验证了IRES活性。用特异性抗体对预测的翻译产物进行验证,并通过液相色谱-串联质谱(LC-MS)鉴定其氨基酸序列,证实circFBXW7编码一种称为FBXW7-185aa的新型21 kDa蛋白。FBXW7-185aa与USP28竞争性相互作用并释放FBXW7α去降解c-Myc,从而诱导细胞周期停滞并减少神经胶质瘤细胞的增殖。此外,circ-FBXW7和FBXW7-185aa可以作为胶质母细胞瘤的独立预后指标。
Zhang等人使用RNA-seq与GEO数据库一起鉴定了差异表达的circRNA,之后查询CircBase数据库,然后选择出circSHPRH。与circFBXW7类似,在circSHPRH中预测到ORF,并确认了其IRES的活性。circSHPRH可翻译为含146个氨基酸的蛋白质,称为SHPRH-146aa,芯片分析表明SHPRH-146aa参与中枢神经系统癌症的发展以及蛋白泛素化途径。通过搜索Uniprot数据库,发现SHPRH-146aa内部有两个泛素化位点。有趣的是,SHPRH-146aa可能保护全长SHPRH免受DTL诱导的泛素化作用,从而在体内促进增殖细胞核抗原(PCNA)转化。因此,在临床上,SHPRH-146aa也可能是胶质母细胞瘤的预后标志物。
circ-LINCPINT是由LINC-PIN外显子2环化形成的。免疫荧光法(IF)显示,circ-LINCPINT中的sORF可以编码一个含87个氨基酸的肽,叫做PINT87aa。使用了两个专门靶向circ-LINCPINT环化位点的siRNA,来证明PINT87aa由circ-LINCPINT产生,而不是由LINC-PINT的线性形式产生。在双萤光素酶载体系统中,在sORF上游鉴定出了有活性的IRES。值得注意的是,PINT87aa在神经胶质瘤组织中下调,并与神经胶质瘤的临床预后负相关。此外,PINT87aa抑制神经胶质瘤细胞的增殖,并与聚合酶相关因子(PAF1)复合物结合,从而抑制多个癌基因的转录延伸。
在最近的一项研究中,Zhang的研究小组报道了一种由circAKT3编码的新型含174个氨基酸的蛋白。AKT3-174aa在神经胶质瘤组织中也被下调,并且可以充当肿瘤抑制因子。AKT3-174aa与p-PDK1相互作用,以防止AKT Thr-308磷酸化。 PDK1介导的Thr-308磷酸化激活AKT是激活RTK / PI3K / AKT信号通路的关键步骤。因此得出结论,在胶质母细胞瘤(GBM)的肿瘤产生过程中,AKT3-174aa可以抑制AKT激活诱导的恶性表型。 因此,该肽可能是诊断和治疗胶质母细胞瘤的潜在靶标。
2.2 Circβ-catenin在肝细胞癌中的作用
使用CircRNADb和CircBase数据库,研究人员预测circβ-catenin序列中ORF和IRES的存在。使用双萤光素酶报告系统检测IRES的活性,使用质谱仪(MS)确认了含370个氨基酸的蛋白,命名为β-catenin-370aa。β-catenin-370aa与GSK3β相互作用,并通过拮抗GSK3β诱导的β-catenin磷酸化和降解来稳定全长β-catenin,从而激活Wnt信号通路。
2.3 circPPP1R12A在结肠癌中的作用
研究人员发现具有ORF序列的circPPP1R12A可编码功能蛋白circPPP1R12A-73aa。circPPP1R12A-73aa在体外和体内均能促进结肠癌(CC)的增殖、迁移和侵袭。为了确定可能的信号传导途径,使用了RNA-seq和KEGG途径数据库分析。最后,发现circPPP1R12A-73aa可以通过激活Hippo-YAP信号通路来调节CC的生长和转移。circPPP1R12A是第一个可以在CC中编码小蛋白并可以作为潜在治疗靶点的circRNA。
2.4 LncRNA HOXB-AS3在大肠癌中的作用
GEO数据库的分析表明,在原发性和高度转移性癌细胞中,lncRNA HOXB-AS3的表达降低。核糖体分析显示lncRNA HOXB-AS3与核糖体结合,这表明lncRNA HOXB-AS3可能编码蛋白质或小肽。之后鉴定出lncRNA HOXB-AS3上的 sORF具有编码含53个氨基酸的肽的潜力,然后使用特异性抗HOXB-AS3抗体和MS确认了内源性HOXB-AS3肽的存在。机制上,HOXB-AS3肽通过阻断hnRNP A1依赖性丙酮酸激酶M(PKM)剪接、miR-18a加工和有氧糖酵解作用来抑制肿瘤发生。在大肠癌(CRC)患者中,HOXB-AS3肽表达量低表现出更高的侵袭性病理特征和较差的预后,提示HOXB-AS3肽可能作为CRC的诊断指标。
参考文献
[1] S. Kong, M. Tao, X. Shen, S. Ju, Translatable circRNAs and lncRNAs:Driving mechanisms and functions of their translation products, Cancer Letters, https://doi.org/10.1016/j.canlet.2020.04.006
.png)