随着DNA甲基化的研究深入,RNA甲基化也成为了当前表观遗传修饰的热点话题,其中circRNA的甲基化研究也慢慢走进人们的视野。2017年,Cell Research首次发表了circRNA存在m6A修饰,且该修饰能够促进circRNA的翻译[2],随后又有研究者发现circRNA广泛存在m6A修饰[3];近期研究者发现m6A能够介导mRNA和circRNA降解,也增加了人们对circRNA降解机制的认知[4]。
铺垫了这么多,大家也该猜到小编今天带来的同样为circRNA的m6A修饰研究成果啦,这项由浙江大学医学院附属邵逸夫医院带来的研究发表在预印本杂志BioRxiv上[1]。下面就一起来看看这篇文章吧~

缺氧性肺动脉高压(HPH)是一种致命性疾病,却一直缺乏有效的治疗方法。circRNA具有在特定细胞或组织差异富集和不易降解的特性,可作为生物标记物在疾病诊断中发挥作用。而RNA普遍的m6A修饰与疾病发生密切相关,那么HPH中circRNA的m6A修饰又会发生什么样的变化呢?
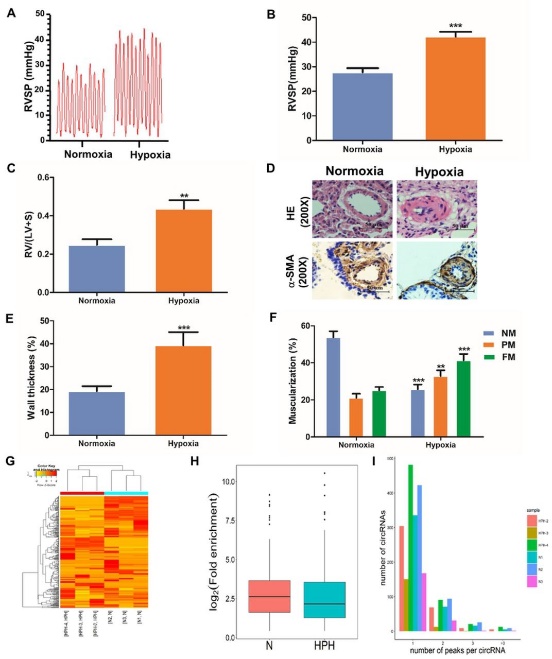
图1 HPH大鼠中circRNA的m6A水平及m6A富集峰数量[1]
为了探究HPH中circRNA的m6A修饰,作者构建缺氧诱导的肺动脉高压(HPH)大鼠模型,验证了HPH大鼠(hypoxia)相对于正常大鼠(normoxia)的病理表型。以大鼠的肺组织为样本,通过MeRIP技术鉴定了circRNA的m6A修饰。发现与正常组相比,HPH组中有166个circRNA的m6A水平显著上调,191个circRNA的m6A水平显著下调,HPH组总体circRNAs的m6A水平也是低于正常组的。同时,作者发现在正常组和HPH组中均有超过50%的circRNA只有一个m6A区(富集峰)。
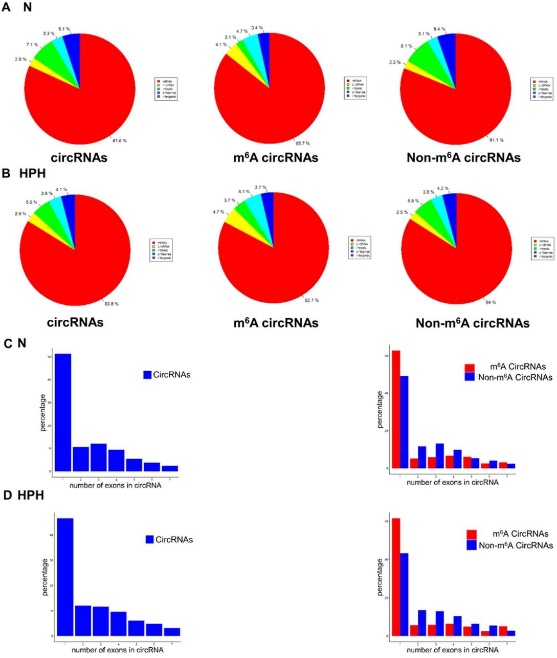
图2 m6A-circRNAs的基因来源[1]
m6A修饰的circRNA又来源于哪种类型的基因呢?作者分析发现,正常组和HPH组中约有80%的总circRNAs、m6A-circRNAs和non-m6A circRNAs来源于编码基因,且与总circRNAs及non-m6A circRNAs相似,两组中m6A-circRNAs均主要来源于编码基因的单个外显子。
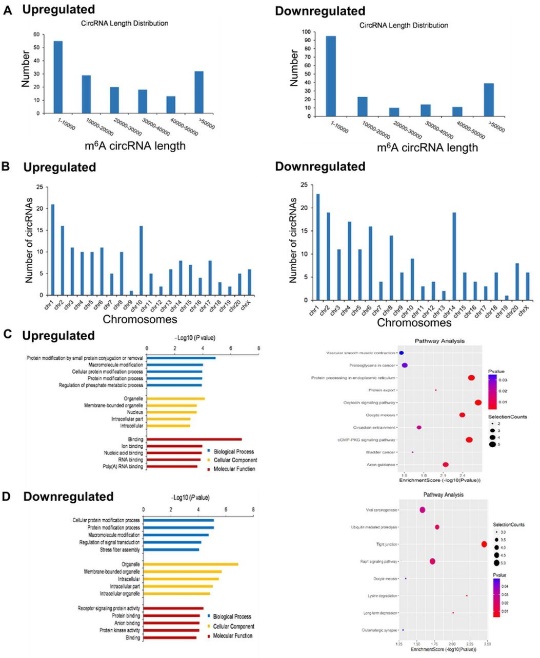
图3 m6A差异表达的circRNA源基因的分布和功能分析[1]
而其中m6A差异表达的circRNA源基因又是如何分布、与哪些生物学功能和信号通路相关呢?作者分析发现差异m6A-circRNAs源基因长度为1-10000 bps,其中表达上调的m6A-circRNAs源基因大多位于染色体1、2、10中,表达下调的大多位于染色体1、2、14中。同时通过GO分析和KEGG分析鉴定差异m6A-circRNAs源基因可能涉及的相关生物学功能和信号通路。
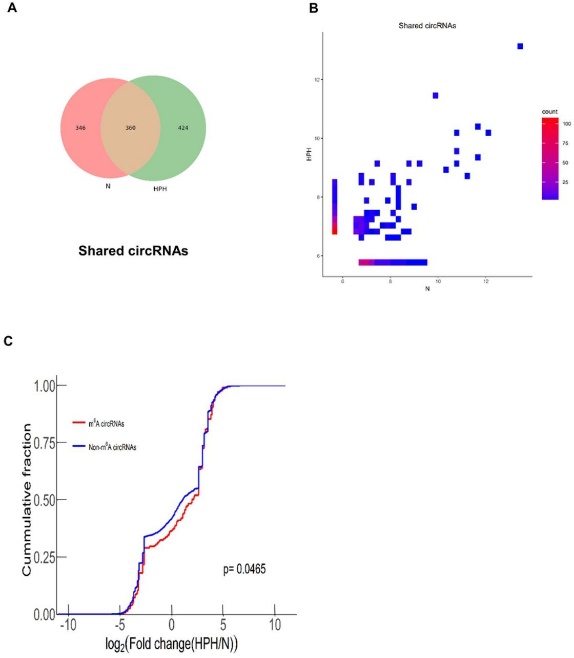
图4 缺氧对m6A水平和circRNA表达的影响[1]
缺氧是否同时影响m6A水平和circRNA表达呢?作者分析发现,正常组和HPH组都具有特异的m6A-circRNA,说明circRNA的m6A水平受缺氧影响。而为了分析m6A修饰是否参与circRNA稳定性的调控,作者筛选出N和HPH组共有的360种m6A-circRNA,发现这些circRNA在HPH组更倾向于低表达状态,说明HPH组中低氧条件可能促进了m6A修饰介导circRNA的降解。
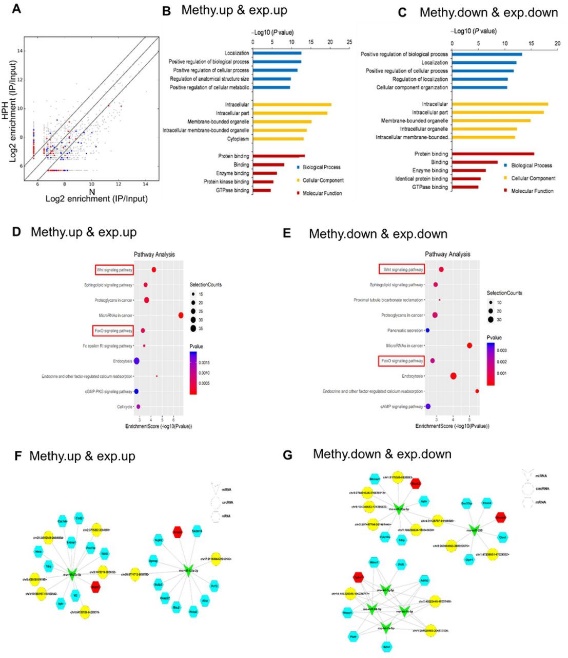
图5 circRNA-miRNA-mRNA 共表达网络(HPH)[1]
发现circRNA的表达及其m6A水平均受缺氧影响后,作者进一步分析了m6A水平与circRNA及其吸附的miRNA、靶基因mRNA表达的关联性,作者筛选出了HPH模式中76个m6A水平增加的表达上调circRNAs,以及76个m6A水平减少的表达下调circRNAs,进行GO分析和KEGG分析,构建circRNA–miRNA–mRNA共表达网络,鉴定mRNA相关生物学功能和信号通路,并通过关联已知肺动脉高压(PH)相关的关键mRNA和miRNA,筛选出了circXpo6和circTmtc3。
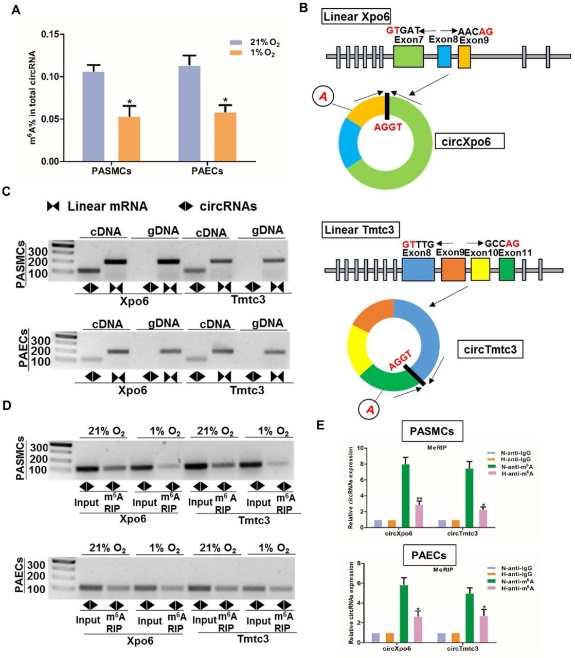
图6 缺氧条件下PASMC和PAEC中m6A-circXpo6和m6A-circTmtc3表达谱[1]
为了验证HPH模式中m6A-circXpo6和m6A-circTmtc3表达的变化,作者将HPH标志细胞——肺动脉平滑肌细胞(PASMC)和肺动脉内皮细胞(PAEC)分别进行正常供氧和缺氧处理,发现缺氧处理后细胞中circRNA的m6A水平显著降低,并在PASMC和PAEC细胞中鉴定了circXpo6和circTmtc3。作者也通过MeRIP-RT-PCR和MeRIP-qRT-PCR进一步鉴定了circXpo6和circTmtc3存在m6A修饰,同时发现在缺氧处理时,细胞中m6A-circXpo6和m6A-circTmtc3的表达是显著降低的。而HPH模式中下调的m6A-circXpo6和m6A-circTmtc3,也为m6A-circRNA作为潜在的诊断标志物和治疗靶标提供了一定的科研依据。
参考文献
- Hua S., et al., Transcriptome-wide map of m6A circRNAs identified in hypoxic pulmonary hypertension rat model. BioRxiv, 2019
- Yang, Y., et al., Extensive translation of circular RNAs driven by N6-methyladenosine. Cell Res, 2017.
- Zhou, C., et al., Genome-Wide Maps of m6A circRNAs Identify Widespread and Cell-Type-Specific Methylation Patterns that Are Distinct from mRNAs. Cell Rep, 2017. 20(9): p. 2262-2276.
- Park, O.H., et al., Endoribonucleolytic Cleavage of m(6)A-Containing RNAs by RNase P/MRP Complex. Mol Cell, 2019
.png)