Shenjian
标题:Upregulation of LAGE3 Correlates With Prognosis and Immune Infiltrates in Colorectal Cancer: A Bioinformatic Analysis
杂志:Int Immunopharmacol;
影响因子:3.361
Highlights
- 首次报道LAGE3在结直肠癌患者中过表达(与相应的正常组织相比)。
- LAGE3在结直肠癌中的表达上调是独立的预后生物标志物,并与不良预后相关。
- LAGE3与大肠癌微环境中的免疫细胞浸润水平和肿瘤免疫相关的特征基因相关。
摘要
背景:结直肠癌(CRC)是全球范围内与癌症相关的死亡的主要原因。鉴定新的CRC生物标志物对于改善针对该疾病的治疗方法的预后和发展势在必行。尽管尚未完全阐明LAGE3(L抗原家族成员3)在CRC中的潜在作用,但LAGE3可作为tRNA修饰因子发挥作用。
方法:从The Cancer Genome Atlas(TCGA)和Gene Expression Omnibus(GEO)数据库下载RNA-seq矩阵和相应的临床信息,然后使用在R语言程序包进行生存,富集和肿瘤微环境分析。
结果:我们发现LAGE3在多个CRC队列中被上调并且与不良预后显著相关。此外,多因素Cox回归分析显示LAGE3是CRC患者的独立预后因素,而功能富集分析表明LAGE3可以调节蛋白靶向tRNA加工和PD-1 / PD-L1检查点途径。此外,CIBERSORT分析表明LAGE3与多种免疫细胞(尤其是CRC中的CD8 + T细胞)浸润水平之间呈负相关。特别地,LAGE3的表达与免疫检查点以及各种免疫细胞类型的特征基因的表达呈负相关。
结论:
总体而言,我们的结果表明,LAGE3高表达与CRC患者的不良预后和不良的免疫浸润相关。
前言
免疫疗法目前被认为是结直肠癌的最新治疗方法,尤其是微卫星不稳定性高的(MSI-H)表型。 MSI-H大肠癌具有大量的突变,可产生新的抗原,从而触发免疫渗透并改变免疫检查点抑制剂。程序性死亡配体1(PD-L1)和细胞毒性T淋巴细胞相关抗原4(CTLA-4)是当前临床试验中目前免疫治疗的主要目标,并且已显示出对癌症的功效,例如非小细胞肺癌(NSCLC)和恶性黑色素瘤。肿瘤微环境(TME)的主要成分是肿瘤细胞,间质和渗透性免疫细胞。迄今为止,几项研究表明,肿瘤浸润免疫细胞(TIIC),特别是细胞毒性T淋巴细胞(CD8 + T细胞)可影响预后,免疫治疗反应率和化疗效果。例如,发现CD8阳性的肿瘤浸润淋巴细胞可独立预测结直肠癌患者的高PD-L1状态。但是,使用单克隆抗体(mAb)(例如抗CTLA-4 mAb)的临床免疫疗法试验显示,晚期结直肠癌的临床疗效不理想,在转移性结直肠癌中,抗PD-1和抗PD-L1 mAb的治疗率有限。因此,有必要探索具有预后价值的新型生物标志物,并为大肠癌患者确定基于免疫的治疗靶标。
LAGE3是一种14804-Da的细胞内蛋白,在人类的许多器官和细胞类型中普遍表达。Goswami等研究表明,敲除LAGE3可以显著降低H358 NSCLC细胞中的细胞增殖,而与TP53状态无关。L抗原家族中LAGE1蛋白是肿瘤特异性CD4 + Treg细胞的配体,该CD4 + Treg细胞是由黑色素瘤癌症患者的TIL产生的。据报道,LAGE1刺激黑色素瘤TME中CD4 + Treg细胞的增殖,从而诱导免疫耐受。据我们所知,LAGE3在免疫渗透中的作用及其在癌症中的预后价值尚未阐明。本研究是首次分析LAGE3的表达谱,并描述其在CRC患者中的潜在预后价值,生物学作用以及与肿瘤免疫浸润的关系。综上所述,我们的分析表明,LAGE3的高表达与CRC患者的不良预后有关,而功能富集分析则揭示了与LAGE3相关的几种癌性和免疫相关途径。此外,我们发现LAGE3与TIIC的渗透水平,尤其是CD8 + T细胞之间存在负相关。 LAGE3表达与肿瘤免疫相关签名基因的表达呈负相关。这项生信分析研究表明,LAGE3可能是CRC的预测生物标志物和潜在治疗靶标。
结果:
1、LAGE3在结肠癌患者中的表达水平
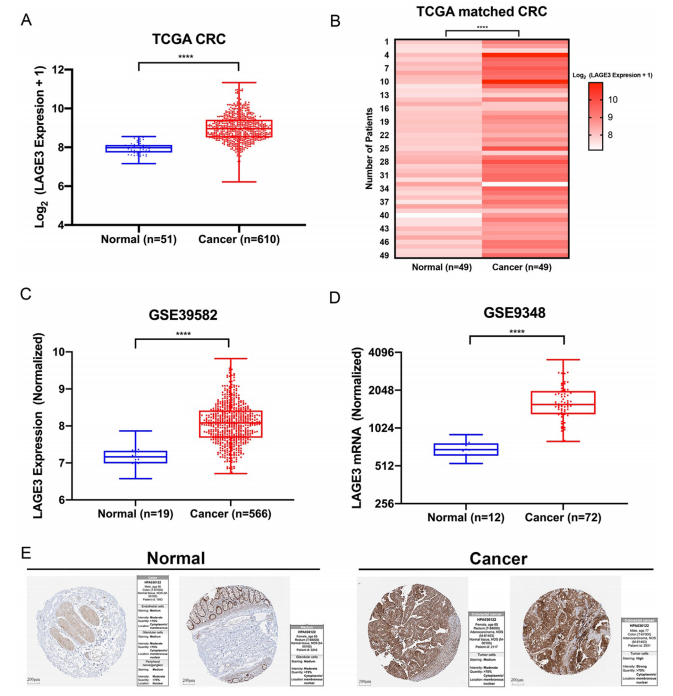
图1:LAGE3在TCGA和GEO的CRC数据集的癌组织中表达水平均上调,THPA中的免疫组化结果也显示LAGE3蛋白水平在癌症中高表达。
LAGE3的临床预后价值

图2. LAGE3在CRC患者中的预后价值。 (A-D)TCGA CRC队列中的OS,DSS,DFI,PFI。 (E,F)GSE39582队列中的OS和RFS。 OS,整体生存率; DSS,无病生存; DFI,无病间隔; PFI,无进展间隔; RFS,无复发生存。
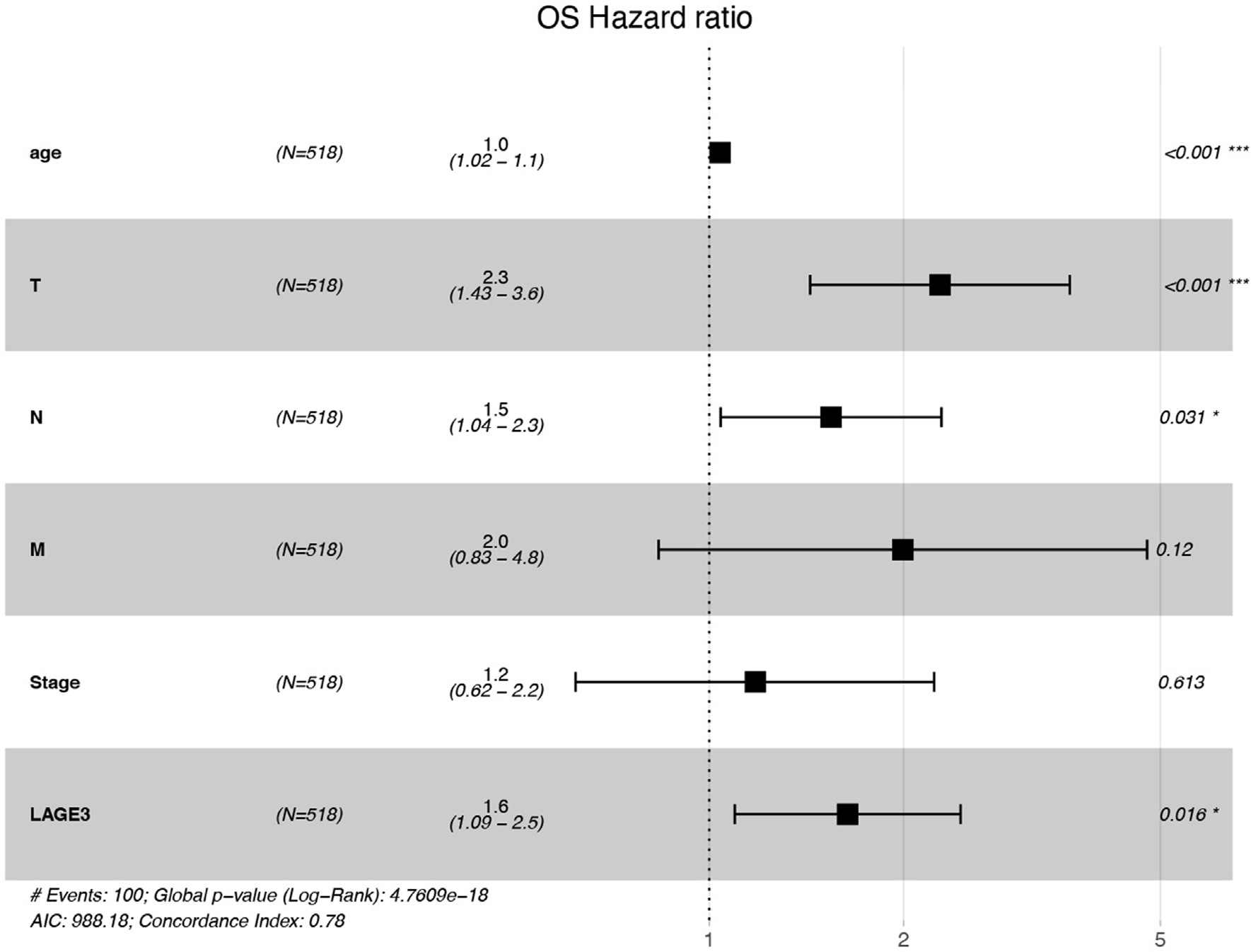
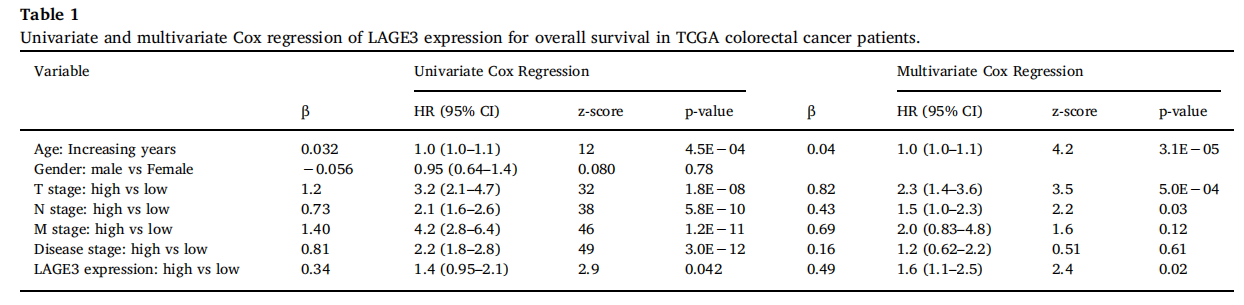
图3. LAGE3表达对CRC患者总体生存的多因素Cox回归分析。
LAGE3在CRC中的功能预测
在特定的生物学状态下共表达的基因更可能是潜在功能和信号途径的驱动力。基于此,我们在TCGA大肠癌队列中筛选了与LAGE3具有强共表达相关性(Spearman相关值> 0.3或<-0.3,p <0.001)的基因用于功能富集分析(图4A)。另外,我们对共表达的基因进行了GO和KEGG途径富集分析。

图4. LAGE3共表达的基因和功能富集分析。 (A)与LAGE3共同表达的CRC热图。 显示前30个正相关和30个负相关的基因。 (B)通过与LAGE3共表达的基因进行GO富集分析(每个亚型的前10个条目)。 (C)通过与LAGE3共表达的基因进行KEGG富集分析(前10个条目)。
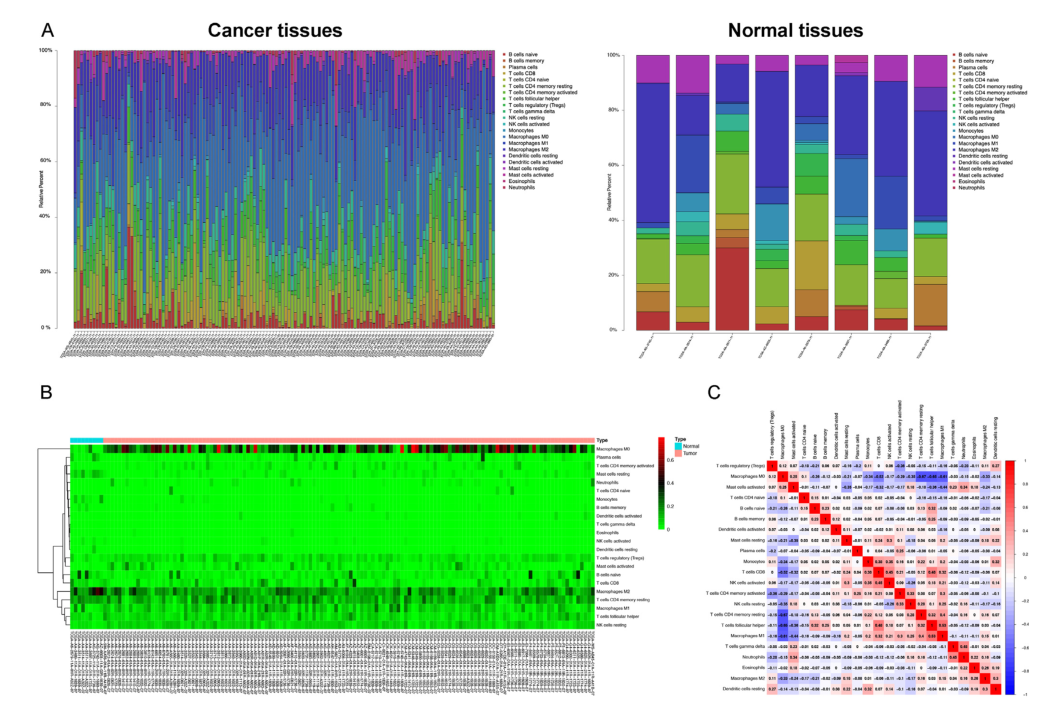
CRC的肿瘤微环境分析

图5. CIBERSORT估计大肠癌微环境中TIICs成分值。 (A)堆积条形图,表示CRC和正常样品中TIIC的成分。 (B)不同TIIC比例的热图。 (C)CRC中不同TIIC比例的相关矩阵。 TIIC,可渗透肿瘤的免疫细胞。
CRC中LAGE3表达与TIIC之间的关系

图6. LAGE3可能影响CRC患者的T细胞衰竭标志物和免疫渗透水平。 (A)小提琴图显示了高LAGE3和低LAGE3样品之间的CIBERSORT TIICs分数差异。 (B)散点图显示了经纯度校正的Spearman的rho值和LAGE3与TIICs水平之间的相关性的p值。 (C)LAGE3与PD-L1(CD274),CTLA-4,TIGIT和TIM-3(HAVCR2)成反比。 TIICs,肿瘤浸润免疫细胞。
讨论
尽管多年来大量研究增进我们对大肠癌的生物学,外科治疗和免疫疗法的理解,但晚期大肠癌患者的预后仍然很差。因此,有必要鉴定免疫相关的生物标志物,阐明CRC的潜在分子机制,以改善患者的预后并指导有效干预措施的发展。在当前的研究中,我们集中于LAGE3,这是通用的tRNA修饰EKC / KEOPS复合物的成员。鉴于我们对LAGE3在癌症中的作用的了解有限,我们旨在通过对开放存取数据库进行全面分析来剖析其在CRC中的生物学功能,并揭示其相关的调控途径。对来自不同国家和不同种族背景的1000多例CRC临床患者的转录组进行分析后,发现CRC中LAGE3的表达高于正常结直肠组织。
此外,在不同的人群中,LAGE3的高表达与不良的生存和无病状态显著相关。多因素cox分析表明,LAGE3的表达水平是CRC患者生存的独立决定因素。因此,我们的结果表明,LAGE3在许多CRC病例中均上调,表明其作为诊断和预后标志物的潜力,尽管这需要进一步的临床验证。
共表达的基因在严格的调节控制下在生物过程中协同作用,因此在适应性进化中具有优势。为了阐明LAGE3的生物学作用,我们进行了共表达和功能富集分析。首先,我们确定了一些与LAGE3先前研究相对应的功能性术语,特别是tRNA加工和蛋白质靶向。其次,功能富集分析表明LAGE3与多种神经退行性疾病相关,包括阿尔茨海默氏病,帕金森氏病和亨廷顿氏病,而GAMOS与之不相关。第三,经过富集分析,我们发现了各种与癌症相关的术语,例如mTOR,sphingolipid,ErbB和Notch信号通路,以及结直肠癌。有趣的是,还鉴定了涉及各种免疫相关过程的众多基因。这些包括对肌动蛋白细胞骨架的调节(在各种免疫细胞反应中起关键作用),氧化磷酸化和thermogenesis(为免疫系统和免疫反应提供必要的能量支持)以及PD-1 / PD-L1信号传导途径的阻断,这表明了部分临床不同癌症患者的反应。这些结果表明,LAGE3在多种疾病中可能具有复杂的调节作用。
先前的研究表明,肿瘤部位的免疫浸润水平影响预后以及化学疗法和免疫疗法的反应率。传统上,CD8 +细胞毒性T细胞被认为是主要的抗肿瘤免疫效应细胞。例如,在多种癌症中,较高水平的CD8 + T细胞渗透与良好的预后相关。在当前的研究中,我们采用CIBERSORT来探索TME,并基于从TCGA获得的CRC定量了22种TIICs免疫反应子集。我们的结果表明,LAGE3表达与幼稚B,CD8 + T和CRC中静息肥大细胞的渗透水平之间存在显著的负相关。但是,我们发现激活的肥大细胞的渗透水平与LAGE3表达之间呈正相关。此外,使用TIMER验证结果表明LAGE3表达与CRC中原代免疫细胞的渗透状态呈负相关。在免疫细胞类型中,LAGE3与CD8 + T细胞具有最强和最一致的相关性。阻断LAGE3可能会增加TME的T细胞免疫功能和功能,从而改善CRC患者的疾病结局。
我们的结果还揭示了CRC中LAGE3与免疫细胞表达和免疫检查点标记之间的相关性。先前的研究表明,PD-L1 / 2与PD-1直接相互作用以抑制肿瘤细胞凋亡并负面影响周围的T效应细胞。另一方面,CTLA-4被广泛认为是由APC触发以激活CD4 +和CD8 + T细胞的一种生理“刹车” ,而TIM-3具有正负调节功能,可以使用作为免疫反应的不同元素。在临床前研究中发现,抗CTLA4和TIM-3阻滞剂的组合可导致肿瘤缩小。在当前研究中,包括PD-L1 / 2,CTLA-4和TIM-3在内的大多数免疫检查点与CRC中LAGE3的表达呈负相关。此外,LAGE3的高表达与其标志物(包括TBX21,STAT1,STAT3,STAT4和BCL6)成反比。
这些相关性表明LAGE3调控CRC中T细胞功能的潜在机制。此外,我们观察到LAGE3与单核细胞,M1/M2巨噬细胞,NK细胞和树突状细胞之间的显著相关性,表明LAGE3可能调节CRC微环境中的免疫渗透。因此,LAGE3表达在CRC中具有预后价值。这项研究有一些局限性。首先,我们的分析仅针对少数TCGA和GEO队列,因此我们的结果应得到验证以更大的样本量。其次,基于RNA序列的算法分析可能不够精确。这需要使用体内模型进行进一步的实验,以探索LAGE3的潜在生物学机制以及CRC中的肿瘤免疫相互作用。总而言之,我们的研究发现LAGE3具有预后价值,并且会影响CRC中的肿瘤免疫状态,CRC中LAGE3高表达与较低的免疫渗透水平和免疫检查点表达相关,因此预后较差。
.png)