Shenjian

肺癌主要包括小细胞和非小细胞肺癌两种类型,是第二大最常见的癌症,并且是迄今为止世界范围内与癌症相关的死亡的主要原因。由于在局部晚期或广泛转移阶段被诊断出的肺癌患者比例很高,因此大多数患者在诊断时的预后仍然很差。早期诊断出并经手术和放疗治疗的肺癌患者预后较好。然而,使用当前的诊断方法,例如CT检查和正电子发射计算机断层扫描(PET),仍然有大约40%的肺癌患者被诊断为远处转移。因此,鉴定有效的生物标志物以进行早期诊断和预后对于降低肺癌患者的死亡率很重要。
越来越多的证据表明,癌细胞与肿瘤微环境(特别是免疫微环境)之间的相互作用也被认为是关键因素,并被证明参与肿瘤的进展和治疗。近年来,T细胞检查点抑制剂已大大改善了对多种癌症的治疗功效。程序性细胞死亡受体1(PD-1)及其配体(PD-L1)的抑制剂已在包括非小细胞肺癌(NSCLC)在内的多种癌症中显示出有希望的抗肿瘤作用。此外,越来越多的证据表明,浸润肿瘤的免疫细胞会影响化疗和免疫疗法的预后和疗效。因此,阐明肿瘤-免疫相互作用的免疫表型并鉴定肺癌中新的与免疫相关的治疗靶标特别重要。
C型凝集素结构域家族3成员B(CLEC3B)编码结合纤溶酶原kringle-4的四连蛋白,定位在细胞血浆,细胞外基质和外泌体中。该四联蛋白通过诱导纤溶酶原激活而在细胞外蛋白水解中起作用,这与肿瘤的侵袭和转移有关。此外,CLEC3B已在多种癌症中被报道,包括肝细胞癌,卵巢癌和口腔鳞状细胞癌,但仍需要大量深入研究来阐明CLEC3B在癌症进展中的分子机制和特定功能。到目前为止,关于CLEC3B的研究非常有限。Dai W.等报道,肝细胞癌外泌体中CLEC3B的下调通过AMP激活的蛋白激酶和血管内皮生长因子信号途径促进转移和血管生成。Liu J等报道,CLEC3B在透明细胞肾细胞癌中具有由促分裂原活化的蛋白激酶途径介导的抗增殖功能。据我们所知,尚未报道CLEC3B与肿瘤免疫及其在肺癌中的功能之间的关系。我们假设CLEC3B可以作为肺癌的潜在诊断和预后生物标志物以及新型的免疫相关治疗靶标。在这项研究中,我们使用可公开获得的癌症数据集评估CLEC3B表达的预后和预测作用,并确定其与免疫微环境表型的相关性。
CLEC3B在肺癌中下调并与临床病理特征密切相关:
为了检查CLEC3B在肺癌中的表达,我们从GEO和TCGA数据库评估了癌症和正常组织的公开数据。结果显示,GSE30219数据集中与非癌性肺组织相比,CLEC3B在几种组织学亚型中显著下调(p <0.001),包括ADC,SCC,大细胞癌(LCC),大细胞神经内分泌肿瘤(LCNE)和小细胞肺癌(SCLC)。(图1a)。此外,CLEC3B在GSE19188的ADC,SCC,LCC(图S1a)和17个Oncomine分析中均被下调。一致地,在来自TCGA的RNA-seq数据中对CLEC3B基因表达的比较表明,ADC和SCC中CLEC3B的表达均下调(图1b,c)。TCGA中来自ADC和SCC患者的癌及相匹配的相邻非肿瘤组织的数据进一步证实了这些结果(图1d,e)。为了进一步验证这些结果,购买了肺癌临床样品的cDNA芯片,并进行了实时定量PCR评估CLEC3B mRNA的表达。不出所料,与匹配的相邻非肿瘤组织相比,肺癌组织中CLEC3B显著下调(图1f,g),ADC和SCC样品中CLEC3B的表达均下调(图1h,i)。
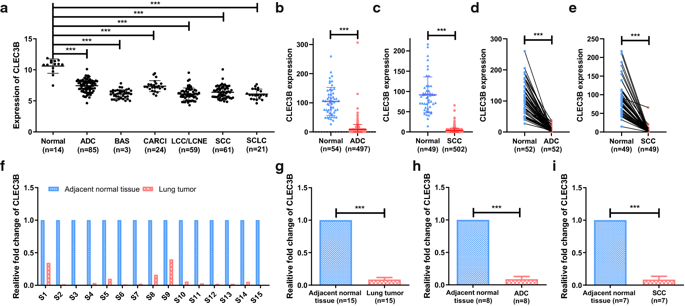
Fig1:在肺癌中CLEC3B的表达下调。GSE30219中正常肺组织和肺癌的不同组织学亚型中的CLEC3B表达。b,c在TCGA数据集中,CLEC3B在正常肺vs ADC和SCC中的表达。d,e TCGA数据集中成对的ADC和SCC样本中CLEC3B的表达水平。f–i通过实时定量PCR分析15对配对的肺癌样本中CLEC3B的表达。ADC,腺癌;BAS,basaloid;CARCI,类癌;LCC,大细胞癌;LCNE,大细胞神经内分泌肿瘤;SCC,鳞状细胞癌;SCLC,小细胞肺癌。*** p <0.001
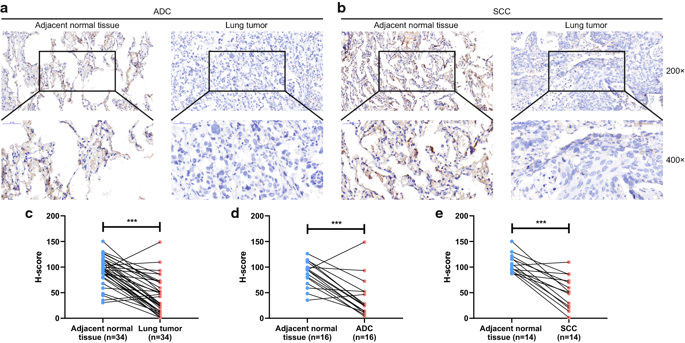
Fig2:肺癌和正常组织中CLEC3B的免疫组化检测。a,b ADC和SCC患者的免疫组化染色的代表性图像(放大倍数,×200,×400)(图像A的H-score评分为3.916和78.929;图像B的H-score评分为20.068和106.444)。c–e肺癌样本的临床肿瘤和癌旁组织的H-score评分。ADC,腺癌;SCC,鳞状细胞癌;H-score,免疫组化评分。*** p <0.001
此外,使用组织微阵列通过IHC染色对CLEC3B的蛋白质表达进行了研究,这也表明CLEC3B在肿瘤组织中的表达低于癌旁组织(图2a,b)。H分数的配对t检验显示,肺癌中CLEC3B的下调是显著的(P <0.001)(图2c)。ADC和SCC H分数的差异也很显著(图2d,e)。
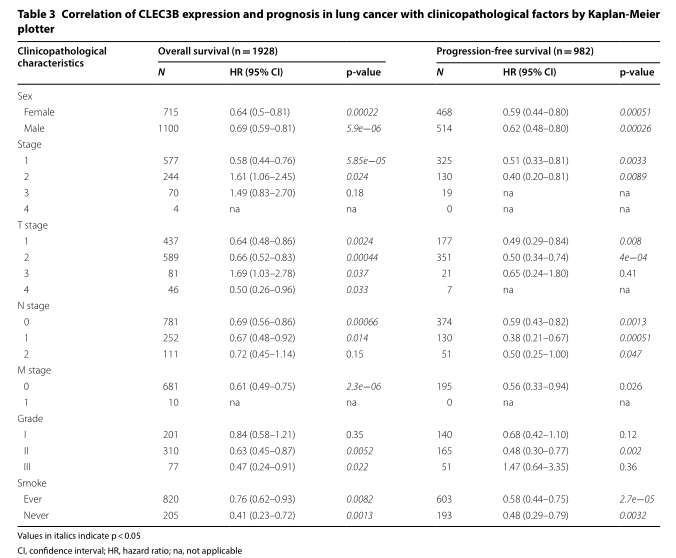
为了确定CLEC3B表达与临床病理特征之间的相关性,我们分析GSE30219和GSE31210数据集,发现CLEC3B下调与T期(p <0.001),N期(p(<0.001),病理期(p <0.001)和吸烟(p(<0.001)(表1、2)密切相关。
CLEC3B对肺癌有很高的诊断价值
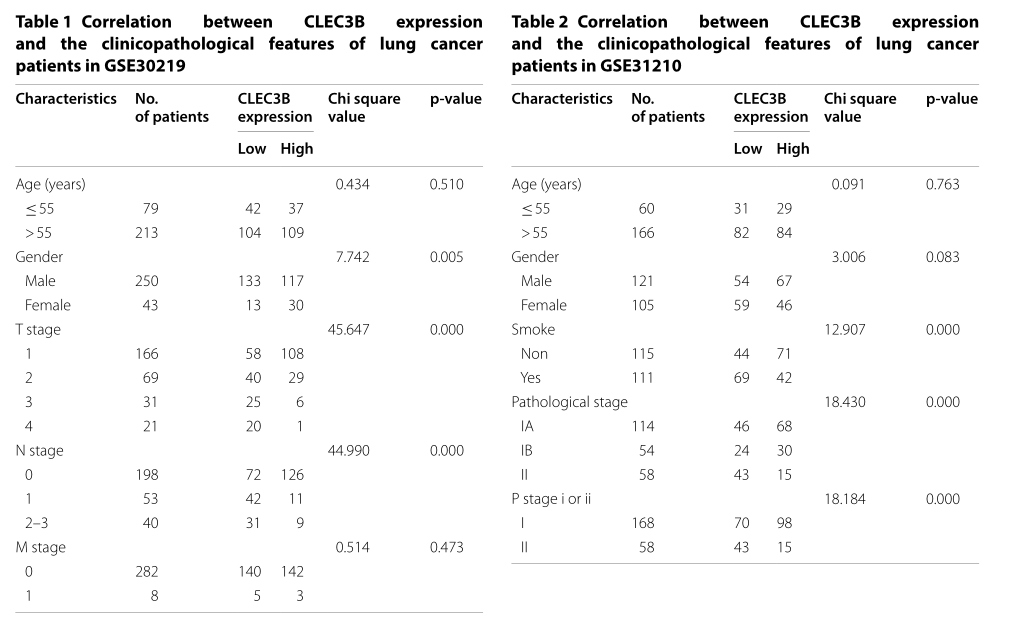
GEO和TCGA数据集用于评估CLEC3B在肺癌中的诊断潜力。TCGA-ADC的ROC分析显示,AUC = 0.993(95%CI 0.987-0.999),灵敏度= 97.6%(95%CI 95.8-98.6%)和特异性= 98.2%(95%CI 90.2-99.9)具有显著的诊断准确性。(图3a);TCGA-SCC的分析还显示了准确度,其中AUC = 0.998(95%CI 0.996–1.00),灵敏度= 97.0%(95%CI 95.1–98.2%),特异性= 100%(95%CI 92.7–100%)(图3b)。如图3c所示,CLEC3B在GSE30219中也显示出很高的诊断准确性,AUC = 0.982(95%CI 0.952-1.00),灵敏度= 98.3%(95%CI 96.1-99.3%),特异性= 92.9%(95%CI 68.5–99.6%)。此外,根据上述临床组织样本H-SCORE,CLEC3B区分肺癌组织与非肿瘤组织的能力的AUC值为0.880(95%CI 0.795-0.964),敏感性为91.2%(95%CI 77.0–96.9%)和特异性为76.5%(95%CI 60.0–87.6%)(图3d)。此外,我们分离了1A期患者并分析了CLEC3B在GSE30219中的诊断价值,结果AUC = 0.972(95%CI 0.922–1.00),敏感性= 98.7%(95%CI 95.3–99.8%)和特异性specific = 92.9%(95%CI 68.5–99.6%)(图3e)。1A期肺癌患者CLEC3B显著下调(图3f)。这些结果表明,CLEC3B在区分肺癌患者和正常个体方面具有很高的诊断性能,甚至在肺癌的早期阶段也是如此。
Fig3:CLEC3B在肺癌中的诊断价值。a,b TCGA数据集中ADC患者和SCC患者的ROC曲线。c GSE30219中所有肺癌患者的ROC曲线。d组织芯片LAC-1403肺癌患者的ROC曲线。GSE30219中1A期肺癌患者的e ROC曲线。f CLEC3B在GSE30219中的正常肺癌和1A期肺癌中的表达。ROC曲线,受试者工作特性曲线;AUC,受试者工作特性曲线下的面积;ADC,腺癌;SCC,鳞状细胞癌。*** p <0.001
CLEC3B表达降低是肺癌预后不良的预测指标
使用Kaplan-Meier数据库和GEO数据集,我们研究了CLEC3B的预后价值。根据自动选择的CLEC3B表达的最佳临界值对患者进行分组。Kaplan-Meier曲线和对数秩检验分析显示,在所有患者中,CLEC3B表达较低的患者的OS明显低于高表达患者(HR = 0.66,95%CI 0.58-0.75,p = 2.1e-10))(图4a);ADC患者(HR = 0.76,95%CI 0.60-0.97,p = 0.025)(图4b)和SCC患者(HR = 0.70,95%CI 0.53-0.91,p = 0.0076)也是如此。4c)。此外,结果显示,在所有肺癌患者(HR = 0.60,95%CI 0.49-0.74,p = 8.3e-07),ADC患者(HR = 0.50,95)中,CLEC3B的低表达预示着PFS低于高表达。%CI 0.36-0.69,p = 1.6e-05)和SCC患者(HR = 0.40,95%CI 0.23-0.67,p = 0.00038)(图4d-f)。
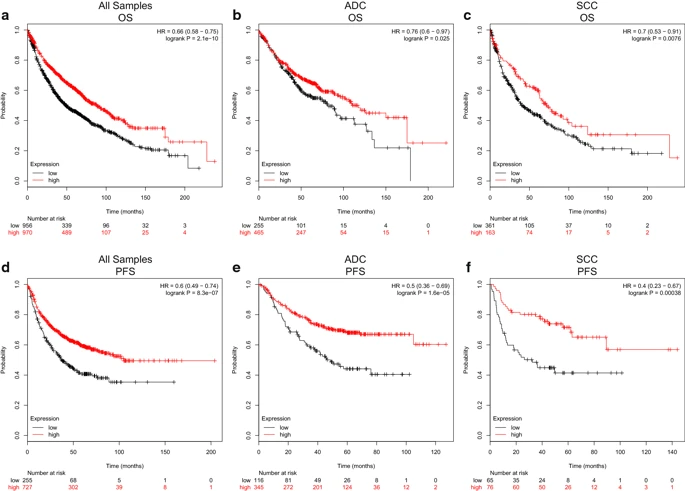
Fig4:Kaplan–Meier生存曲线比较CLEC3B高表达和低表达的肺癌患者。a所有肺癌患者(n = 1926),b ADC患者(n = 720)和c SCC患者(n = 524)的OS生存曲线。所有肺癌患者(n = 982),ADC患者(n = 461)和SCC患者(n = 141)的d–f PFS生存曲线。OS,整体生存率;PFS,无进展生存期;人力资源,危险比;CI,置信区间;ADC,腺癌;SCC,鳞状细胞癌
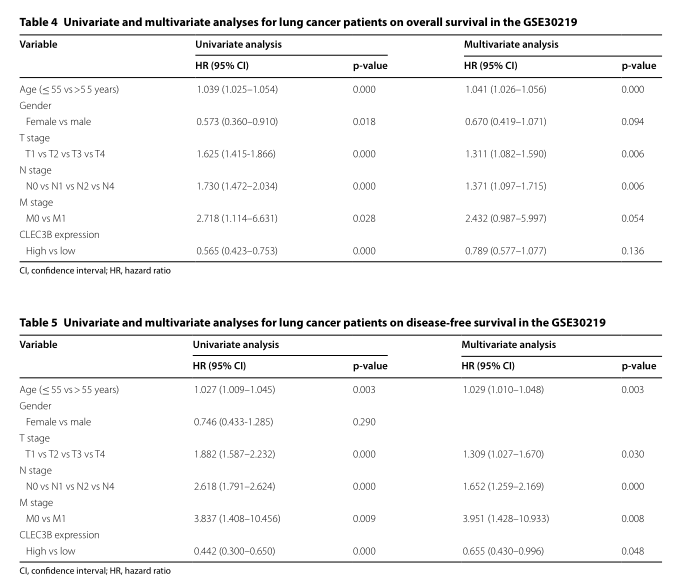
为了更好地了解CLEC3B低表达对生存的影响,Kaplan–Meier数据库分析CLEC3B表达与患者临床特征之间的相关性。CLEC3B的下调与1至2期,T1至T2期和N0至N1期肺癌患者的OS和PFS恶化相关(p <0.05)。此外,CLEC3B的低表达预测吸烟和不吸烟患者的OS和PFS均较差(p <0.05)(表3)。进行Cox回归模型以进一步评估CLEC3B表达的预后潜力。在单变量分析中,CLEC3B表达(HR = 0.565,95%CI 0.423-0.753,Cox p = 0.000)是OS的重要预测指标(表4)。无病生存期(DFS)的多元分析值显著(HR = 0.655,95%CI 0.430-0.996,Cox p = 0.048),而OS则无(表5)。因此,CLEC3B的较低表达可能被定义为肺癌患者DFS的独立危险因素。此外,还可以在GSE30219(其他文件6:图S2a,b)和GSE30210数据集(其他文件6:图S2c,d)中验证能够预测较差OS和DFS的CLEC3B的低表达。
CLEC3B表达与肺癌的免疫浸润相关
被诊断具有相同组织学类型的癌症患者可能具有不同的免疫浸润水平,这可能导致多种临床结果。在包括NSCLC在内的几种癌症中,已经报道了与良好预后相关的原发肿瘤组织中的肿瘤浸润淋巴细胞数量增加。因此,评估了CLEC3B与免疫浸润水平的相关性,以揭示CLEC3B影响肺癌预后的可能机制。使用来自TCGA数据库的数据通过ESTIMATE算法计算患者样品的免疫评分,以预测肿瘤组织中浸润性免疫细胞的存在。根据免疫评分的等级,我们用中位数将ADC和SCC病例分为高评分组和低评分组。结果表明,CLEC3B在SCC的高免疫评分组中被上调,但在ADC中没有统计学意义,这表明CLEC3B可能参与了SCC的免疫浸润(图5a,b)。
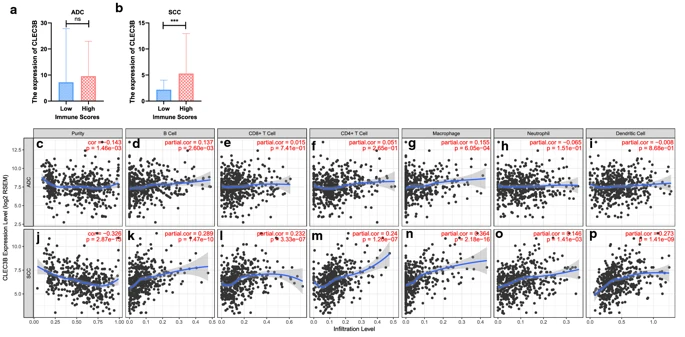
Fig5:ADC和SCC中CLEC3B表达与免疫浸润水平的相关性。a,b ADC和SCC高免疫评分组和低免疫评分组之间CLEC3B表达的比较。c–p CLEC3B与TIMER分析的肿瘤纯度以及ADC和SCC的免疫浸润水平有关。ADC,腺癌;SCC,鳞状细胞癌;ns,没有意义。*** p <0.001
为了进一步验证CLEC3B表达与肺癌的免疫浸润之间的关系,我们使用TIMER来评估CLEC3B表达与肿瘤纯度和免疫细胞浸润水平的相关性。结果表明,CLEC3B表达与ADC肿瘤纯度略有相关,但与肿瘤纯度和SCC的免疫浸润水平有更显著的相关性。在ADC中,CLEC3B的表达水平与CD8 + T细胞,CD4 + T细胞,中性粒细胞和树突状细胞(DC)的浸润没有显著相关性(图5c-i)。然而,在SCC中,CLEC3B的表达与B细胞(r = 0.289,p = 1.47e-10),CD8 + T细胞(r = 0.232,p = 3.33e-07),CD4 +的浸润显著正相关。T细胞(r = 0.24,p = −1.20e−07),巨噬细胞(r = 0.364,p = 2.18e−16),中性粒细胞(r = 0.146,p = 1.41e-03)和DC(r = 0.273,p= 1.41e−09)(图5j–p)。这些发现表明CLEC3B可能在SCC的免疫浸润中起重要作用。
在TIMER数据库中分析了CLEC3B与免疫细胞免疫标志物之间的相关性,以探讨CLEC3B与ADC和SCC的免疫浸润细胞之间的关系(表6)。在SCC中,CLEC3B的表达与不同功能性T细胞(CD8 + T,Th1,Th2等),B细胞,树突状细胞,嗜中性粒细胞和自然杀伤细胞的大多数基因标记呈正相关。结果如图5所示。此外,CLEC3B与肿瘤相关的巨噬细胞(TAM)浸润有关,既发挥了抗肿瘤作用又发挥了促肿瘤作用。但是,CLEC3B的表达与ADC中B细胞,DC,嗜中性粒细胞,自然杀伤细胞和Th1细胞的标记物仅有极强的相关性。结果表明,CLEC3B的表达水平与SCC免疫细胞的大多数免疫标记显著相关,而ADC中仅有少数标记。这些发现可能为CLEC3B在ADC和SCC中的预后价值差异提供了解释。
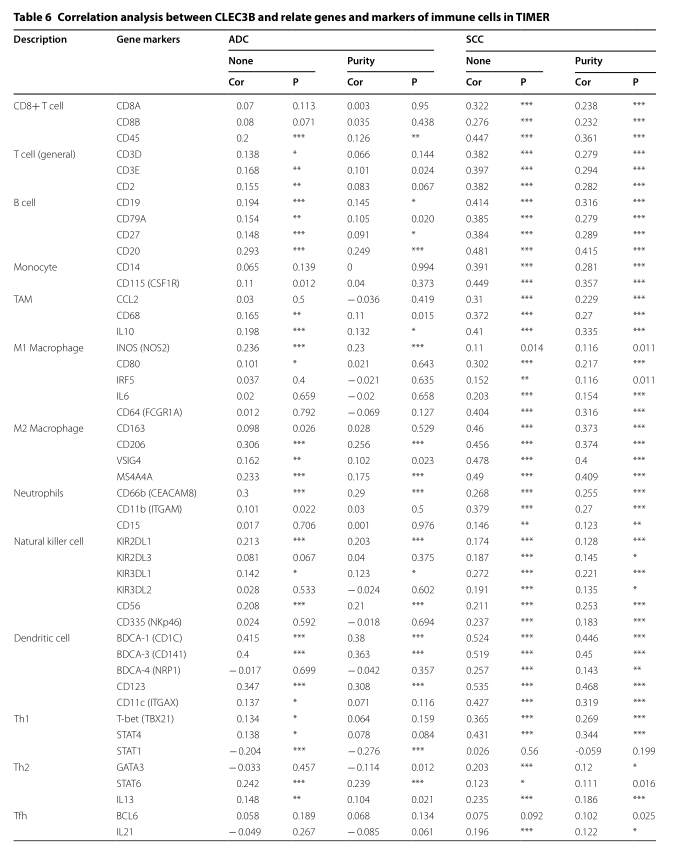
CLEC3B参与肺癌的免疫激活和增殖抑制
我们采用GSEA分析方法探索CLEC3B在肺癌中的机制。根据CLEC3B的中位表达,将ADC和SCC的TCGA数据分为高(最高50%)和低(最低50%)CLEC3B表达组。使用GMT文件C5(GO基因集)分析TCGA数据。附加文件7、8、9、10:表S4,S5,S6,S7中显示了前20个富集结果(标称p值<0.05和FDR <0.25)。在CLEC3B高表达ADC中,与癌症进展相关的富集结果很少,而在SCC CLEC3B高表达组中,许多与免疫激活相关的基因集被富集,表明CLEC3B可能通过免疫激活抑制SCC的进展,这也与先前的结果一致(图6a-e)。此外,ADCEC和SCC的CLEC3B低表达组中富集了几个与细胞周期相关的基因集,这表明CLEC3B也可能参与了肺癌细胞增殖的抑制作用(图6f-o)。
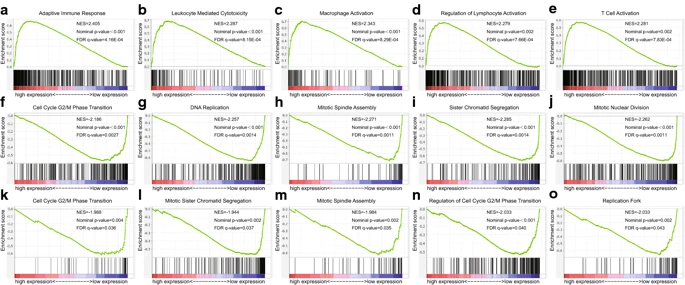
Fig6:根据CLEC3B在肺癌中的表达丰富了免疫激活和细胞周期过程。使用ADC和SCC的TCGA基因表达谱进行基因集富集分析,并选择“ c5.all.v5.1”基因集进行分析。a–e免疫激活过程在SCC的CLEC3B高表达组中富集。f–j细胞周期过程在ADC的CLEC3B低表达组中富集。k–o细胞周期过程在SCC的CLEC3B低表达组中富集。
讨论
癌症的生存率很大程度上取决于诊断的阶段。然而,40-60%的肺癌患者直到晚期阶段才诊断出。在本研究中,我们观察到肺癌中CLEC3B表达的下降,与OS和DFS恶化有关。我们的结果还表明,CLEC3B与肺癌的免疫浸润有关,这可能是CLEC3B影响预后的机制。这些结果表明CLEC3B可以作为诊断和预后的潜在生物标志物,可以被认为是一种新型的免疫相关治疗靶标。C型凝集素结构域家族的成员CLEC3B编码四聚体蛋白tetranectin。已经在几种肿瘤中证实了CLEC3B的低表达。但是,其在肺癌中的表达水平和功能尚未见报道。数据库分析和患者样本检测表明,CLEC3B在各种类型的肺癌中均显著下调。此外,我们的结果表明,CLEC3B在1A期中显著下调,并且在早期对肺癌具有很大的诊断价值,因为CLEC3B对1A期肺癌患者的诊断的AUC值约为1,这表明具有重要意义。因此,我们的结果表明CLEC3B的表达可以高灵敏度和特异性将肺癌患者与健康个体区分开。我们发现,CLEC3B的下调与不良的PFS和OS相关。此外,单因素和多因素分析表明,CLEC3B的较低表达可能被定义为影响肺癌患者OS和DFS的危险因素。因此,我们验证了CLEC3B在肺癌中具有预后价值。此外,CLEC3B表达水平与TNM分期呈负相关。CLEC3B水平低的患者更有可能在TNM晚期出现疾病,这表明CLEC3B是肺癌的抑癌基因。在口腔鳞状细胞癌中,据报道CLEC3B是一种抑癌基因。近年来见证了肿瘤免疫疗法的快速发展。人们越来越认识到免疫系统在癌症发展和进展中的作用。肿瘤微环境作为一种预后和诊断性生物标志物或治疗靶标的探索是积极研究的领域。一些研究表明,免疫细胞浸润会影响肺癌的生存。本研究的其他重要发现是CLEC3B在肿瘤免疫微环境中起作用,并且CLEC3B的表达与肺癌尤其是SCC中的免疫浸润水平相关。我们的结果显示,CLEC3B表达与SCC中B细胞,CD8 + T细胞,CD4 + T细胞,巨噬细胞和DC浸润之间存在最显著的正相关。在NSCLC肿瘤微环境中,免疫细胞类型是T细胞,其次是B细胞,巨噬细胞,DC和自然杀伤细胞。树突状细胞是专门的抗原呈递细胞,在抗肿瘤T淋巴细胞的激活中起重要作用。T细胞的浸润通常预示着患者会有更好的临床结果。另外,肿瘤浸润性B细胞在肿瘤微环境中的作用引起了越来越多的关注。大多数研究表明,NSCLC中B细胞的浸润与良好的预后有关。在未使用PD-1 / PD-L1抑制剂治疗的NSCLC患者中,较高的T和B细胞水平与更好的预后相关。GSEA的结果进一步证实CLEC3B可能参与了SCC的免疫激活。此外,我们的结果表明CLEC3B与SCC中的巨噬细胞有关。然而,巨噬细胞浸润和活化在肺癌中的作用仍存在争议。通常,TAM发挥促肿瘤作用。然而,在适当的刺激下,它们可能具有与T细胞协同抗肿瘤作用的能力。根据最新报告,高水平的M1,CD204 + M2和巨噬细胞浸润是I至III期NSCLC患者预后良好的独立因素。我们的结果表明,CLEC3B能够募集和调节肺癌的免疫浸润细胞。然而,CLEC3B在肿瘤免疫微环境和肿瘤进展中的确切作用仍需进一步研究探索。两者合计,我们的结果表明CLEC3B可能通过免疫浸润和免疫激活改善肺癌患者的预后。关于CLEC3B对SCC和ADC免疫浸润的不同影响,我们认为这可能是由于它们固有的免疫微环境的差异所致。值得指出的是,CLEC3B在SCC中的预后价值比ADC更重要(图4),这可能是由于CLEC3B表达与SCC中的免疫浸润之间的相关性比ADC中更强。此外,我们还发现CLEC3B可能与肺癌细胞增殖的抑制有关,这与透明细胞肾细胞癌的报道一致。抑制细胞增殖的功能与肺癌患者的预后相关。总之,CLEC3B诱导的免疫激活和增殖抑制可能是该基因抗癌作用的两个组成部分。
参考文献:
Sun J, Xie T, Jamal M, et al. CLEC3B as a potential diagnostic and prognostic biomarker in lung cancer and association with the immune microenvironment[J]. Cancer cell international, 2020, 20(1): 1-15.
.png)