本期特邀文章第一作者何涛博士后分享解读,感谢广州医科大学附属第一医院泌尿外科曾国华教授团队刘永达教授课题组对circRNA平台的关注!
肾细胞癌(Renal cell carcinoma, RCC)是严重影响人类健康的恶性肿瘤之一。2022年统计显示,肾癌在美国新诊断的肿瘤病例中占比超过4%。研究报告显示,约70%的肾癌患者在初诊时为局限性肿瘤,但是,约30%至50%的病例在经过治疗后将发生致命性的远处转移。因此,迫切需要进一步探索RCC进展的机制,以期寻找有效的诊断和治疗靶点。
环状RNA(circular RNAs,circRNAs)是非编码RNA重要的成员,在真核生物中大量表达。由于circRNA具有特殊的环状结构,使其拥有高度的保守性及稳定性,这让其在疾病的诊断和预测预后中成为最理想的生物标志物。目前,circRNA在肿瘤中的作用已被大量的证实。在既往的肾癌研究中,circRNA主要通过结合miRNA起到调控作用。因此,circRNA是否通过其它机制调控肾癌的进展,目前研究尚少。
肿瘤相关成纤维细胞(Cancer-associated fibroblasts, CAFs)作为肿瘤间质中的主要细胞类型,在促进肿瘤的发展和转移中扮演着至关重要的角色。而外泌体(Extracellular vesicles, EVs)是由各种细胞释放的细胞外颗粒,其中包含各种生物活性分子,如脂质、蛋白质和核酸(包括circRNA)。最近研究证实,来源于肿瘤细胞的EVs可以作为信息传递者,可将生物活性分子传递到远处的器官,从而重塑转移部位的微环境,促进肿瘤的转移。但是,在肾癌的进展中,circRNA是否被包装至外泌体中,并通过外泌体投送至成纤维细胞中,将成纤维细胞转换为CAFs,从而改变肾癌的微环境,促进肾癌转移,目前尚不清楚。因此,探索circEHD2在肾癌进展中的作用机制,对肾癌的防治以及提高患者的生活质量具有重要的意义。
2023年7月22日,广州医科大学附属第一医院泌尿外科曾国华教授团队刘永达教授课题组(刘永达教授为通讯作者,何涛博士后及张乾升硕士为本文共同第一作者)在《Molecular Cancer》(IF=37.3)发表了题为“Extracellular vesicle-circEHD2 promotes the progression of renal cell carcinoma by activating cancer-associated fibroblasts”的研究论文。该研究发现了circEHD2通过circEHD2/YWHAH/YAP/SOX9信号轴促进肾癌的增殖,而外泌体circEHD2通过将成纤维细胞转化为CAFs促进肾癌的转移。该研究揭示了circEHD2在肾癌进展中的新机制,并有可能成为肾癌新的治疗靶点。

亮 点
1)circEHD2在肾癌组织以及转移性肾癌的血清外泌体中高表达;而肾癌组织中circEHD2的高表达与患者的不良预后密切相关。
2)敲低circEHD2显著抑制肾癌细胞的增长。
3)circEHD2通过结合YWHAH蛋白后,YWHAH蛋白作为一个桥梁蛋白将circEHD2及转录因子YAP稳定的固定在SOX9的启动子区域,从而促进SOX9的持续高表达,促进肾癌的增殖。
4)剪接因子FUS可调控circEHD2的生成。
5)hnRNPA2B1可通过结合circEHD2的方式将circEHD2包装至外泌体中,而外泌体将circEHD2传递至成纤维细胞中,激活成纤维细胞转换为CAFs,CAFs分泌细胞因子IL-6,从而促进肾癌的转移。
6)circEHD2-ASO在体内可明显抑制肿瘤的增殖。
1、circEHD2在肾癌样本中高表达、具有临床生物标志物的潜能
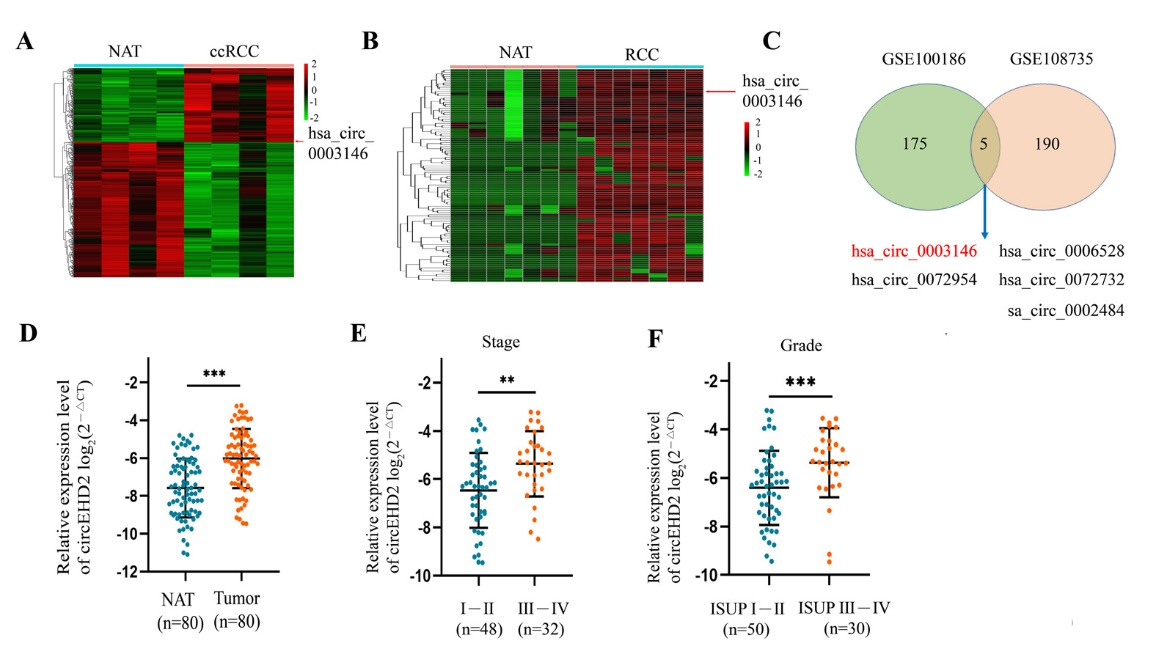 图1 circEHD2的来源,circEHD2在肾癌组织中及高分期、高分级的肾癌组织中高表达
图1 circEHD2的来源,circEHD2在肾癌组织中及高分期、高分级的肾癌组织中高表达
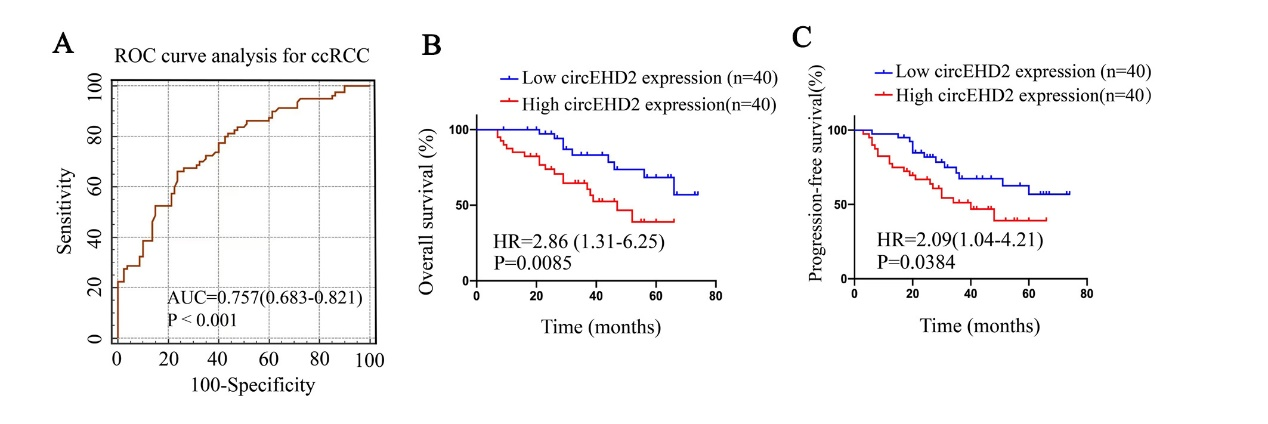 图2 ROC分析及KM生存分析
图2 ROC分析及KM生存分析
通过对公共数据库GSE100186和GSE108735分析,发现circEHD2在两个数据库中都高表达。同时,研究团队收集80例肾癌患者进行分析,发现circEHD2在癌组织中的表达量高于癌旁组织,并在高分期及高分级的肾癌组织中高表达。肾癌组织中高表达的circEHD2与患者预后不良密切相关。
2、circEHD2促进肾癌的增殖能力
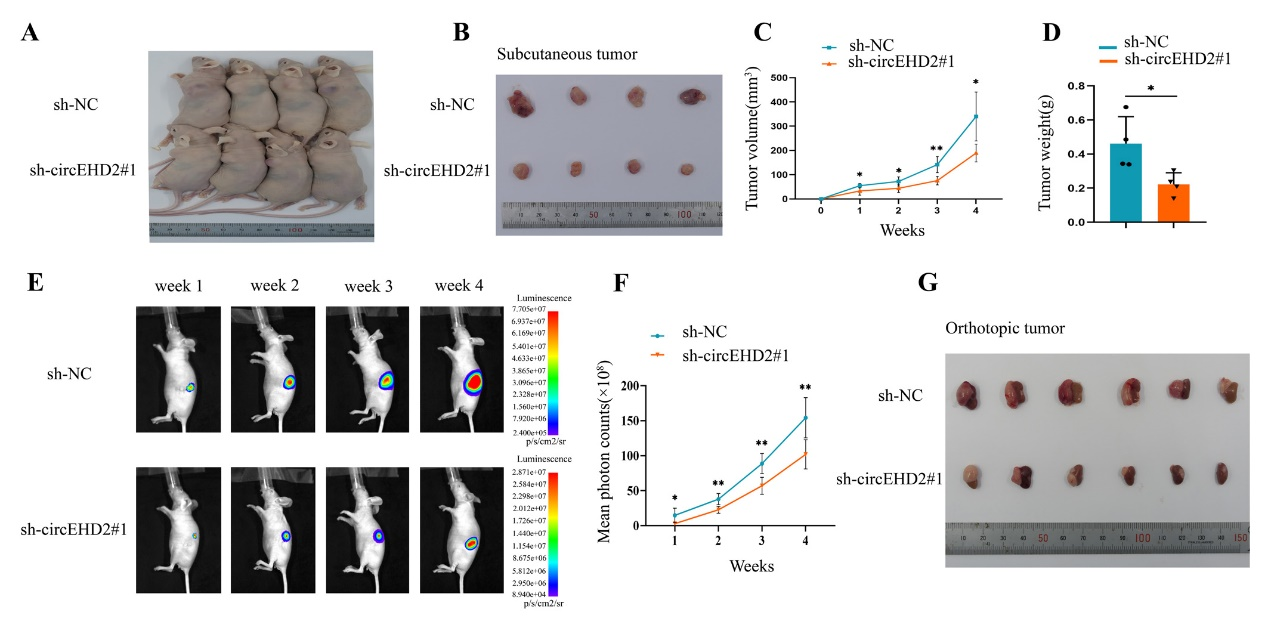 图3 敲低circEHD2抑制肿瘤的生长
图3 敲低circEHD2抑制肿瘤的生长
3、SOX9是circEHD2的下游调控基因
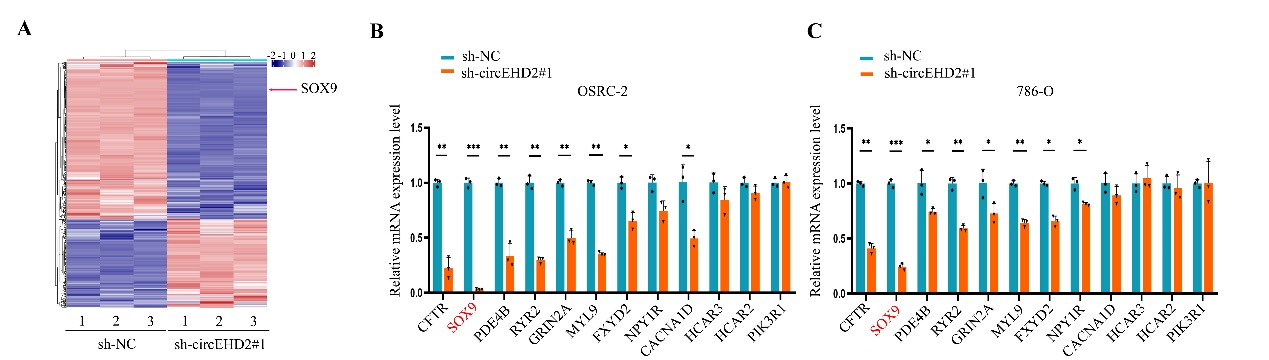 图4 SOX9受circEHD2的调控
图4 SOX9受circEHD2的调控
4、circEHD2在肾癌细胞中可与YWHAH蛋白结合于细胞核中
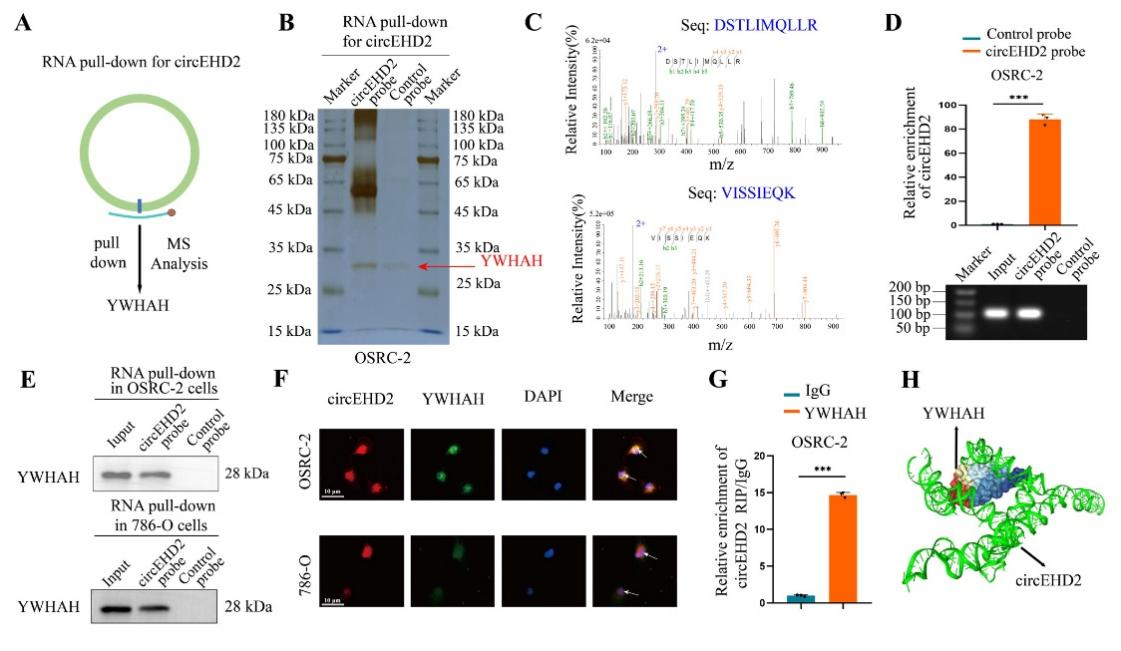 图5 circEHD2可结合YWHAH蛋白
图5 circEHD2可结合YWHAH蛋白
5、YWHAH可与转录因子YAP结合于细胞核中
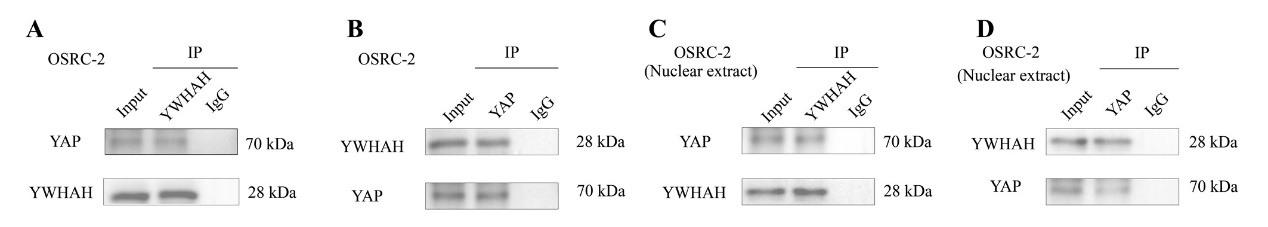
图6 YWHAH可结合YAP
6、YWHAH可作为桥梁蛋白,将circEHD2及转录因子YAP共同固定于SOX9的启动子区域,从而促进SOX9的高表达,促进肾癌的进展
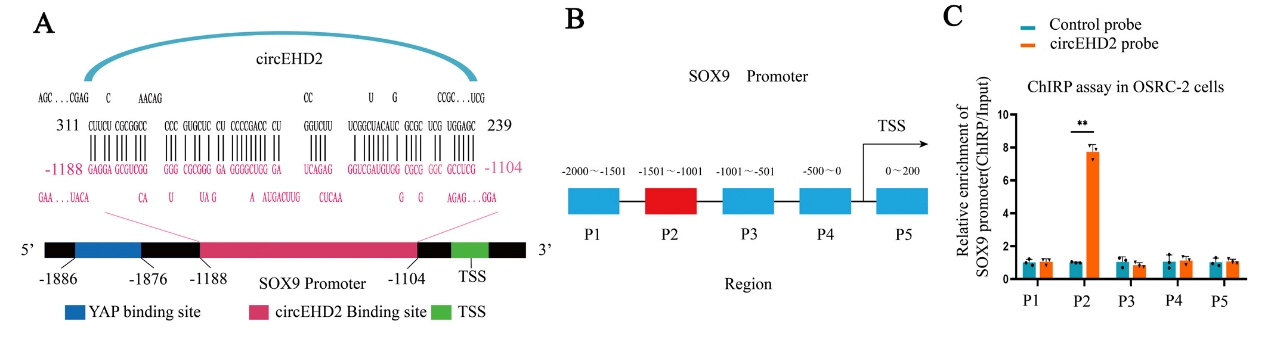 图7 YWHAH可将circEHD2及YAP固定于SOX9的启动子区域
图7 YWHAH可将circEHD2及YAP固定于SOX9的启动子区域
7、剪接因子FUS可通过结合circEHD2的前体mRNA,从而促进circEHD2的生成
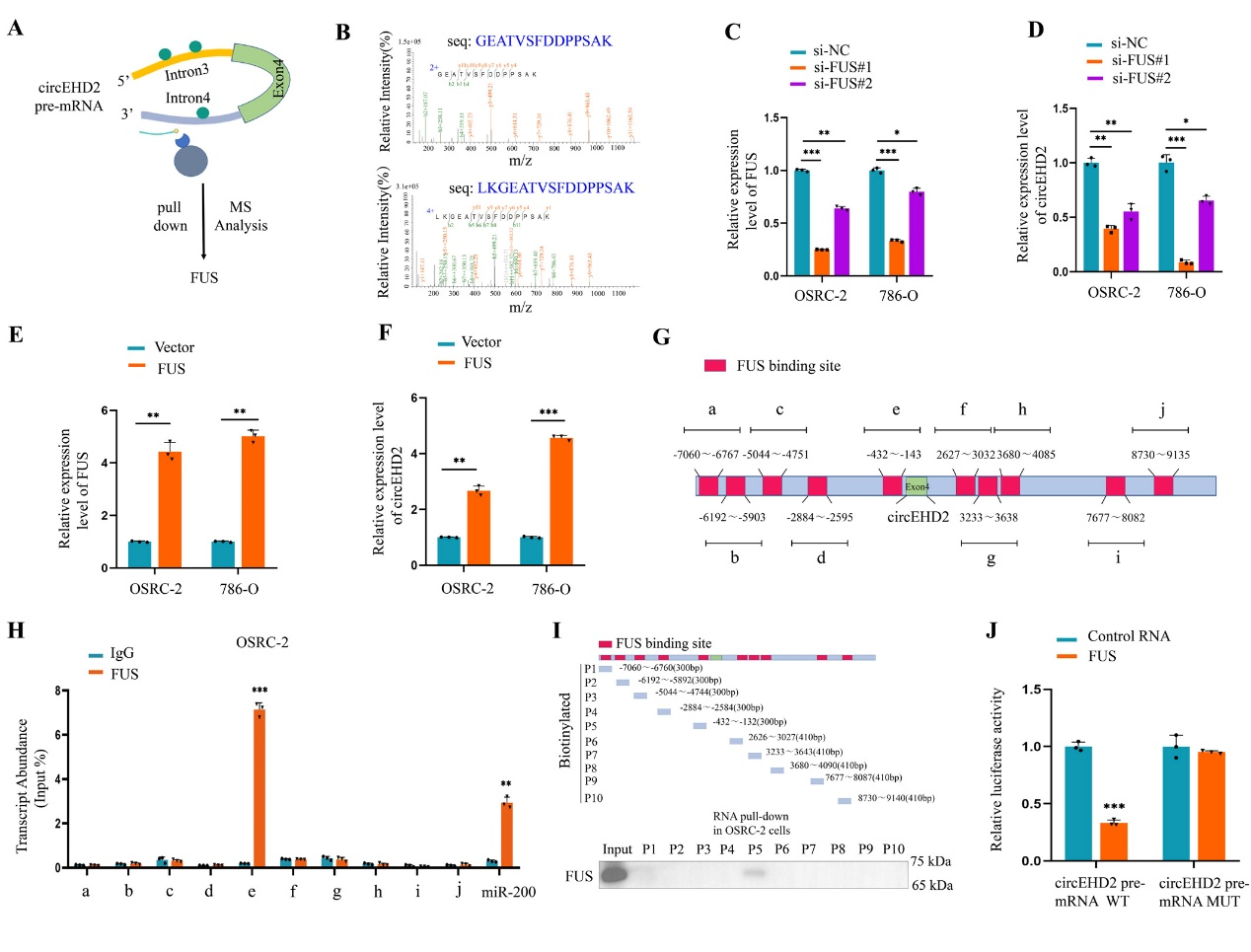 图8 FUS促进circEHD2的生成
图8 FUS促进circEHD2的生成
8、hnRNPA2B1可通过与circEHD2结合的方式,将circEHD2包装至外泌体中
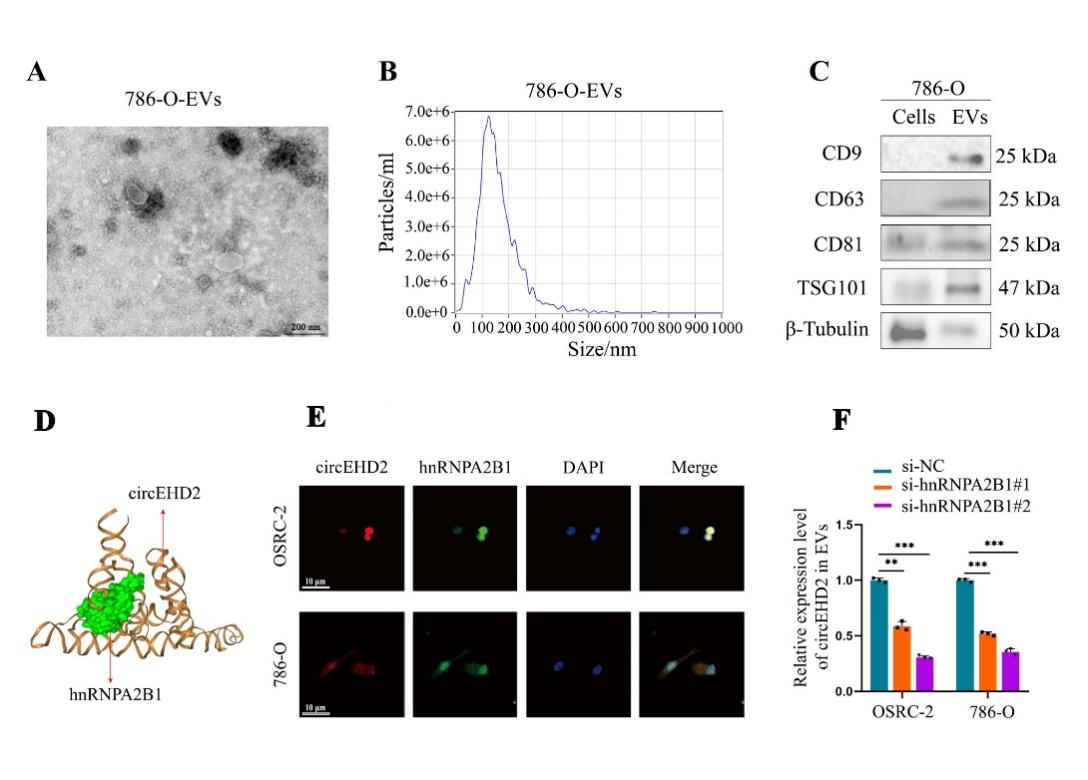 图9 hnRNPA2B1调控circEHD2包装至外泌体中
图9 hnRNPA2B1调控circEHD2包装至外泌体中
9、肾癌细胞分泌的外泌体circEHD2转运至成纤维细胞中,激活成纤维细胞转换为肿瘤相关成纤维细胞(CAFs),而CAFs通过分泌IL-6,促进肾癌细胞的转移
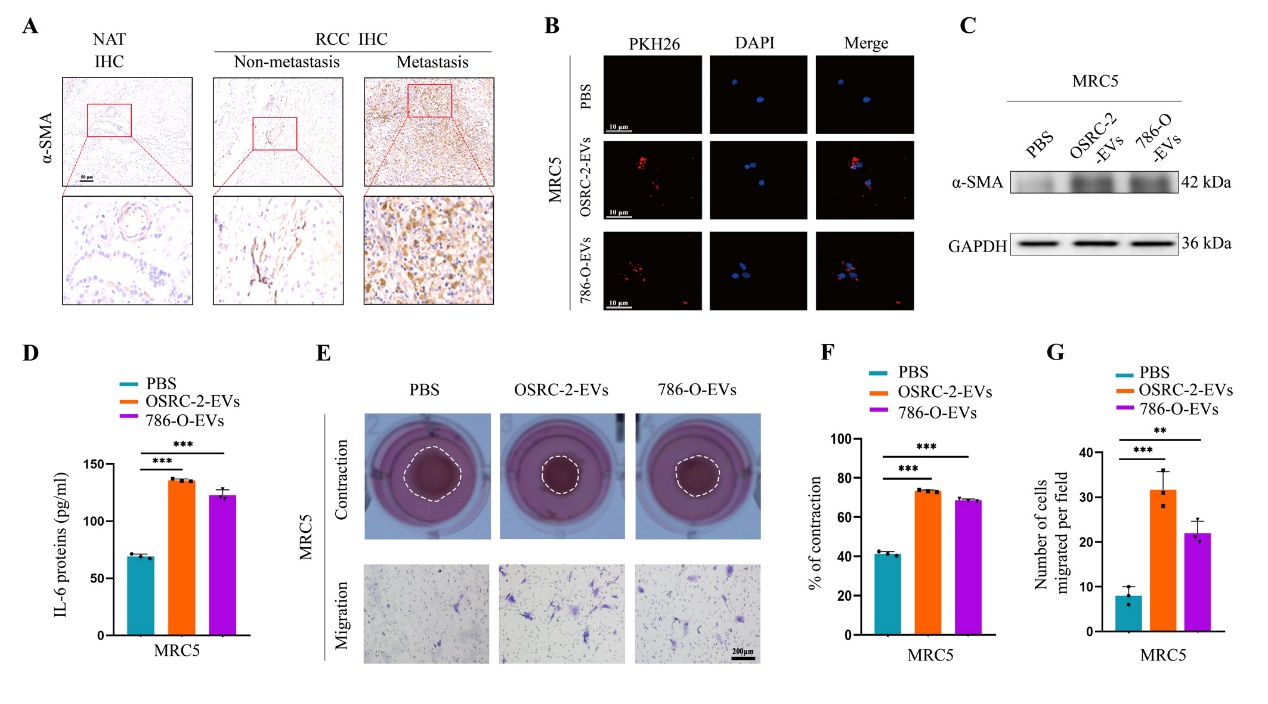 图10 外泌体circEHD2促进CAFs的激活
图10 外泌体circEHD2促进CAFs的激活
10、circEHD2-ASO可明显抑制肿瘤的生长,因此,circEHD2可能成为治疗肾癌的潜在分子靶点
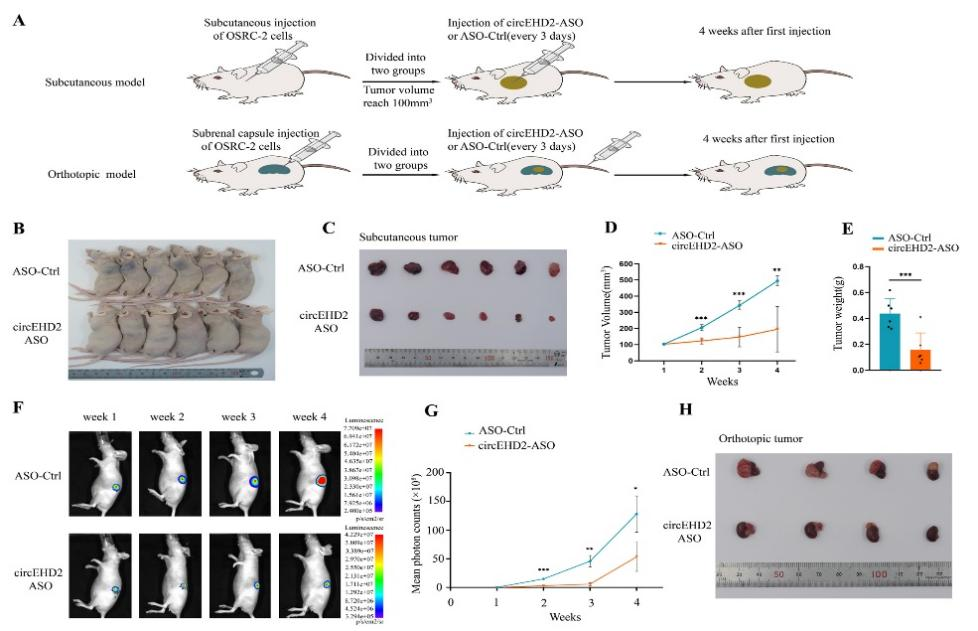 图11 circEHD2-ASO抑制肾癌的生长
图11 circEHD2-ASO抑制肾癌的生长
结论
综上所述,研究团队阐明了EVs-circEHD2促进 RCC进展的一种新机制。FUS调控 circEHD2的生成,而YWHAH则充当了桥梁蛋白将circEHD2和YAP募集到SOX9启动子区域,从而维持SOX9的高表达,促进RCC的生长。更重要的是,hnRNPA2B1可调控circEHD2包装至外泌体中,EVs-circEHD2激活成纤维细胞成为CAFs,从而诱导RCC的转移。研究表明,外泌体circEHD2可为肾癌的治疗提供新靶点。
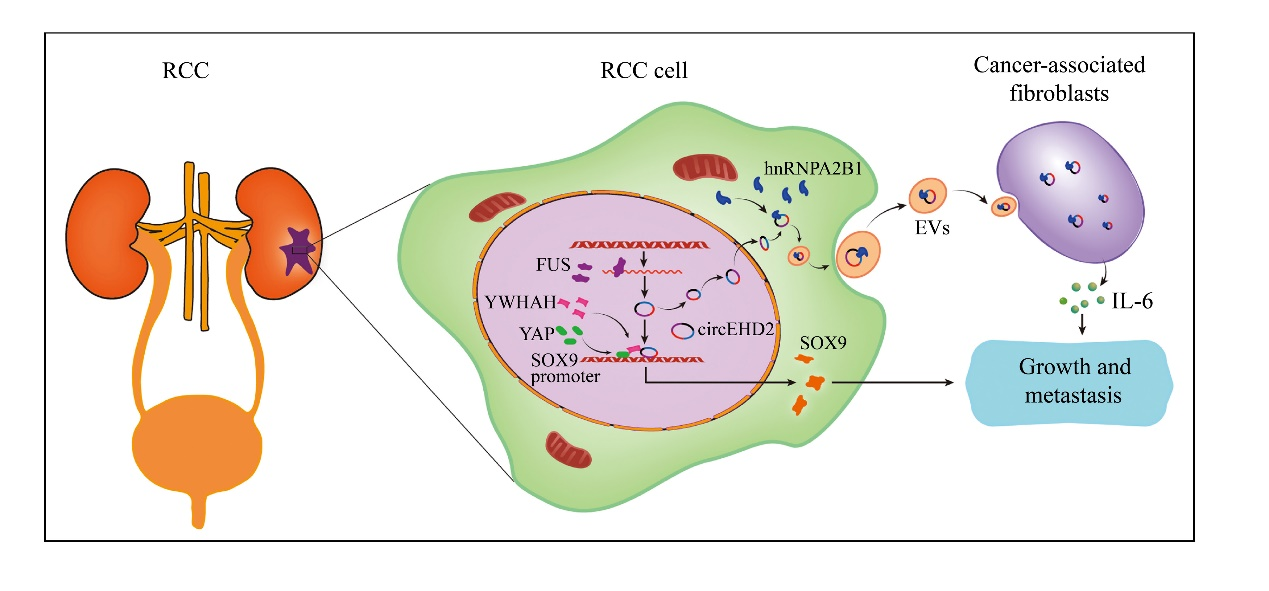 图12 外泌体circEHD2促进肾癌进展的机制模式图
图12 外泌体circEHD2促进肾癌进展的机制模式图
原文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01824-9

.png)