CRC(结直肠癌)作为最常见的恶性肿瘤之一,是癌症导致死亡的第二大因素[1]。虽然临床上-针对CRC患者治疗的方案不断更新迭代,但是CRC患者的总体生存率仍旧很低。L-OHP (奥沙利铂)是一种抑制基因转录和DNA合成的第三代铂化合物,常用于CRC患者手术切除后的化疗方案中。然而,癌细胞最终形成的化学作用可通过多种机制阻碍L-OHP的有效性,包括药物吸收减少和药物失活等。因此,必须明确CRC细胞对L-OHP产生耐药性的精确分子机制,识别有效的生物标记物来分析L-OHP反应,并开发靶向治疗以减少耐药性。
越来越多的研究表示,外泌体中的非编码RNA和蛋白对参与肿瘤侵袭、增殖、免疫逃逸和耐药的靶细胞起作用,尤其是circRNA(环状RNA)。最近的一些研究已经报道了circRNA实际上可以编码蛋白质。并且外泌体富集的circRNA在CRC化疗耐药中的功能和潜在机制备受关注,并需要进一步研究。
近期,广东省人民医院胃肠外科主治医师李勇在Advanced Science上发表文章:A Novel Protein Encoded by Exosomal CircATG4B Induces Oxaliplatin Resistance in Colorectal Cancer by Promoting Autophagy。文章表示:L-OHP虽常用于结直肠癌手术切除后的化疗方案,但是其耐药性的出现会影响CRC患者的疗效。而circATG4B是L-OHP耐药发生的关键。机制在于,circATG4B可编码一种新的蛋白质(circATG4B-222aa)与TMED10互作,阻止TMED10与ATG4B结合,从而导致自噬增加,继而诱导L-OHP耐药。研究揭示了外泌体circATG4B参与了CRC细胞化疗敏感性的降低,为潜在的治疗CRCL-OHP 耐药靶点提供了新的理论基础。

1.L-OHP耐药CRC中ATG4B相关circRNA的分析
ATG4B在各种癌症中的自噬诱导功能,已被报道与化疗耐药有关[2]。因此,作者在circBase找到15个ATG4B,并从中发现circATG4B(hsa_circ_0007159)在L-OHP 耐药患者的CRC组织以及耐药CRC细胞系中明显上调。背靠背引物验证/R酶处理/FISH验证circATG4B成环/稳定/定位胞质。这些结果表明circATG4B稳定存在,并与CRC患者的L-OHP 反应密切相关。
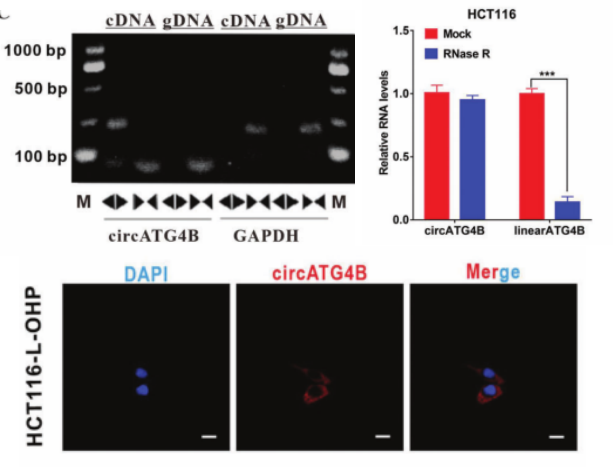
图1. circATG4B的特性
2.来自外泌体的circATG4B诱导CRC细胞耐药性
以前的研究已经证明,circRNA可以包装成外泌体,并可以进行细胞间转移。因此,我们假设从L-OHP 耐药的CRC细胞分离出的外泌体circATG4B可转移到L-OHP 敏感细胞,导致细胞产生耐药性。为了验证这一假设,从L-OHP 耐药CRC细胞上清液中分离出的外泌体,电镜/NTA/WB观察其双层膜的结构/前体大小分布/外泌体标记物的表达,且circATG4B在外泌体中含量丰富;然后发现,该外泌体可侵染正常CRC细胞。此外,体外细胞实验+体内表示,外泌体circATG4B降低了CRC患者对L-OHP 的敏感性;而敲低circATG4B则有相反的结果。
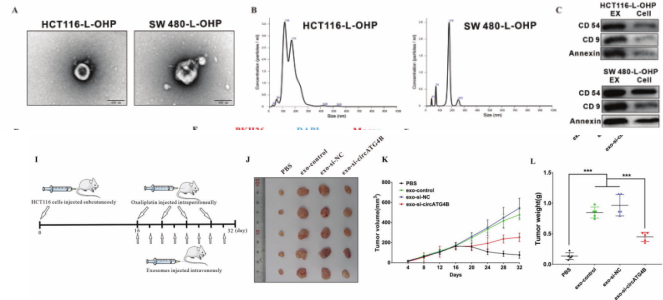
图2. 外泌体的circATG4B诱导CRC细胞耐药性
3.外泌体circATG4B增强L-OHP 耐药过程中的自噬活性
根据以往的研究,自噬在药物耐药过程中起着重要作用。作者发现自噬诱导剂——雷帕霉素可诱导CRC细胞耐药,自噬抑制剂——3-甲基腺嘌呤增加CRC细胞耐药;L-OHP 会增加CRC细胞自噬水平,进而诱导CRC细胞耐药。而同时外泌体circATG4B可诱导CRC细胞L-OHP 耐药,作者推测自噬介导了该作用。过表达circATG4B增强CRC细胞耐药性,然而,3-甲基腺嘌呤治疗逆转了这一作用,表明circATG4B可以通过自噬诱导耐药。此外,透射电镜(TEM)分析显示,exo-si-NC预处理后自噬体数量增加,而exo-si-circATG4B预处理后自噬体数量显著减少(图3G)。进一步证实了外泌体circATG4B通过调节自噬诱导CRCL-OHP 耐药。
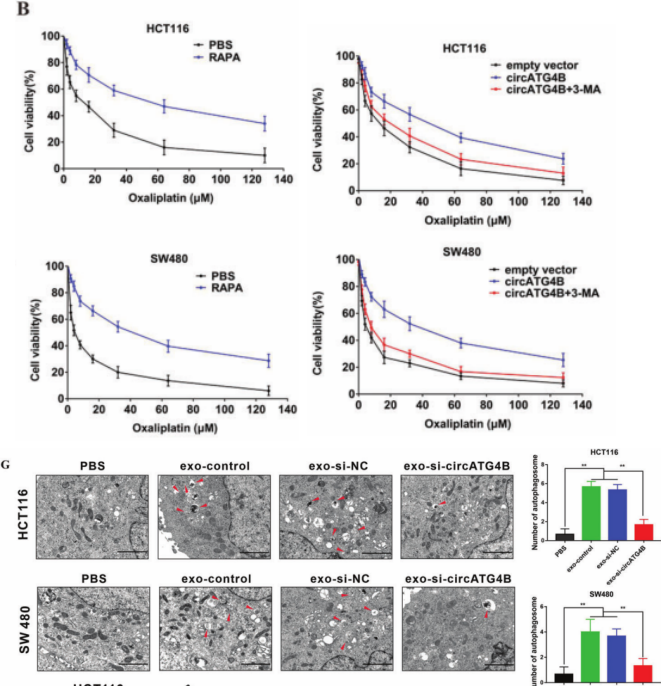 图3. 外泌体circATG4B促进细胞自噬
图3. 外泌体circATG4B促进细胞自噬
4.circATG4B编码一种新的蛋白-circATG4B-222aa诱导细胞L-OHP耐药
MicroRNA (miRNA)海绵作用是circRNA最常见的功能。然而,RIP结果显示circATG4B与AGO2无关,这表明circATG4B可能通过不同的机制发挥其功能。越来越多的证据表明,一些circRNA能够编码新的蛋白质。通过查阅circRNA Db发现,circATG4B有一个669nt的ORF,有可能编码222个氨基酸的蛋白质,并且其中有一段包含33个氨基酸的新序列。作者在ORF中发现534nt-672nt处有一个IRES,并用双荧光素酶法验证了circATG4B中IRES具有活性。随后,作者构造了四个不同的载体(阴性空载对照/带Flag标签载体/突变起始密码子+Flag标签阴性载体对照/线性阳性载体对照),又研发了一种新的抗体(特异识别circATG4B-222aa),用qPCR和WB证实circATG4B-222aa能够被翻译出来。最后,通过SDS-PAGE分离转染了circATG4B细胞的总蛋白,然后将大小接近24kd的蛋白条带切除并提交质谱分析,发现了circATG4B的剪接位点处所形成的独特肽序列(IAELDPSIAVIGGGHKG),表明circATG4B可以编码一种新的蛋白质。此外,在接受L-OHP 治疗的CRC患者中,circATG4B-222aa表达与不良预后呈正相关,这提示circATG4B-222aa可能是L-OHP 耐药细胞的预后标志物。
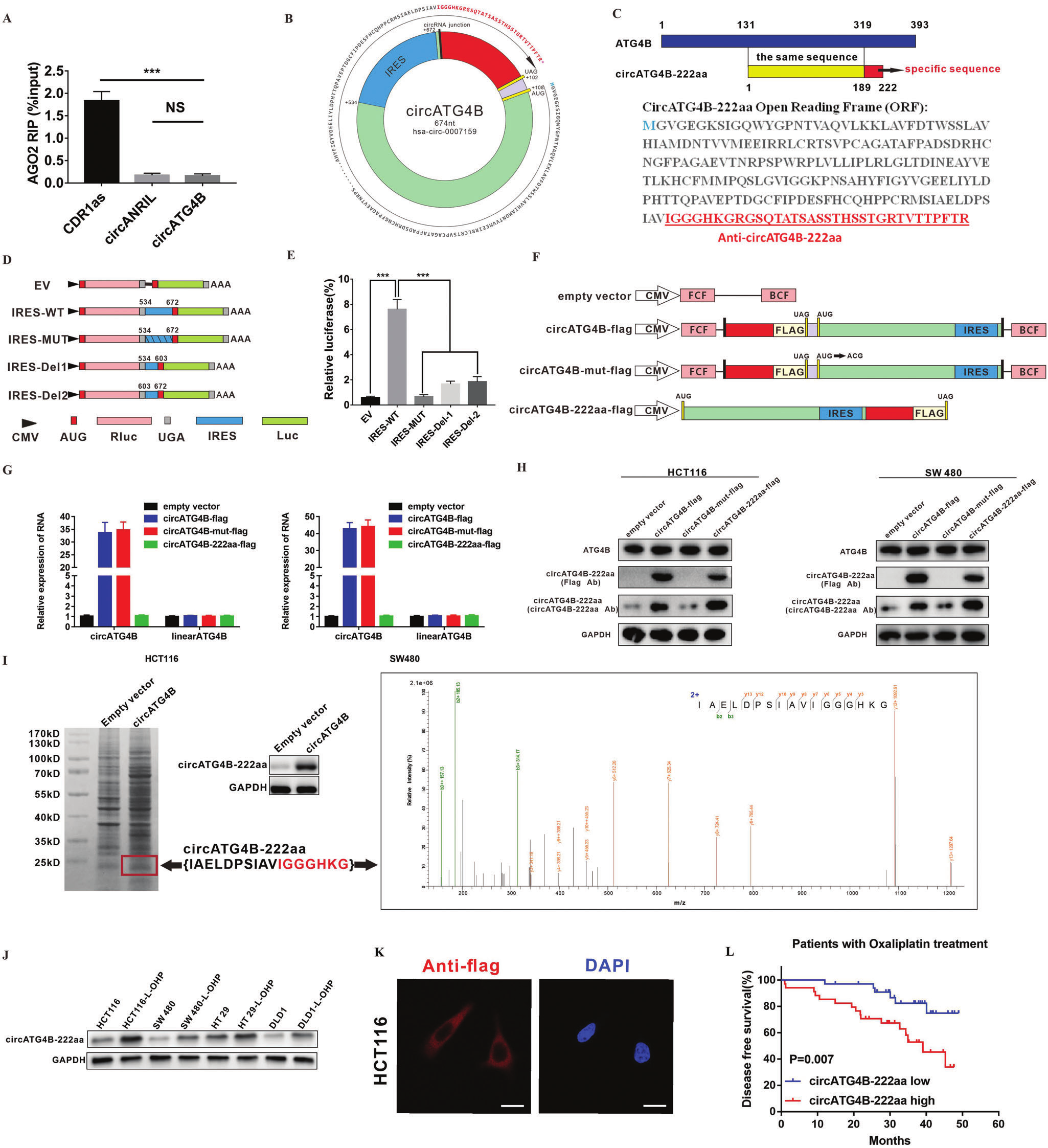
图4. circATG4B编码CircATG4B-222aa
作者通过将上述4种载体体外转染到CRC细胞中发现,仅转染circATG4B或circATG4B-222aa过表达载体后,自噬增加,CRC细胞耐药性增加;另外,作者又在体内小鼠中做皮下注射稳转四种载体细胞,结果同体外实验相同。这些结果表明,能够编码circATG4B-222aa的载体才可增加自噬水平,诱导细胞L-OHP 耐药。
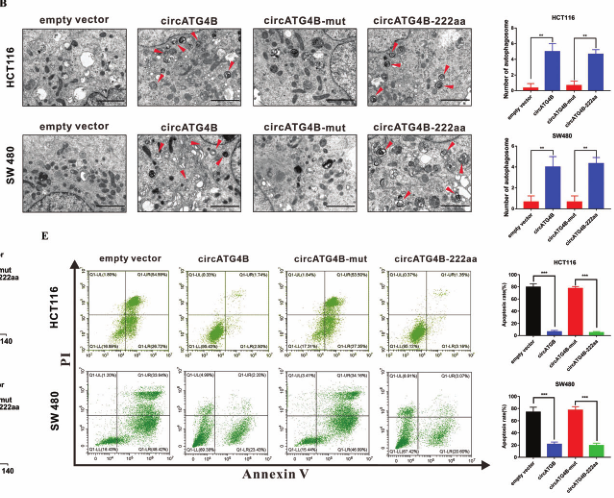
图5.完整的circATG4B才可增加自噬水平,诱导细胞L-OHP耐药
5.circATG4B-222aa与TMED10蛋白互作,释放ATG4B
为了进一步探索circATG4B-222aa在自噬中的潜在机制。作者CO-IP/MS/IF检测circATG4B-222aa互作蛋白发现并验证了TMED10,并且二者定位于胞质。为了探索TMED10与circATG4B-222aa相互作用的区域,作者构建了一系列GFP标记的TMED10删除突变体。并通过Co-IP/WB实验验证,TMED10的TD和CD都是TMED10与circATG4B-222aa相互作用的必要条件。
通过与标记了circATG4B-222aa的截断突变体相互Co-IP分析,我们还确定了circATG4B-222aa与TMED10相互作用相关的区域。circATG4B-222aa (aa 1-111)和circATG4B-222aa (aa 112-222)都可以被TMED10拉下,表明无论是整段circATG4B-222aa还是前半段和后半段都可以与TMED10相互作用。但是在进一步的研究中,结果显示,只有全长的circATG4B-222aa可增加自噬过程。
由于circATG4B-222aa除了独特的氨基酸外,其大部分氨基酸序列与线性基因ATG4B相同,作者推测circATG4B-222aa可能通过结合TMED10,释放ATG4B。随后CO-IP结果发现,circATG4B-222aa过表达削弱了TMED10和ATG4B之间的相互作用,这表明circATG4B-222aa可结合TMED10,释放ATG4B。综上所述,这些发现表明circATG4B-222aa可能作为TMED10的诱饵,从而释放TMED10抑制的ATG4B。
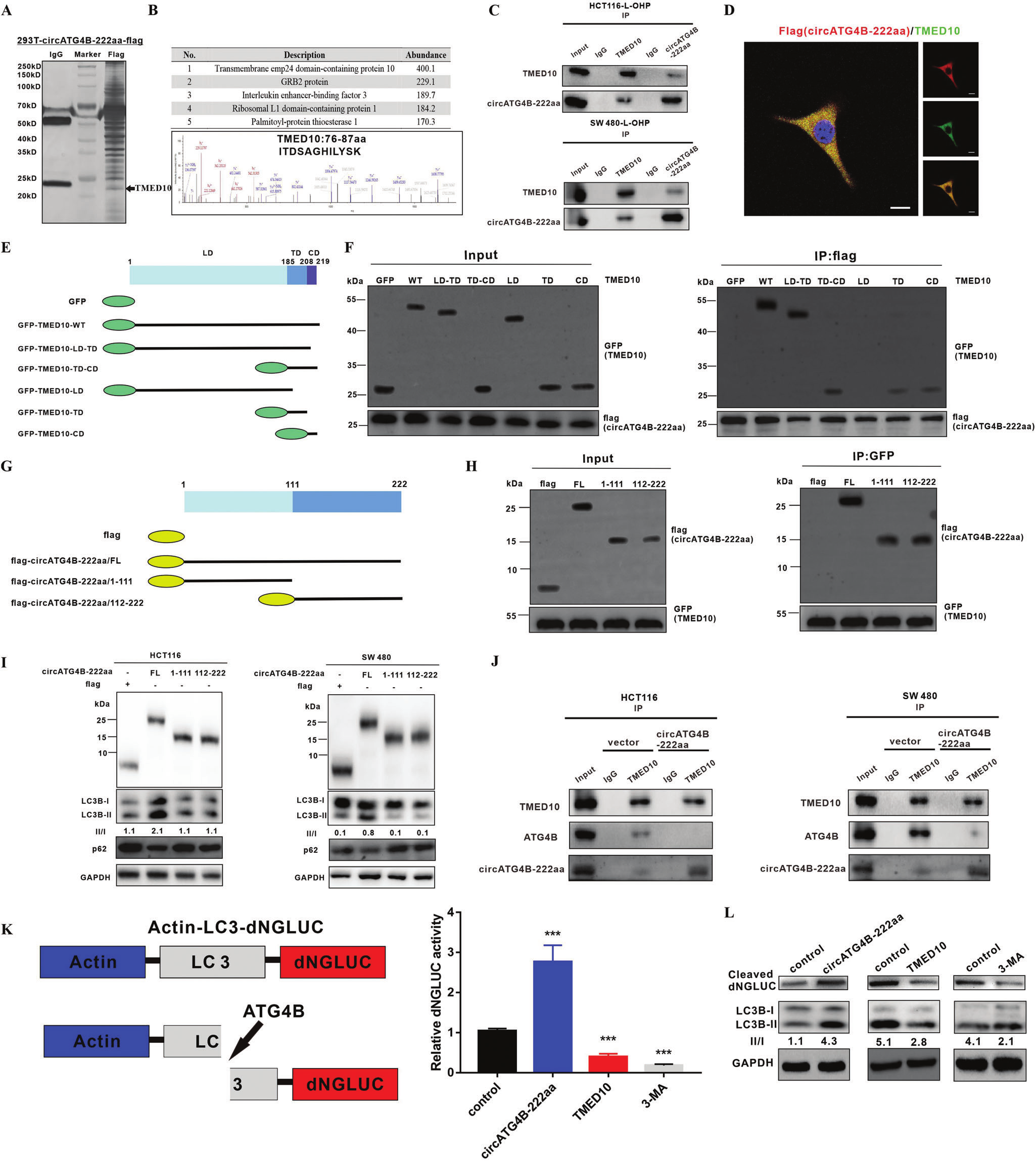 图6.circATG4B-222aa与TMED10蛋白互作,释放ATG4B
图6.circATG4B-222aa与TMED10蛋白互作,释放ATG4B
6.circATG4B-222aa逆转TMED10诱导的L-OHP耐药CRC细胞的化疗敏感性
随后,作者评估了circATG4B-222aa和TMED10之间的相互作用在L-OHP 耐药细胞中的作用。体外实验发现,circATG4B-222aa可逆转了TMED10在耐药CRC细胞中诱导的凋亡和化疗敏感性的增加;体内实验发现,在植入过表达TMED10的细胞组中,肿瘤生长和体重均显著下降,而过表达circATG4B-222aa则逆转了这种抑瘤作用。总之,这些结果表明circATG4B-222aa可以拮抗TMED10作用,诱导细胞L-OHP耐药。
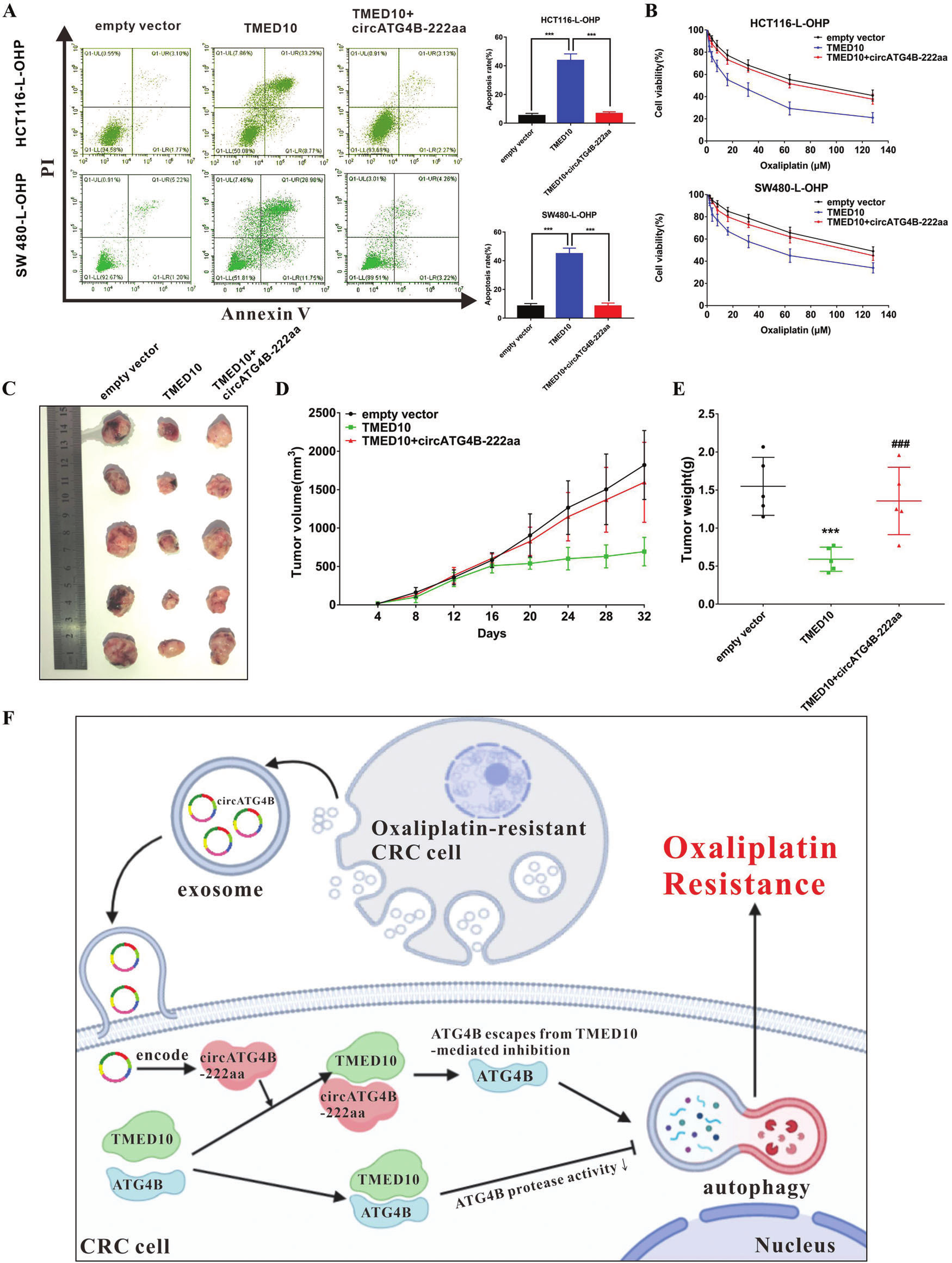
图7.circATG4B-222aa拮抗TMED10作用,诱导细胞L-OHP耐药
原文链接:
https://doi.org/10.1002/advs.202204513
参考文献:
H. Sung, J. Ferlay, R. L. Siegel, M. Laversanne, I. Soerjomataram, A.Jemal, F. Bray, CA Cancer J. Clin. 2021, 71, 209.
A. Agrotis, R. Ketteler, Cells 2020, 9, 53.
转载请联系邮箱授权:circRNA@163.com



 图3. 外泌体circATG4B促进细胞自噬
图3. 外泌体circATG4B促进细胞自噬

 图6.circATG4B-222aa与TMED10蛋白互作,释放ATG4B
图6.circATG4B-222aa与TMED10蛋白互作,释放ATG4B
.png)