结直肠癌(CRC)是排名第三的常见恶性肿瘤,也是癌症相关死亡的第二大原因[1]。CRC患者的预后较差,死亡率逐渐上升,高死亡率的主要原因是CRC的肝转移。20%的CRC患者在诊断时出现转移,约50%最终发展为肝转移。此外,肝转移患者的总体5年生存率仅为14%。最近关于CRC诊断和治疗靶点研究逐渐从蛋白质编码基因扩展到非编码RNA,如miRNA、反义转录物、lncRNA和circRNA。
环状RNA主要由反向剪接产生,其特征是共价闭环结构,没有5’帽和3’polyA尾。由于其特殊的结构,环状RNA对核酸外切酶具有更高的耐受性,使其非常稳定。环状RNA被证明是诊断和治疗癌症的有力工具。据报道几种环状RNA通过ceRNA机制或RBP机制影响CRC转移能力[2]。
2022年10月12号,成均馆大学医学院三星医学中心的Hyeon Ho Kim团队在Molecular Cancer发表文章Two circPPFIA1s negatively regulate liver metastasis of colon cancer via miR-155-5p/CDX1 and HuR/RAB36,研究结果表明:circPP-FIA1s对CRC的肝转移具有负调节作用。机制上,circPPFIA1-L和circPPFIA1-S作为miR-155-5p和HuR的海绵发挥作用。circPPFIA1通过靶向miR-155-5p上调肿瘤抑制基因CDX1,并通过隔离HuR来下调致癌基因RAB36。circPPFIA1作为一种癌转移抑制剂,是治疗CRC肝转移的一个有前景的治疗靶点。
研究思路
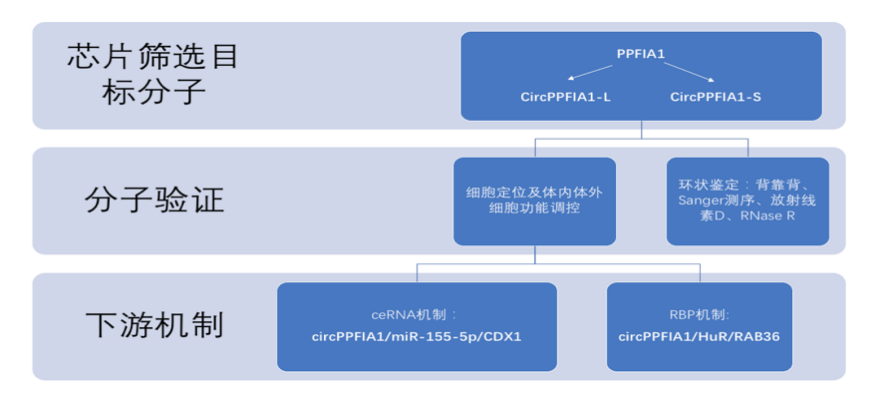
01、CircPPFIA1在肝转移性结直肠癌细胞下调
首先,作者分析CRC细胞(KM12C)和CRC肝转移细胞(KM12L4),实验证明KM12L4细胞比KM12C细胞具有更强的迁移和侵袭能力。两种细胞的circRNA芯片筛选出hsa_circRNA_100873(hsa_circ_0003429,本研究中作者命名为circPPFIA1-L),由PTPRF相互作用蛋白α1(PPFIA1)的17-21外显子组成;而作者又发现来自同一亲本基因PPFIA1的17-19外显子产生的另外一个circRNA,即hsa_circRNA_100872(hsa_circ_0000337,本研究中作者命名为circPPFIA1-S);两种circRNA的表达虽然在KM12C细胞中均有下降,但是circPPFIA1-L为最甚。
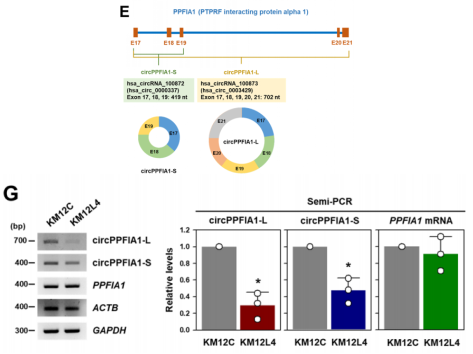
图1. circPPFIA1-L和-S形成及在结直肠癌中下调
02、circPPFIA1-L和-S是稳定的环状RNA
RNase R和放线菌素D验证circPPFIA1的稳定性,测序及背靠背实验验证其成环效果。细胞组分分离实验检测circPPFIA1-L和-S在胞质中大量表达。
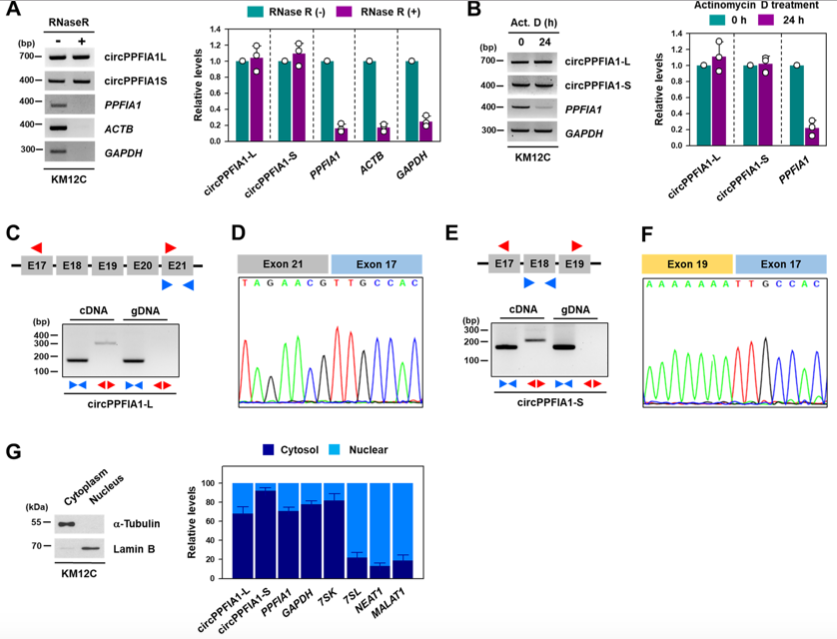 图2.circPPFIA1-L和-S的鉴定
图2.circPPFIA1-L和-S的鉴定
03、circPPFIA1s负调控结直肠癌的转移能力
过表达和敲低circPPFIA1-L与-S在体外细胞实验表示,circPPFIA1-L和-S对KM12C细胞迁移和侵袭具有负调控作用;体内小鼠模型证明circPPFIA1-L和-S对CRC中的肝转移亦有负调节作用。
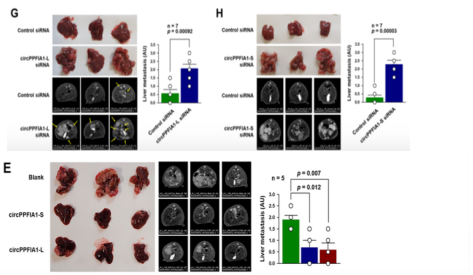
图3.过表达和敲低circPPFIA1s对CRC转移的影响
04、miR-155-5p是circPPFIA1s的海绵靶标
circPPFIA1-L和-S主要位于胞浆中,表明它们可能作为ceRNA发挥作用。作者在arraystar、circInteractome、Starbase、RNA22网站预测circPPFIA1相互作用的miRNA—miR-155-5p。ASO pulldown实验及荧光素酶报告基因实验验证miR-155-5p与circPPFIA1相互作用;但作者发现circPPFIA1-L、-S或两者的敲除并不影响miR-155-5p的水平,且过表达pre-miRNA,miR-155-5p不会影响circPPFIA1s的表达。结果表明,circPPFIA1s和miR-155-5p虽互相结合,但不影响彼此的表达。而进一步的研究发现,转移潜能的增加取决于miR-155-5p的表达水平,过表达miR-155-5p促进KM12C细胞迁移,抑制miR-155-5p表达则效果相反。敲低circPPFIA1增强KM12C细胞的迁移,而抑制miR-155-5p表达则逆转这一结果,表明circPPFIA1是通过miR-155-5p发挥功能。
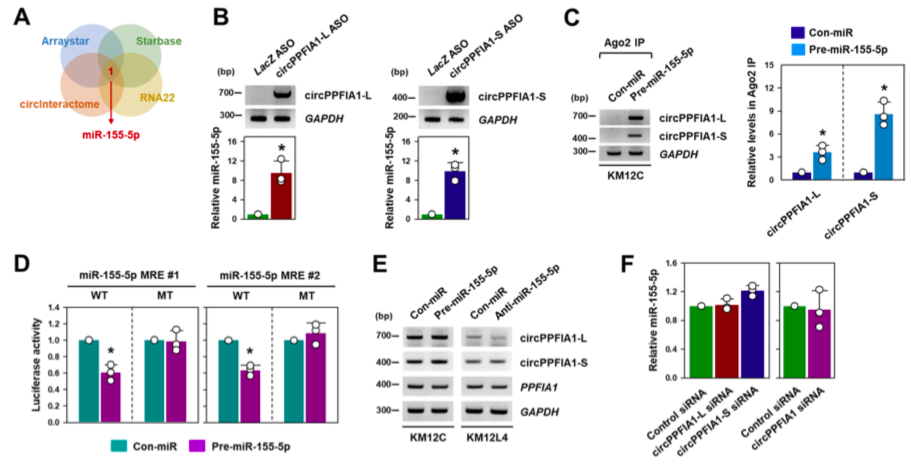
图4.miR-155-5p是circPPFIA1的海绵靶点
05、CDX1是circPPFIA1/miR-155-5p的功能靶点
作者预测肿瘤抑制剂CDX1可能是circPPFIA1/miR-155-5p的靶点。Western Blot和RT-qPCR实验检测CDX1在细胞及组织中的表达,证实CDX1是肿瘤抑制剂,并其表达分别受到circPPFIA1(促进)和miR-155-5p(抑制)影响。Ago2 RIP和荧光素酶实验验证CDX1和miR-155-5p之间的直接相互作用。
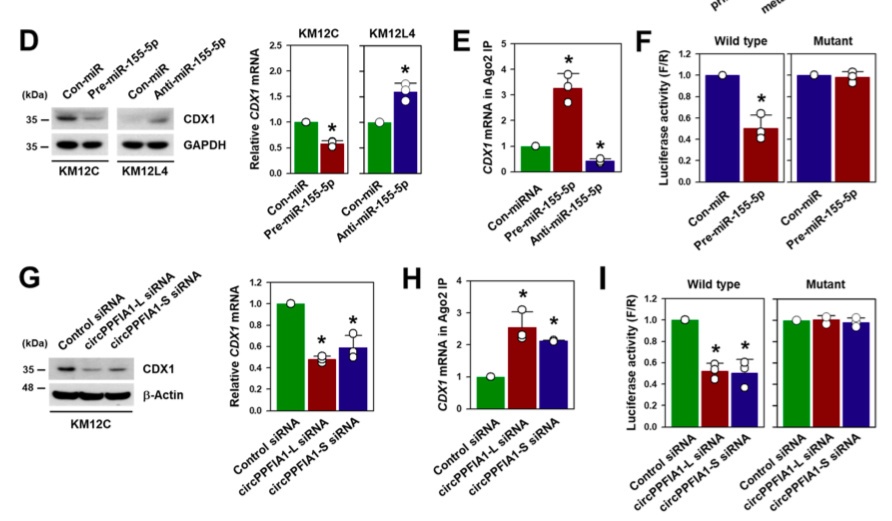 图5.CDX1是miR-155-5p的靶标
图5.CDX1是miR-155-5p的靶标
06、HuR是circPPFIA1s相互作用的RBP
CircInteractome、RBPDB、StarBase预测HuR可能是circPPFIA1相关的RBP。RBP map预测HuR和circPPFIA1的联系,ASO pull-down验证circPPFIA1和HuR之间的直接相互作用。接下来,作者通过实验发现HuR的表达和定位在两种细胞类型之间无差异,且表达水平不受circPPFIA1影响。于是作者假设circPPFIA1虽然不影响HuR自身的表达水平,但是干扰HuR介导的靶mRNA稳定或翻译。作者用Transwell试验证实HuR影响KM12L4细胞的侵袭和迁移能力。且敲低HuR可以逆转敲低circPPFIA1s增加的转移潜能。表明HuR对于敲低circPPFIA1导致的细胞转移能力增加是必需的。
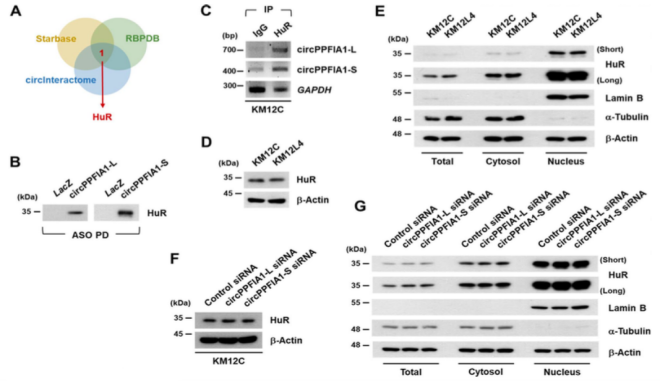
图6.HuR是circPPFIA1的海绵靶点
07、RAB36参与circPPFIA1s/HuR调控KM12L4细胞功能
作者通过HuR clip测序+三种条件下上调的基因序列进行比对发现,RAB36可作为HuR的靶基因,而HuR RIP实验、Wb和RT-qPCR也证实了这一点。RAB36在肝转移性结肠癌组织中高表达)。此外,敲低HuR下调RAB36蛋白和mRNA,表明RAB36是HuR的一个新靶点。敲低circPPFIA1-L和-S增加了RAB36蛋白和mRNA的表达水平。RIP实验表示,敲低circPPFIA1s可增强HuR与RAB36之间的相互作用,使HuR稳定了RAB36,过表达则相反。敲低circPPFIA1后的RAB36水平升高。敲低RAB36降低KM12L4细胞迁移和侵袭能力。综上提示,RAB36参与circPPFIA1s/HuR调控KM12L4细胞迁移和侵袭能力。
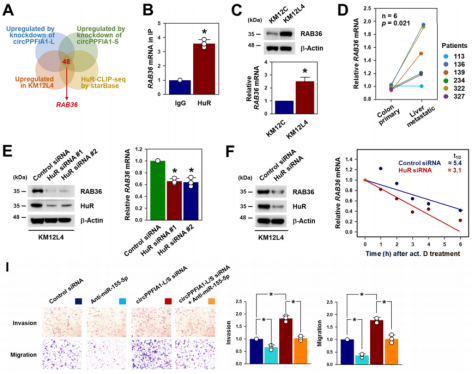
图7.CircPPFIA1通过隔离HuR负调控RAB36表达
综上所述,作者使用KM12C CRC细胞及其肝转移细胞KM12L4寻找与转移相关的circRNAs,发现circPPFIA1,通过体内和体外实验,发现circPPFIA1s对大肠癌的肝转移具有负调节作用。从机制上来说,circPPFIA1-L和-S通过充当miR-155-5p的海绵或与HuR结合发挥作用。circPPFIA1s通过靶向miR-155-5p上调肿瘤抑制基因CDX1,并通过隔离HuR来下调致癌基因RAB36。作者团队发现circPPFIA1作为一种转移抑制剂,是治疗结直肠癌肝转移的一个有前景的治疗靶点。
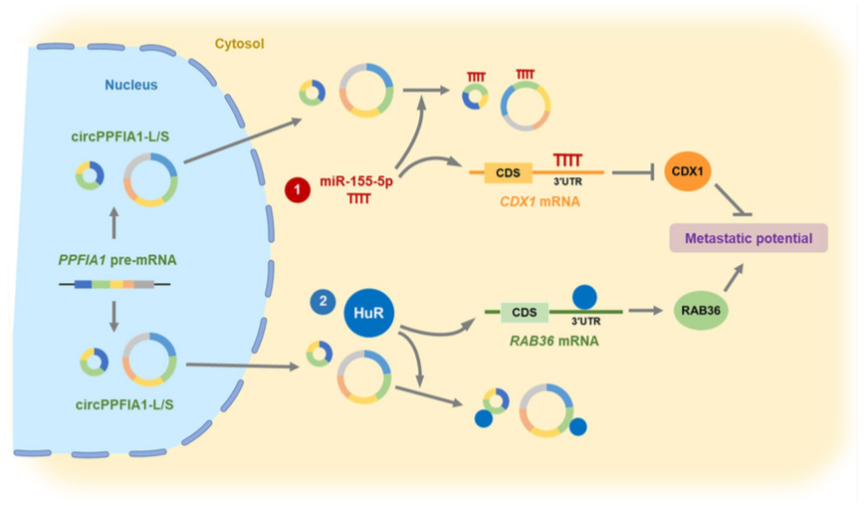
circPPFIA1在结直肠癌转移潜能中的分子机制
原文链接:
https://doi.org/10.1186/s12943-022-01667-w
参考文献:
[1] Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394–424.
[2] Hansen TB, Jensen TI, Clausen BH, Bramsen JB, Finsen B, Damgaard CK, et al. Natural RNA circles function as efficient microRNA sponges. Nature. 2013;495(7441):384–8.
转载请联系邮箱授权:circRNA@163.com
.png)