环状RNA(circRNAs)是一种新型的调控RNA,具有高度进化保守性和稳定性。circRNA有望成为各种恶性肿瘤的潜在诊断生物标志物和治疗靶点。然而,circRNAs在TNBC中的调控功能和潜在机制在很大程度上是未知的。
一、circRNA CREIT在TNBC中表达下调,并增强DOX敏感性
GO和GSEA分析表明,circRNA-CREIT可能与调节细胞对各种环境压力的反应密切相关,尤其是化学诱导的压力。DOX是TNBC治疗中的化疗药物,circRNA-CREIT在耐DOX的乳腺癌组织和TNBC细胞中下调,其过表达可提高TNBC细胞对DOX的敏感性,敲低则结果相反;作者又构建肿瘤异种移植模型和类器官(PDO)模型,在体内验证了这一结果。
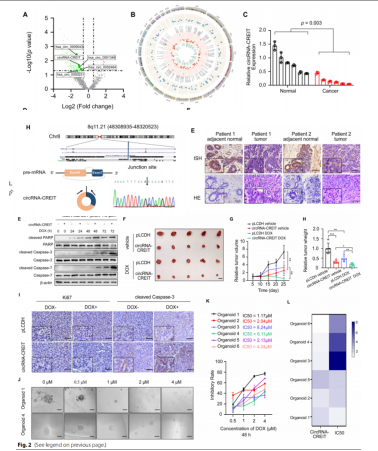
图1. circRNA CREIT在TNBC中表达下调,并增强DOX敏感性
二、circRNA-CREIT的机制探索
随后作者发现过表达circRNA-CREIT抑制PKR蛋白的表达,而敲低circRNA-CREIT则相反。环己酰亚胺(CHX)处理显示,与circRNA-CREIT过表达相比,敲低可增加PKR蛋白的半衰期。提示circRNA-CREIT在PKR降解中起着重要作用。CO-IP结果显示,circRNA-CREIT过表达显著上调PKR的泛素化;并且,circRNA-CREIT过表达增强PKR的K48连接而非K63连接多泛素(K48连接的多泛素通常诱导底物蛋白降解,K63连接的多泛素与蛋白质稳定或活化相关)。上述提示,circRNA-CREIT通过K48连接的泛素-蛋白酶体途径介导PKR降解。
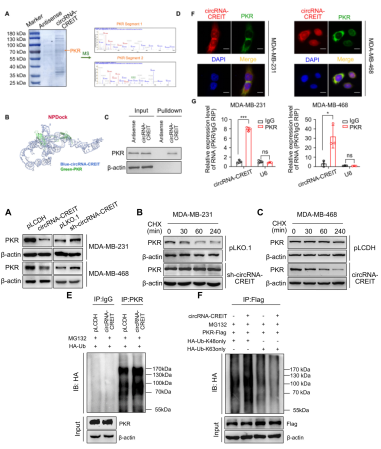
图2. circRNA-CREIT1通过K48连接的多泛素化增强PKR的降解
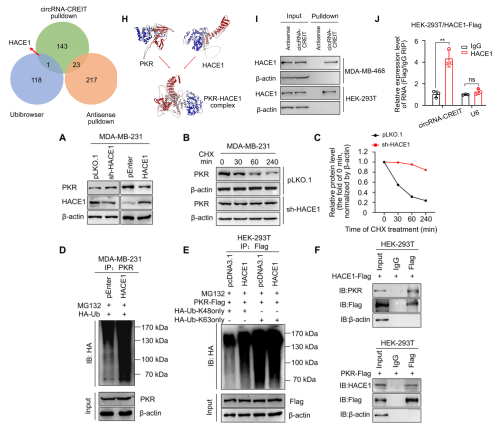 图3. circRNA-CREIT介导HACE1-PKR相互作用
图3. circRNA-CREIT介导HACE1-PKR相互作用
三、circRNA-CREIT的应用
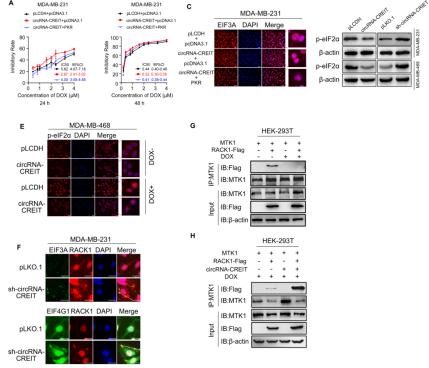
图4. circRNA-CREIT通过PKR/eIF2α轴减弱了SG的形成
小分子ISRIB可逆转eIF2α磷酸化,触发SG分解[5]。作者发现,circRNA-CREIT过表达和ISRIB可发挥协同作用,进一步提高TNBC的药物敏感性。并且,ISRIB可逆转circRNA-CREIT敲低引起的化学耐药性。作者单独使用阿霉素或ISRIB治疗肿瘤模型小鼠可以抑制体内肿瘤生长,而阿霉素和ISRIB的联合使用对抑制肿瘤生长具有协同作用。这提示,ISRIB可与化疗联合用于降低耐药性,治疗TNBC。
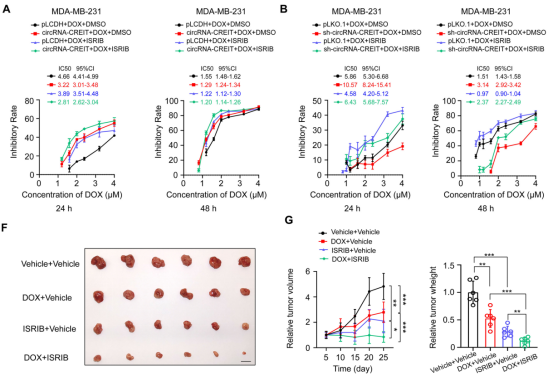 图5. circRNA-CREIT与靶向SGs的ISRIB协同作用
图5. circRNA-CREIT与靶向SGs的ISRIB协同作用
circRNA可以被包装到外泌体,将耐药性传递给其他细胞[6]。作者分离出circRNA-CREIT外泌体处理细胞发现,circRNA-CREIT外泌体抑制细胞增殖、提高阿霉素敏感性、下调eIF2α的磷酸化水平并弱化SG形成。接下来,作者通过体内小鼠模型实验验证circRNA-CREIT外泌体可降低移植瘤的生长速度。上述数据提示,circRNA-CREIT外泌体可作为治疗TNBC的有效策略。
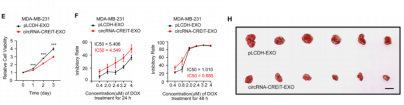
图6. circRNA-CREIT通过外泌体传递在TNBC中发挥抑瘤作用
https://doi.org/10.1186/s13045-022-01345-w
参考文献:
[1] Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA 2021;71(3):209–49.
[2] Hu X, Zhang Z. Understanding the genetic mechanisms of cancer drug resistance using genomic approaches. Trends Genet. 2016; 32(2):127–37
[3] Shen S, Yang Y, Shen P, Ma J, Fang B, Wang Q, et al. circPDE4B prevents articular cartilage degeneration and promotes repair by acting as a scafold for RIC8A and MID1. Ann Rheum Dis. 2021;80(9):1209–19.
[4] Chen HY, Lin LT, Wang ML, Tsai KL, Huang PI, Yang YP, et al. Musashi-1 promotes chemoresistant granule formation by PKR/eIF2α signaling cascade in refractory glioblastoma. Biochimica et biophysica acta Molecular basis of disease. 2018;1864(5 Pt A):1850–61.
[5] Sidrauski C, McGeachy AM, Ingolia NT, Walter P. The small molecule ISRIB reverses the efects of eIF2α phosphorylation on translation and stress granule assembly. eLife. 2015;4
[6] Xu J, Ji L, Liang Y, Wan Z, Zheng W, Song X, et al. CircRNA-SORE mediates sorafenib resistance in hepatocellular carcinoma by stabilizing YBX1. Signal Transduct Target Ther. 2020;5(1):298.
转载请联系邮箱授权:circRNA@163.com
.png)
