2022年6月30日,南京医科大学附属无锡市人民医院占强教授在Molecular Cancer发表文章circEZH2/miR-133b/IGF2BP2 aggravates colorectal cancer progression via enhancing the stability of mA-modified CREB1 mRNA。研究结果表明:circEZH2与m6A阅读器IGF2BP2相互作用并阻止其泛素化依赖性降解。同时,circEZH2可以作为miR-133b的海绵,导致IGF2BP2的上调。特别是,circEZH2/IGF2BP2增强了CREB1mRNA的稳定性,从而加重了CRC的进展。

首先,从6对CRC和邻近正常组织中分离出总RNA(去核糖体RNA)进行了RNA-seq分析,结果显示人类染色体上已识别和表达的circRNA的染色体大约90.33%是从外显子区域产生。相对于正常组织,CRC组织中有32个circRNA上调,39个下调。作者在这些候选上调的circRNA中,直接选择研究circEZH2(hsa_circ_0006357)。通过针对Junction位点设计引物PCR和Sanger测序验证其环状结构,使用RNaseR消化以及放线菌素D(一种转录抑制剂)验证其稳定性,荧光原位杂交(FISH)检测circEZH2定位于细胞质。随后分别在CRC患者肿瘤组织上和细胞系(CRC细胞系和正常结肠细胞系)水平上来检测circEZH2的表达水平。结果显示:CRC患者肿瘤组织中的circEZH2水平显著高于相邻正常组织中的水平。而细胞系水平上,CRC细胞系中circEZH2的表达水平显著高于正常结肠细胞系,并且在HCT116和SW620表达量最高,随后作者选择它们用于进一步的功能评估。
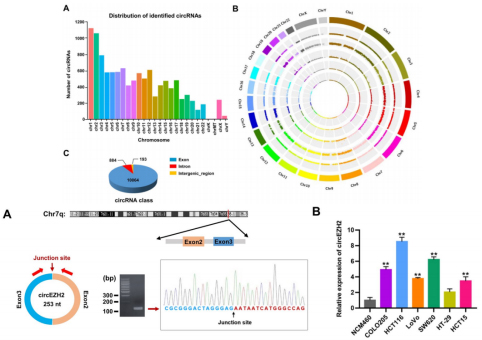
图1.circEZH2的筛选和稳定表达验证
体外实验:circEZH2的shRNA显著降低两种细胞系中circEZH2的表达水平,但对线性EZH2没有影响。细胞功能上看,circEZH2敲低显著抑制了两种细胞系的增殖和迁移能力。体内实验:通过尾静脉注射建立的转移动物模型用于评估体内CRC细胞的转移。结果显示,circEZH2低表达显著抑制了体内小鼠肺部转移灶的形成。随后,作者又使用CRC小鼠模型(偶氮甲烷/葡聚糖硫酸钠〔AOM/DSS〕诱导59天)研究circEZH2是否参与CRC发病机制。在诱导前一周,在小鼠结肠中使用腺病毒(AAV9)包装circEZH2。结果显示,circEZH2包装小鼠的肿瘤比对照组小鼠明显更多和更大,结肠长度也增加。提示circEZH2在体内促进了结直肠肿瘤的发生、生长和转移。
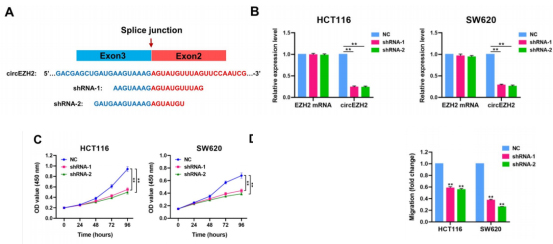
图2-1.体外实验结果
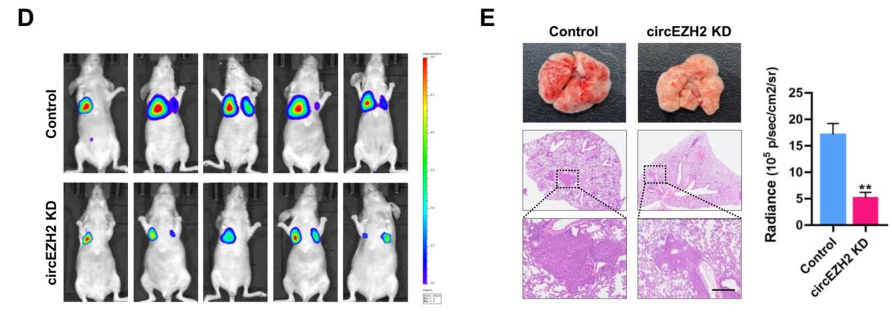 图2-2.体内实验结果
图2-2.体内实验结果
由于circRNA已被证明可作为竞争性内源性RNA与调节性miRNA相互作用并在转录后水平控制miRNA的表达。作者直接在结直肠癌和癌旁组织中进行测序分析,筛选出140个差异表达的miRNA。同时,作者预测出有四种miRNA(miR-1265、miR-554、miR-556-5p和miRNA-133b)可能是circEZH2的互作伙伴。然后经过数据库预测和miRNA-seq双重分析,最终miR-133b被鉴定可作circEZH2的潜在“伴侣”。RNA免疫沉淀(RIP)和荧光素酶报告基因分析是证明互作的实验标准。RIP结果显示,circEZH2仅和上述四种miRNA中的miR-133b存在结合;同时,检测circEZH2与miR-378b(CRC生成相关的miRNA)的互作结果无效。而荧光素酶报告基因检测circEZH2和miR-133b互作的结果与RIP结果一致。FISH分析也显示circEZH2和miR-133b共定位于HCT116细胞的细胞质中。有趣的是,circEZH2对miR-133b的表达有抑制作用。circEZH2敲低上调miR-133b的表达,而circEZH2过表达效果与之相反。而circEZH2敲低或过表达对上述四种miRNA的表达无作用。这提示,circEZH2在CRC细胞中起到miR-133b海绵的作用,其表达同circEZH2在CRC组织中呈负相关。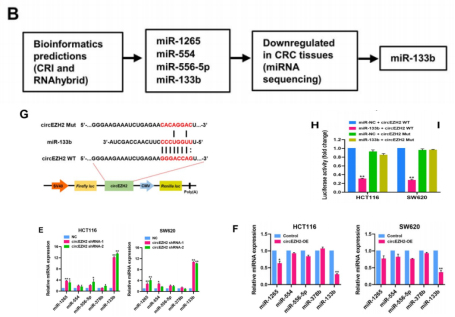
图3.circEZH2发挥miR-133b分子海绵作用
1.1 circEZH2作为miR-133b海绵影响CRC进展
作者在CRC细胞上建立了稳定的过表达miR-133b。细胞功能实验结果显示过表达miR-133b抑制细胞增殖和迁移能力。随后作者在circEZH2过表达体系中引入过表达miR-133b可消除circEZH2对肿瘤生成的促进作用。这提示,circEZH2可作为miR-133b的分子海绵来影响CRC的进程。
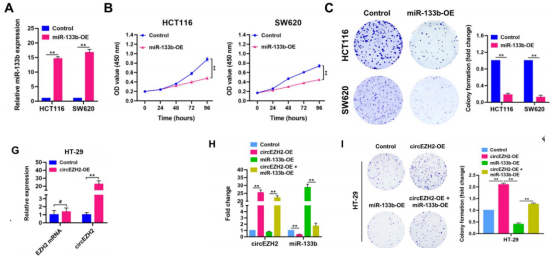
图4.circEZH2发挥miR-133b分子海绵作用影响CRC进程
2. CircEZH2与m6A阅读器IGF2BP2相互作用并阻止其泛素化依赖性降解
作者使用circRNA pulldown(利用circRNA钓取蛋白质),随后进行质谱分析,发现与circEZH2相互作用的候选蛋白中,IGF2BP2(胰岛素样生长因子)由于是新发现的N6-甲基腺苷(m6A)“阅读器”被关注。作者又通过RIP实验(利用蛋白钓取circRNA)反向证明circEZH2和IGF2BP2之间存在分子互作。
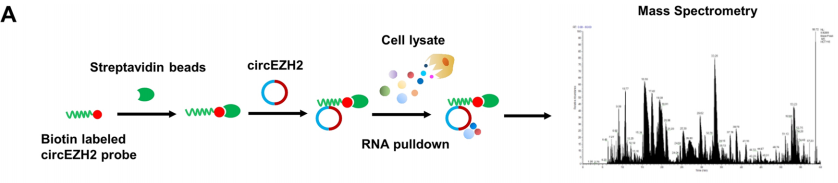
图5.circEZH2和IGF2BP2之间存在互作
circEZH2敲低显著降低了IGF2BP2的蛋白质水平,但对其mRNA水平没有太大影响。因此,推测circEZH2可能直接与IGF2BP2蛋白互作。而值得注意的是,circEZH2敲低促进了HCT116细胞中IGF2BP2的泛素化水平,而circEZH2过表达小鼠肿瘤中的IGF2BP2显示高表达。这提示,circEZH2可通过降低IGF2BP2泛素化水平来促进IGF2BP2蛋白高表达。巧合的是,生信分析显示IGF2BP2是miR-133b的下游靶标。双荧光素酶结果显示二者存在结合。并且IGF2BP2过表达可逆转miR-133b过表达抑制CRC细胞增殖和迁移的效果。综上,m6A阅读器—IGF2BP2是miR-133b的下游靶标,并与CircEZH2产生互作。
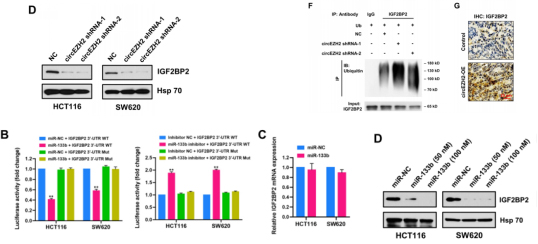
图6.IGF2BP2与CircEZH2相互作用,并且是miR-133b的下游靶标
2.1 circEZH2通过调节CREB1表达来促进CRC进程
为了发现CRC中潜在的m6A修饰谱,作者分析了(MeRIP)-seq数据集,结果显示m6A修饰主要发生在CRC组织中3′-UTR和CDS的连接区域,并且在CREB1 mRNA中检测存在显著的m6A修饰位点,修饰基序为GCAAC。circEZH2敲低下调CREB1 mRNA和蛋白的表达,并且CREB1 mRNA可被IGF2BP2抗体沉淀。此外,IGF2BP2敲低或miR-133b过表达亦可下调CREB1 mRNA水平。在CRC和癌旁组织以及小鼠注射实验均和上述结果一致。这提示,circEZH2/IGF2BP2增强CRC中CREB1mRNA的稳定性。随后作者建立了对照、circEZH2敲低和circEZH2敲低+CREB1过表达处理CRC细胞系。结果显示,CREB1过表达显著逆转了circEZH2敲低对CRC细胞增殖和迁移的抑制效果。证明circEZH2通过调节CREB1表达来促进CRC进程。
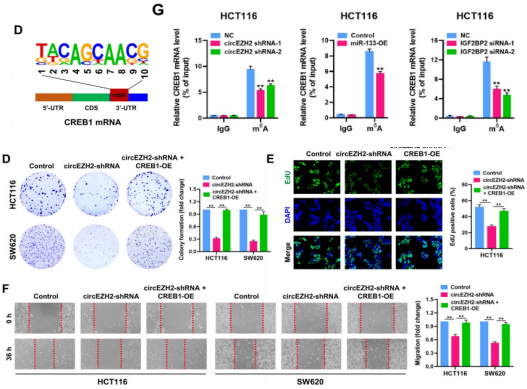
图7.circEZH2通过调节CREB1表达来促进CRC进程
综上所述:circEZH2在CRC进展中可充当癌基因。CircEZH2与m6A阅读器—IGF2BP2互作并阻断其泛素化依赖性降解,从而促进CRC中CREB1 mRNA的稳定性。本文扩展了对CRC发病机制中circRNA的作用,并建立了circEZH2/miR-133b/IGF2BP2/CREB1轴为CRC的诊断和治疗提供了一个新的靶点。
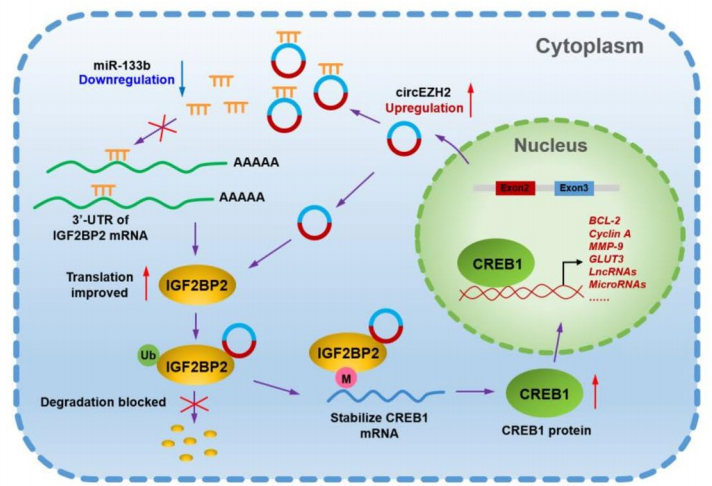
图8.结构化摘要图
原文链接:
https://doi.org/10.1186/s12943-022-01608-7
参考文献:
[1] Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65(2):87–108.
[2] Shang A, Gu C, Wang W, Wang X, Sun J, Zeng B, et al. Exosomal circ-PACRGL promotes progression of colorectal cancer via the miR-142-3p/miR-506-3p- TGF-beta1 axis. Mol Cancer. 2020;19(1):117.
转载请联系邮箱授权:circRNA@163.com



 图2-2.体内实验结果
图2-2.体内实验结果





.png)