
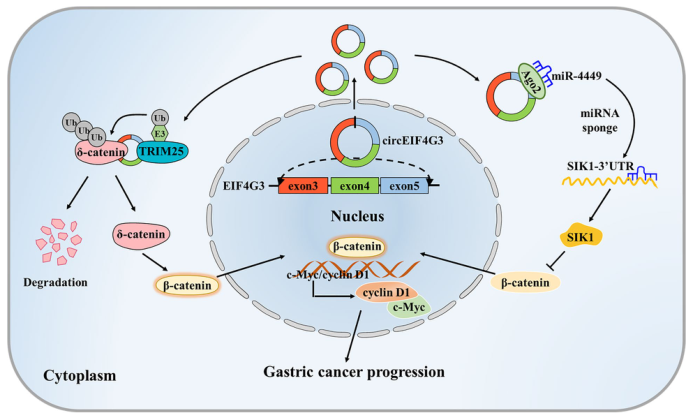
图1. circEIF4G3在胃癌中的作用机制模型
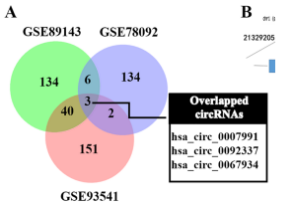
图2. 胃癌细胞中差异表达的circRNA
作者通过构建circEIF4G3敲低与过表达的细胞模型,同时通过体外功能实验和体内功能研究探讨了circRNA在胃癌细胞中的生物学作用,结果表明circEIF4G3在胃癌中发挥肿瘤抑制作用(图3)。
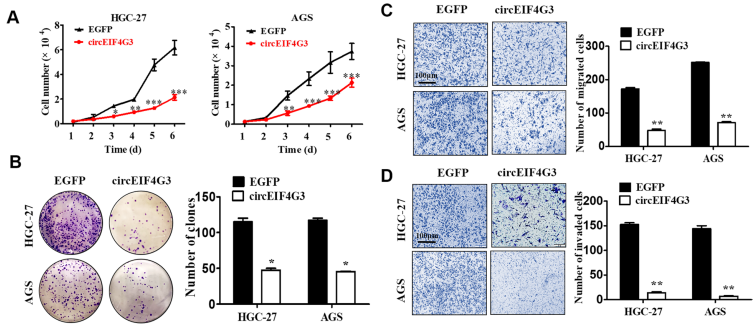
图3. circEIF4G3过表达减弱胃癌细胞生长和转移
为进一步探索其机制,作者进行了TRAP(Tagged RNA affinity purification,是一种检测与RNA结合的蛋白质的检测方法)、质谱和RIP分析潜在的circEIF4G3相互作用蛋白(图4),结果表明circEIF4G3通过与δ-catenin相互作用来调节β-catenin信号,并进一步通过蛋白酶体抑制剂MG132和β-catenin途径激活剂LiCl实验,探索circEIF4G3对δ-catenin降解的影响,结果表明circEIF4G3通过增强泛素依赖性降解来调节δ-catenin的稳定性。
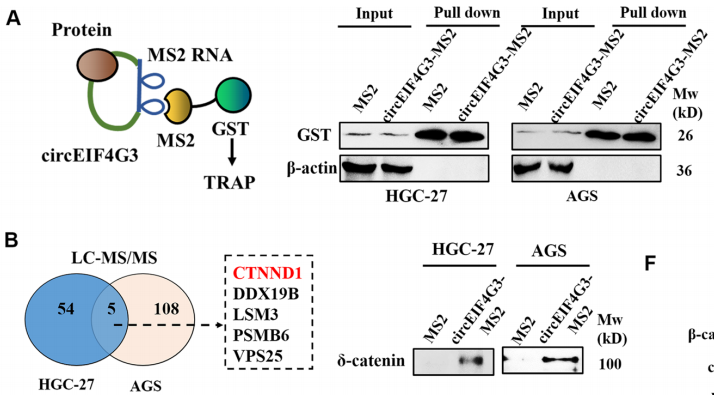
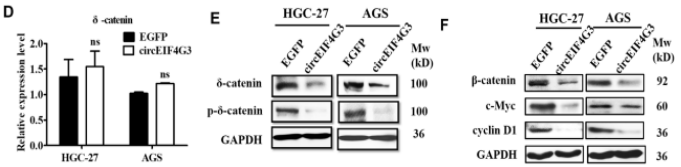
图4.circEIF4G3与δ-catenin相互作用使β-catenin信号失活
TRAP分析中筛选由circEIF4G3共沉淀的蛋白质,以寻找用于δ-catenin泛素化的潜在的E3连接酶,共免疫沉淀发现TRIM25与δ-catenin结合。通过免疫荧光发现circEIF4G3、TRIM25和δ-catenin共同定位于胃癌细胞的细胞质中(图5)。在TRIM25过表达的胃癌细胞中δ-catenin泛素化增加,表明TRIM25作为泛素E3连接酶在胃癌细胞中发挥作用,用于circEIF4G3调节的δ-catenin泛素化和降解。
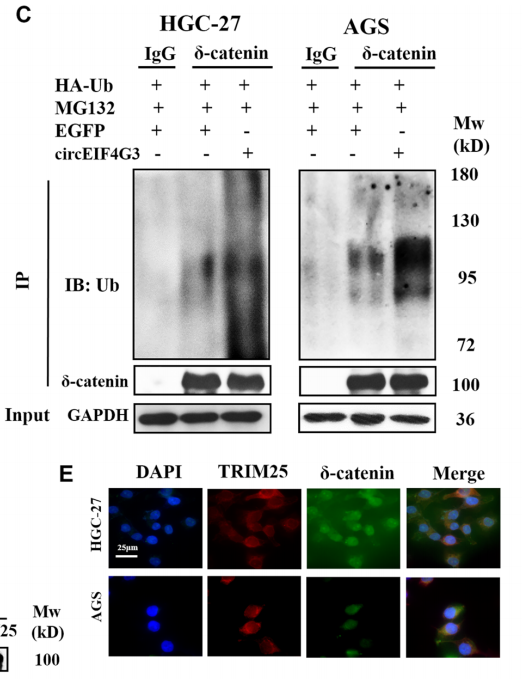
图5. δ-catenin和TRIM25蛋白在胃癌细胞中的IP与共定位
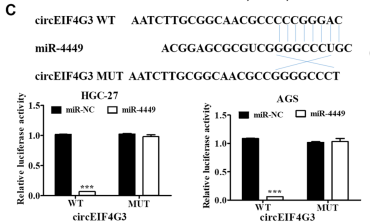
图6. 荧光素酶报告实验揭示miR-4449与circEIF4G3的结合
对受circEIF4G3调控的miR-4449的靶基因盐诱导激酶(SIK1)进行研究,双荧光素酶报告实验表明SIK1是miR-4449的直接靶点(图7),肿瘤和临近非肿瘤组织中SIK1基因的表达分析表明,circEIF4G3过表达可显著抑制胃癌细胞的增殖、迁移和侵袭,这种抑制作用可以通过同时敲除SIK1而逆转。结果证明circEIF4G3调节miR-4449/SIK1轴以使胃癌中的β-catenin信号失活。
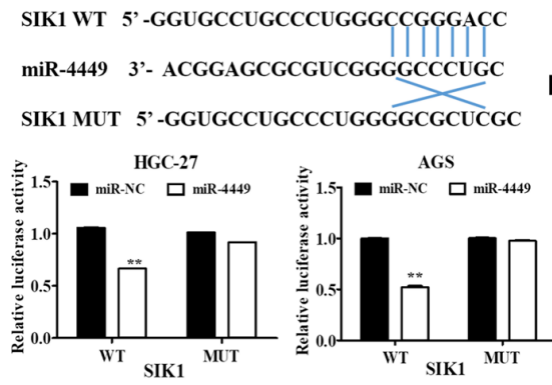
图7. 荧光素酶报告实验揭示SIK1是miR-4449的直接靶点
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-022-01606-9
参考文献:
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7–30
2. Sexton RE, Al Hallak MN, Diab M, Azmi AS. Gastric cancer: a comprehensive review of current and future treatment strategies. Cancer Metastasis Rev. 2020;39(4):1179–203.
3. Russo AE, Strong VE. Gastric cancer etiology and management in Asia and the West. Annu Rev Med. 2019;70:353–67.
转载请联系邮箱授权:circRNA@163.com
.png)