
卵巢癌是最常见的恶性肿瘤之一,在女性癌症总死亡率中排名第五,女性生殖系统癌症的发病率和死亡率居第二位。卵巢癌的早期症状不明显,并且明显缺乏可靠的早期诊断生物标志物,导致大多数患者被确诊时已发展为卵巢癌晚期。与其他类型的肿瘤不同,卵巢癌容易在盆腔和腹腔广泛转移。因此,识别卵巢癌的早期诊断和治疗生物标志物的开发具有重要的临床意义。
环状RNA是一种新发现的非编码RNA,在真核生物体内广泛且丰富表达,具有高度的稳定性和保守性。研究发现,环状RNA是一类重要的新生物标记物,对疾病诊断、预后和治疗具有重要的临床意义。

首先,作者分析了27个卵巢癌患者肿瘤组织和26个正常卵巢组织的RNA测序结果,发现circFBXO7是显著性下调的环状RNA分子,而其亲本基因FBXO7在卵巢肿瘤和正常卵巢组织之间缺乏任何显著差异表达。在12个独立卵巢癌组织样本和12个正常卵巢组织样本中验证了circFBXO7的下调。
作者分别使用高表达(SKOV3和OV90)和低表达(A2780和MDAH2774)circFBXO7的卵巢癌细胞,进行干扰和过表达(circRNA慢病毒过表达载体plO5)处理。体外功能实验发现,circFBXO7可以抑制卵巢癌细胞的增殖、迁移和侵袭。作者构建了过表达circFBXO7的裸鼠成瘤模型,circFBXO7过表达组的肿瘤体积和重量明显小于对照组。综上所述,circFBXO7在体外和体内卵巢癌中发挥肿瘤抑制作用。
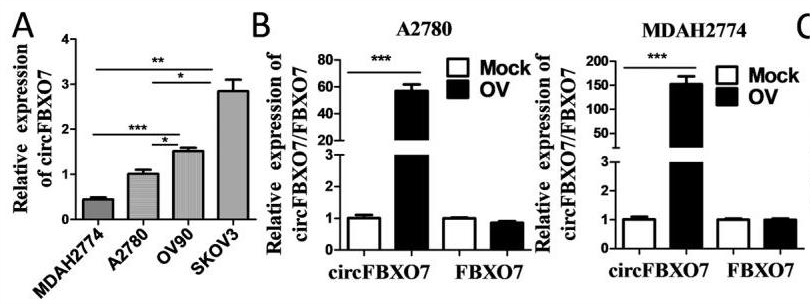
circFBXO7过表达效果(不影响FBXO7表达)
随后,机制探索发现Ago2 RIP实验中,circFBXO7在IP组富集,circFBXO7结合Ago2蛋白,circFBXO7可能作为卵巢癌细胞中miRNA的分子海绵发挥作用。生物信息学分析发现,circFBXO7与miR-96-5p可能存在相互结合,并通过双荧素酶报告基因实验和细胞功能挽救实验验证了二者的相互结合关系。进一步使用三个生物信息学数据库(miRTarBase、TargetScan和miRDB)预测miR-96-5p的潜在靶点,三个数据库统一预测了17个基因作为miR-96-5p的潜在靶点,其中MTSS1的表达变化在卵巢癌细胞中验证结果与circFBXO7变化一致。circFBXO7可以作为miR-96-5p的ceRNA来调节MTSS1的表达。
已有研究发现,MTSS1在乳腺癌和慢性髓系白血病中被认为是肿瘤抑制因子,但在黑色素瘤和肝细胞癌中观察到MTSS1高表达[1,2]。作者发现,MTSS1在卵巢癌细胞中参与EMT,作为促癌基因发挥作用。circFBXO7通过海绵结合miR-96-5p来调节MTSS1,从而抑制卵巢癌细胞的增殖和迁移。
RNA测序结果显示,circFBXO7的下游信号转导主要富集在Wnt信号通路,参与肿瘤起始、肿瘤生长、细胞衰老、细胞死亡、分化和转移。Wnt信号通路需要β-catenin入核,进而与转录因子TCF/LEF结合形成复合物,共同起始下游调控基因的转录。通过设计TCF/LEF的DNA结合和突变位点,构建TOP-Flash和FOP-Flash荧光素酶报告基因载体。结果发现,circFBXO7的过度表达抑制了Wnt/β-catenin信号的激活,而MTSS1的敲除可以激活两种细胞系中的Wnt/β-catenin信号通路(如图1)。
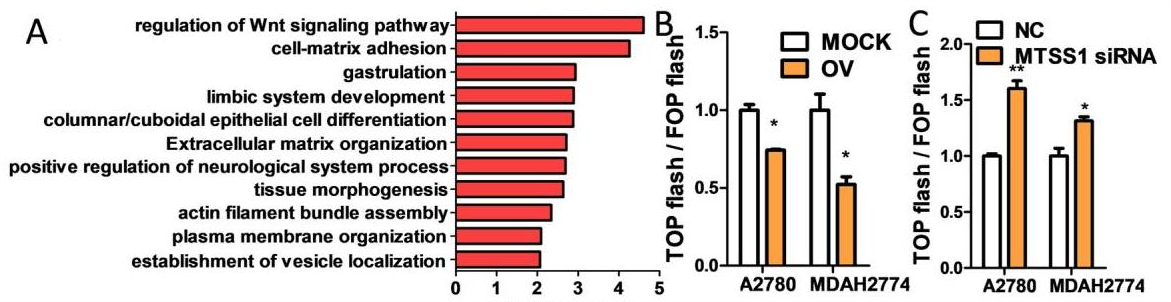
图1. circFBXO7调节卵巢癌中Wnt/β-catenin信号通路
综上所述,circFBXO7在卵巢癌中下调,circFBXO7表达较低的患者预后较差。circFBXO7的下调释放其海绵状miR-96-5p,然后诱导MTSS1的降解。circFBXO7/miR-96-5p/MTSS1轴是Wnt信号通路中的一个重要调节因子,以该轴为靶点可能是卵巢癌治疗的一种有希望的策略。
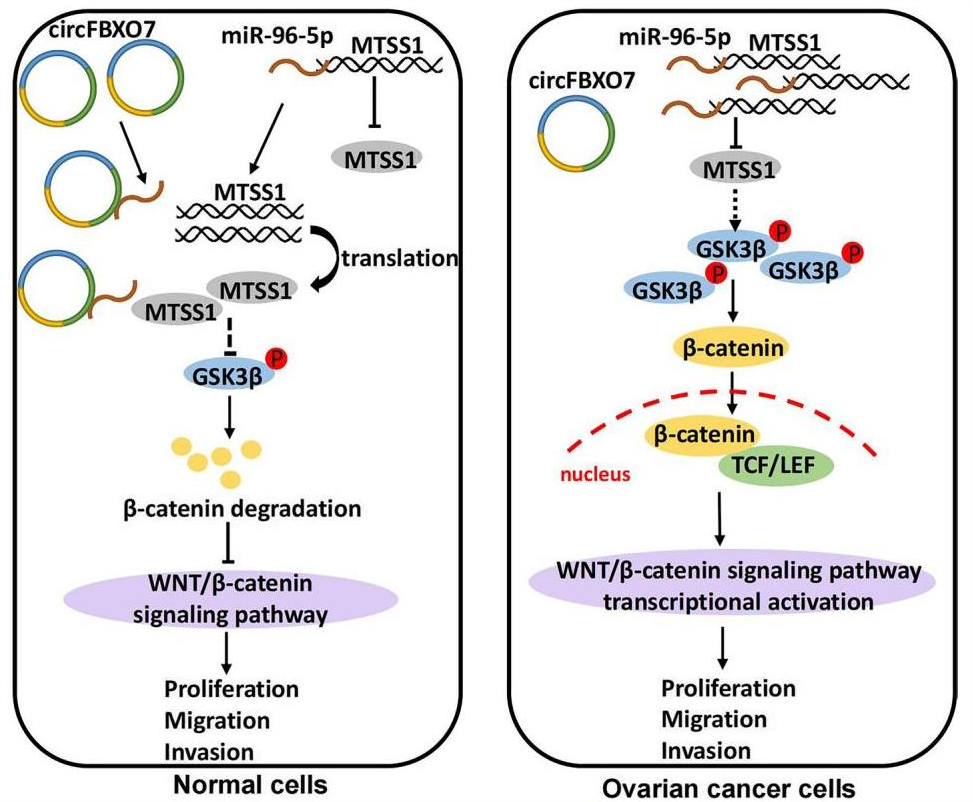
circFBXO7在卵巢癌中的潜在分子机制
.png)