2020年6月29日,南京医科大学第一附属医院的束永前教授在Molecular Cancer(IF=15.302)杂志上发表了一篇题为“Exosomal circSHKBP1 promotes gastric cancer progression via regulating the miR-582-3p/HUR/VEGF axis and suppressing HSP90 degradation”的文章,阐述胃癌中高表达的circSHKBP1可以被外泌体递送,通过海绵吸附miR-582-3p和结合HSP90从而起到促癌作用。此外,它的表达与TNM分期和预后不良相关,还可以作为胃癌的诊断分子和预后分子([1])。

环状RNA(circRNA)在多种癌症的发生发展中起着重要的调控作用,但其在胃癌(GC)中的生物学功能和潜在的分子机制还尚不清楚。本篇文章中,作者表明circSHKBP1在GC患者的肿瘤和血清外泌体中过表达,并与晚期病理分期和较低的生存率相关。circSHKBP1通过调节miR-582-3p / HUR / VEGF途径和抑制HSP90降解,来促进体内外的胃癌进程。这项研究也为探索GC的发病机理提供了新的见解。
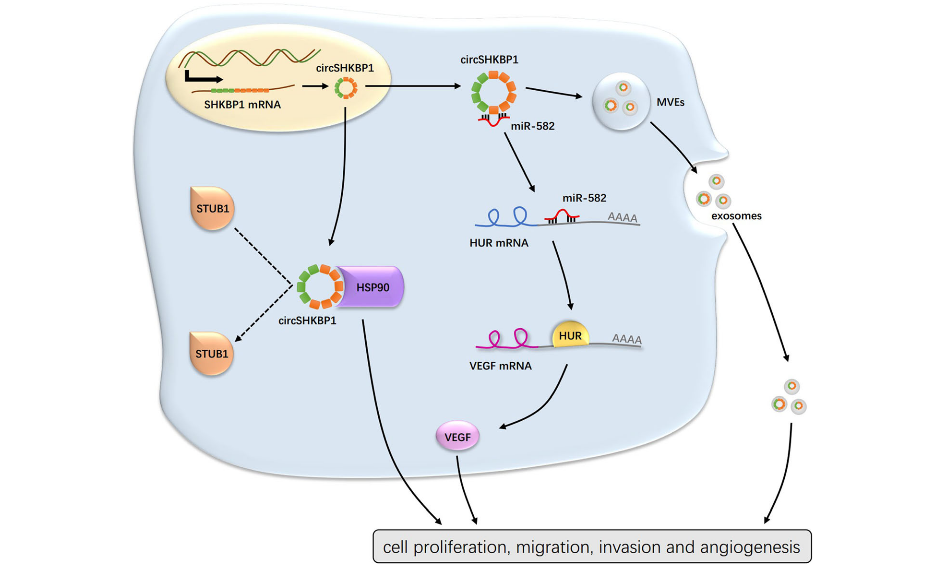
图1 circSHKBP1调控胃癌进展的作用示意图
1、通过RNA-seq鉴定GC中差异表达的circRNA
首先使用CIRI将RNA-seq数据定位到来源于UCSC基因组数据库的人类参考基因组(GRCh37 / hg19)。每个样品的归一化强度(log2转换)被用作circRNA丰度的绝对度量。作者对8例GC组织和8例匹配相邻正常组织的一个混合样本进行RNA-seq。在癌组织和正常组织中共鉴定出119种差异表达的circRNA(FC≥4和P<0.05),与正常组织相比,5种circRNA在GC组织中表达上调,114种circRNA表达下调。随后,作者通过qRT-PCR进一步验证前5个上调和下调的circRNA在10对GC组织和正常组织中的表达差异,结果表明circSHKBP1是GC中差异表达最显著的circRNA。
2、circSHKBP1特征及其在GC中的表达情况
circSHKBP1衍生自人体组织中广泛表达的蛋白编码基因座SHKBP1。circSHKBP1首次发现于2013年,它在许多内皮细胞中高度富集。circSHKBP1是由SHKBP1基因外显子11和12两侧的内含子(含多个Alu元件)反向剪接生成。为了证明circSHKBP1是环状RNA,作者设计并合成跨环化位点的发散引物来扩增circSHKBP1,反转录产物使用Sanger测序进行验证。RNaseR实验表明,与SHKBP1 mRNA相比,circSHKBP1具有较低的降解率,且半衰期超过24小时,这表明circSHKBP1以高度稳定的环状形式存在。
然后,作者分析了72对GC组织和正常组织中circSHKBP1的表达差异。qRT-PCR表明,circSHKBP1在53个GC组织中均上调,且circSHKBP1在GC组织中的表达平均比正常组织高2.31倍(P <0.05)。此外,作者对来自GC患者的152对癌组织和正常组织进行ISH分析。结果表明,GC组织的circSHKBP1丰度远高于正常组织,并且circSHKBP1的表达与晚期TNM分期、血管浸润和预后不良相关。
为了确定是否可以在血清外泌体中检测到circSHKBP1,作者收集了20对GC患者和健康对照的血液样本。通过TEM和蛋白生物标志物的western blot分析来鉴定血清中的外泌体。正如预期那样,胃癌患者血清外泌体来源的circSHKBP1比健康对照组更丰富。血清外泌体中circSHKBP1水平约为GC患者肿瘤组织中circSHKBP1水平的6倍,这使从血液样本中检测circSHKBP1的表达成为可能。作者还研究了胃切除手术前后血清外泌体的circSHKBP1水平,发现切除肿瘤后外泌体circSHKBP1水平急剧下降,这表明GC组织是外泌体circSHKBP1的来源。
这些结果表明,circSHKBP1是一种来源于胃癌组织的上调的circRNA,可以被外泌体有效地输送到循环系统中。此外,circSHKBP1的高表达与晚期TNM分期和GC预后不良相关,使其具有作为GC潜在生物标志物的潜力。
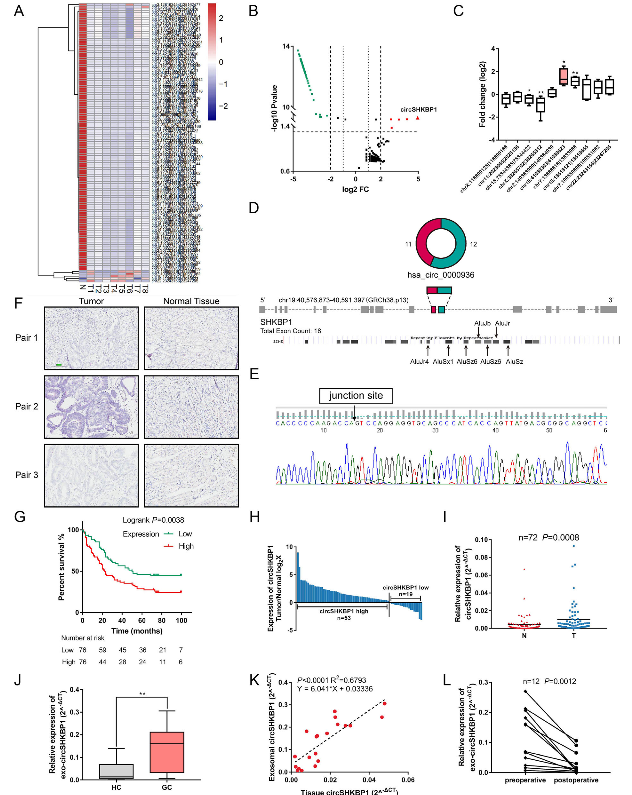
图2 circSHKBP1可以作为GC的生物标记物
3、circSHKBP1促进体外GC细胞的增殖、迁移和侵袭
为了探索circSHKBP1是否影响GC细胞的生物学过程,作者首先分析了circSHKBP1在4种人胃癌细胞系(BGC823、HGC27、AGS和MGC803)和正常胃上皮细胞系GES1中的表达水平。结果表明,与GES1细胞相比,circSHKBP1在4个GC细胞系中均高表达,尤其是BGC823和HGC27。此外,作者还鉴定了来自BGC823细胞培养基的外泌体circSHKBP1水平。与GES1细胞相比,外泌体circSHKBP1在GC细胞系中也存在过表达。然而,SHKBP1线性mRNA的表达水平在各细胞系之间并没有显着差异。因此,作者使用BGC823和HGC27细胞进行以下实验。
作者设计并合成靶向circSHKBP1反向剪接序列的siRNA来敲低circSHKBP1。此外,作者使用pcDNA3.1-CMV-circRNA载体构建一个circSHKBP1过表达质粒。过表达/敲低效率使用qRT-PCR证实,且均不影响SHKBP1线性mRNA的水平。CCK8、EdU和Transwell分析显示,过表达/敲低circSHKBP1会显着提高/抑制GC细胞的增殖、迁移和侵袭。
转染circSHKBP1质粒后,qRT-PCR分析显示,exo-circSHKBP1水平的变化与细胞circSHKBP1的过表达水平相一致。用NTA检测外泌体总量,结果表明外泌体的释放量略有增加。但是,考虑到外泌体circSHKBP1的显著过表达,作者将外泌体circSHKBP1的增加归因于更多的circSHKBP1被加载到外泌体中,而不是释放了更多的外泌体。作者从circSHKBP1质粒转染BGC823和HGC27细胞的培养基中提取外泌体,并将不同浓度的外泌体与未经处理的GC细胞共培养。如预期的那样,外泌体circSHKBP1的过表达也影响GC细胞的增殖、迁移和侵袭,并促进恶性细胞表型。
这些结果表明,过表达circSHKBP1促进GC细胞的生长和转移,而敲低circSHKBP1则会抑制GC细胞发育。更重要的是,随着circSHKBP1在GC细胞中的异位表达,更多的circSHKBP1被加载到外泌体中,从而干扰邻近或远处GC细胞的生物学功能。
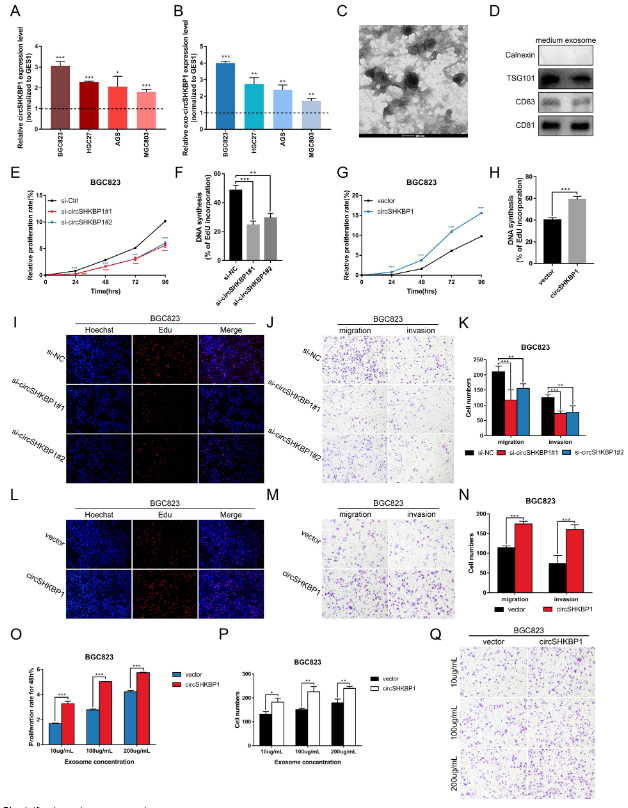
图3 circSHKBP1促进体外GC细胞的增殖、迁移和侵袭
4、circSHKBP1作为miR-582-3p的海绵分子
为了研究circSHKBP1在GC细胞中的作用机制,作者首先要确定其在细胞内的定位。FISH与胞核和胞质RNA的qRT-PCR分析表明,circSHKBP1优先定位于GC细胞胞质。鉴于circRNA海绵吸附miRNA的作用已被广泛研究,且circSHKBP1在胞质中含量丰富,作者接下来探索circSHKBP1是否通过作为miRNA的海绵分子来发挥生物学功能。对BGC823细胞中的AGO2进行RIP,结果显示内源性circSHKBP1特异性地富集于AGO2,表明circSHKBP1具有充当miRNA海绵分子的潜力。作者使用CircInteractome预测可以与circSHKBP1结合的潜在miRNA分子(miR-582-3p、miR-665、miR-1207和miR-4458)。下一步检测这些miRNA分子在过表达circSHKBP1的GC细胞中的表达水平,发现只有miR-582-3p和miR-665被下调。为了验证miR-582-3p / miR-665和circSHKBP1之间的直接相互作用,作者实行双萤光素酶报告基因实验,证实仅仅miR-582-3p可以直接与circSHKBP1互作。生物素标记的RNA pull down实验也得到了相同的结果。此外,FISH分析证实circSHKBP1和miR-582-3p共定位于胞质中,表明它们之间存在互作。qRT-PCR显示,GC肿瘤组织中miR-582-3p的表达水平低于配对正常组织,miR-582-3p和circSHKBP1的表达呈负相关。这些实验结果表明,circSHKBP1可以充当miR-582-3p的海绵分子并降低miR-582-3p的表达。
为了探索miR-582-3p的生物学作用,以及circSHKBP1是否可以影响miR-582-3p的功能,作者将miR-582-3p模拟物单独转染或与circSHKBP1质粒一起转染到GC细胞中。CCK8和Transwell分析表明,miR-582-3p模拟物会抑制GC细胞的增殖、迁移和侵袭,而过表达circSHKBP1则消除了它对GC细胞生长的抑制作用,这表明circSHKBP1是通过海绵吸附miR-582-3p来发挥的促癌作用。
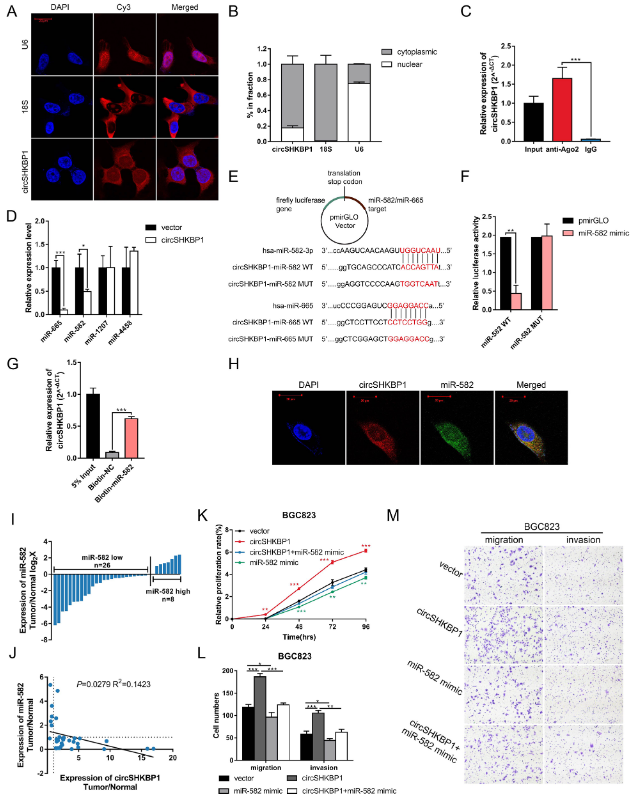
图4 circSHKBP1作为miR-582-3p的海绵分子
5、circSHKBP1通过上调HUR来促进VEGF的翻译
通过分析临床数据,作者发现circSHKBP1高表达组的血管浸润率显著高于circSHKBP1低表达组。之后,使用生信分析网站(TargetScan、TargetMiner和miRDB),作者找到了54个miR-582-3p的候选下游靶标,其中HUR和EIF2S1有被报道作为VEGF信号通路的一部分。VEGF是促进内皮细胞增殖的重要因素之一,因此作者下一步对HUR和EIF2S1进行深入研究。TCGA数据库显示,HUR和EIF2S1在GC中高表达。GC的生存分析表明,高表达HUR的GC患者伴随着较短的OS,而EIF2S1的高表达组和低表达组在生存时间上并没有显著差异。western blot分析显示,过表达circSHKBP1会促进HUR和VEGF的表达,而对EIF2S1水平无明显影响。此外,miR-582-3p模拟物可以降低BGC823细胞中HUR和VEGF的表达。相似地,在敲低circSHKBP1下调HUR和VEGF的基础上,导入miR-582-3p抑制剂可以恢复HUR和VEGF的表达水平。HUR是VEGF信号通路中的一个重要元件,通过与VEGF mRNA的ARE结合,从而稳定其mRNA结构并促进VEGF翻译。HUR的RIP实验证实,它可以与VEGF mRNA和miR-582-3p直接结合。来自TCGA数据库的数据表明,HUR表达与miR-582表达呈负相关。作者同时还检测了胃癌组织中HUR mRNA的表达水平,发现HUR表达与miR-582-3p表达呈负相关,与circSHKBP1表达呈正相关。作者使用不同浓度的VEGF抗体来处理过表达circSHKBP1的GC细胞,以确定circSHKBP1是否通过VEGF加速肿瘤进展。western blot分析表明,随着VEGF抗体浓度的增加,VEGF的水平逐渐降低。VEGF抗体以浓度依赖性方式抑制GC细胞的增殖和迁移,过表达circSHKBP1细胞的抑制率比对照组高得多。成管实验进一步证实,circSHKBP1可以促进VEGF的分泌并诱导血管生成,这可以被VEGF抗体所阻断。这些实验结果表明,circSHKBP1通过海绵吸附miR-582-3p,减少了其对HUR mRNA的降解,使HUR表达上调并促进VEGF翻译,从而对胃癌的发展起到促进作用。
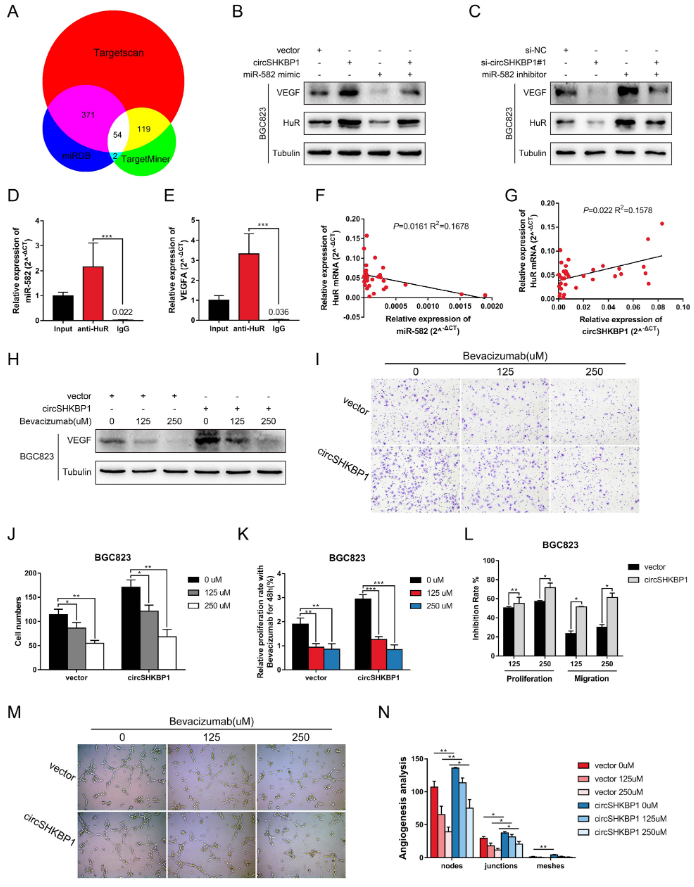
图5 circSHKBP1通过上调HUR来促进VEGF翻译
6、circSHKBP1直接结合HSP90并抑制其降解
作者设计了一种特异性生物素标记的circSHKBP1探针,用于HGC27细胞的RNA pull down实验。银染色结果显示,相比于对照组,有几个蛋白条带在过表达circSHKBP1的GC细胞中富集。接下来,使用蛋白质谱分析来鉴定差异表达的蛋白。在鉴定的蛋白排名表中,排名前2位的分别是HSP90β和HSP90α,它们均为HSP90的异构体。RIP分析显示,与IgG相比,抗HSP90抗体下拉出更丰富的circSHKBP1,证实了circSHKBP1与HSP90的直接相互作用。TCGA分析表明HSP90在GC中表达上调。作者使用qRT-PCR和ELISA分别检测HSP90的mRNA和蛋白水平,结果显示,与正常组织相比,GC肿瘤组织中的HSP90 mRNA和蛋白均上调。鉴于这是circRNA与蛋白之间的相互作用,作者分析了HSP90蛋白表达与circSHKBP1表达之间的关系,发现它们之间呈正相关。Western blot表明过表达circSHKBP1使HSP90的总表达量略有增加。然而,在使用CHX抑制蛋白合成后,当过表达circSHKBP1时,HSP90的降解受到明显抑制。已证明E3泛素连接酶STUB1可以泛素化HSP90,从而将HSP90靶向蛋白酶体进行降解。因此,作者使用蛋白酶体抑制剂MG132来阻断HSP90的泛素化。在MG132处理后,HSP90的降解速度确实被减慢。为了解释circSHKBP1保护HSP90免受降解的机制,作者提出circSHKBP1和STUB1竞争性结合HSP90的假说。IP分析表明,过表达circSHKBP1可以降低STUB1与HSP90的结合,验证了这个假设。此外,HSP90的选择性抑制剂NMS-E973在体外削弱了circSHKBP1的促癌作用。这些结果表明,circSHKBP1可以直接与HSP90结合,并抑制STUB1对HSP90的泛素化,从而促进胃癌的发生发展。
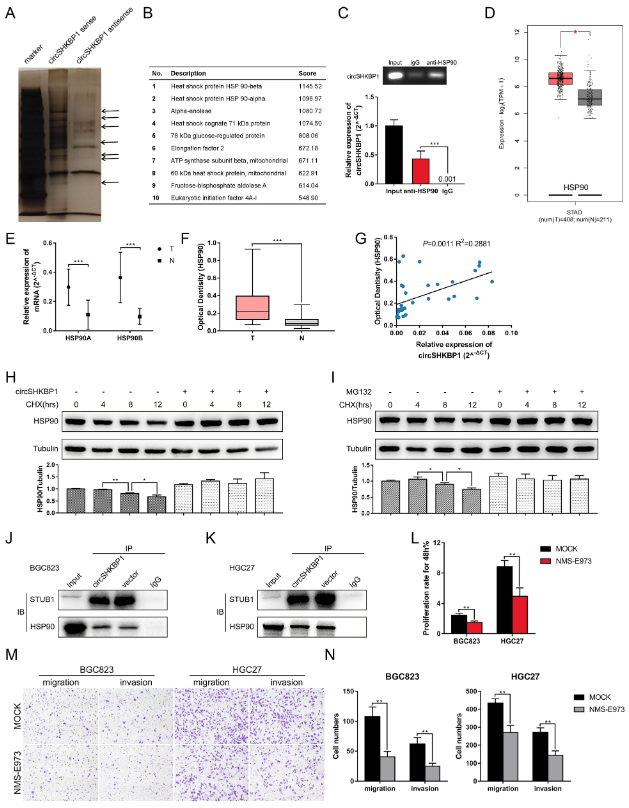
图6 circSHKBP1直接结合HSP90并抑制其降解
7、circSHKBP1调节体内GC的生长
作者构建慢病毒载体来过表达/沉默BGC823细胞的circSHKBP1。将转导LV3-sh1、LV3-sh2和LV3-NC的细胞皮下接种到裸鼠的右腿内,并对这些小鼠的肿瘤生长进行24天的密切监测。研究结果表明,就肿瘤体积和肿瘤重量/体重比而言,源自LV3-sh1细胞的肿瘤明显小于源自LV3-NC细胞的肿瘤,表明敲低circSHKBP1会抑制肿瘤生长。另外,作者将转导LV5-circSHKBP1和LV5-NC的细胞皮下接种到裸鼠的右腿内,并对每组中一半数量的小鼠每周给予两次VEGF抗体。密切监测21天后,发现源自LV5-circSHKBP1细胞的肿瘤比源自LV5-NC细胞的肿瘤具有更大的尺寸和更重的重量。此外,VEGF抗体显着抑制肿瘤生长。通过对小鼠血清和肿瘤中蛋白质的western blot分析,发现与对照组比,LV3-sh1和LV3-sh2组的HUR和VEGF水平均降低,而LV5-circSHKBP1组的水平升高。GC组织中,HUR和VEGF的IHC也显示出相似的结果。接下来,作者从血清外泌体和肿瘤中提取总RNA,通过qRT-PCR研究circSHKBP1的表达。结果表明,外泌体circSHKBP1线性依赖于癌组织circSHKBP1的表达,且它的平均丰度为癌组织的61,713倍,这证实了circSHKBP1可通过外泌体递送到远端部位,并在循环系统中检测到,其在血液中的丰度使其可能成为一种很有潜力的GC生物标志物。作者还检测肿瘤组织中miR-582-3p的水平,发现它与circSHKBP1的水平呈负相关。此外,肿瘤中CD31的IF实验显示,LV5-circSHKBP1组的荧光面积明显大于对照组,表明其血管生成活跃,而VEGF抗体可以消除circSHKBP1诱导的血管生成。
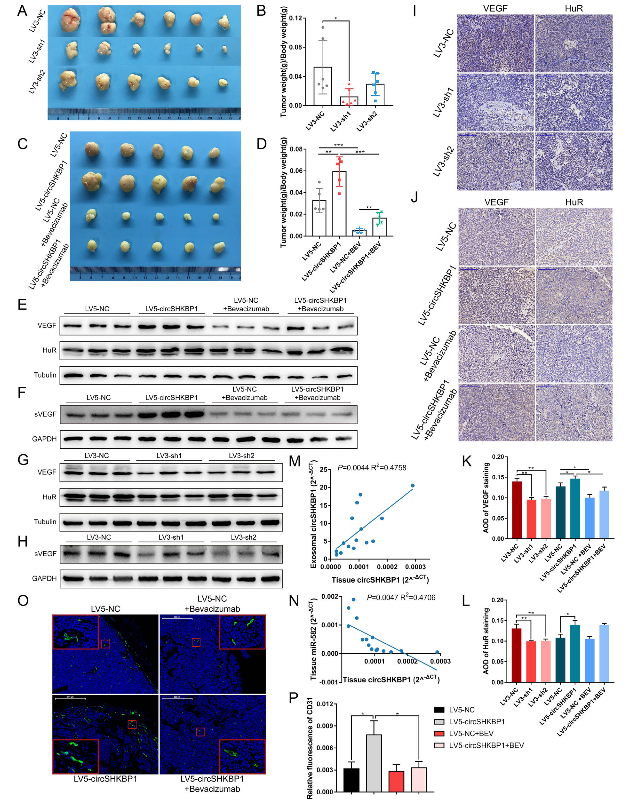
图7 circSHKBP1调节体内GC的生长
8、circSHKBP1调控体内GC的转移
为了探索circSHKBP1对体内胃癌转移的影响,作者首先将荧光素质粒稳定转染到上述5个细胞系,然后通过尾静脉将这些细胞注入裸鼠体内。LV5-circSHKBP1和LV5-NC组中的一半的小鼠每周接受两次VEGF抗体处理。接种3周后,小鼠每周进行体内生物发光成像来检测肺转移,连续4周。结果表明,敲低SHKBP1可显著减少肺转移灶的数目和大小。此外,ISH显示,敲低circSHKBP1会导致GC肺转移灶中的HUR和VEGF染色明显减少。生物发光成像和HE染色表明,过表达circSHKBP1可以加重肺转移病变和增加HUR和VEGF染色。而VEGF抗体可以抑制circSHKBP1诱导的癌细胞转移。
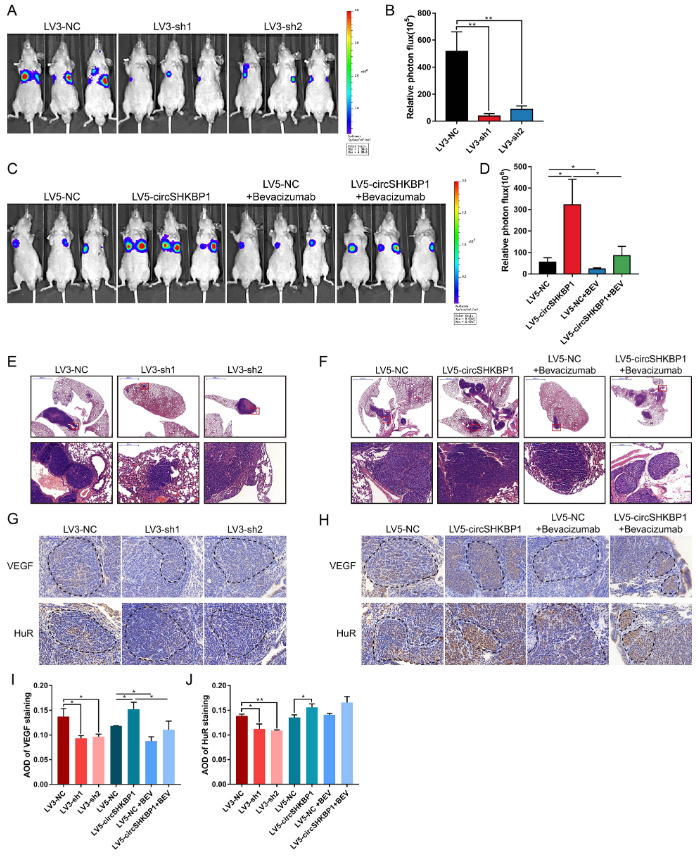
图8 circSHKBP1促进体内GC转移
参考文献:[1] Xie M, Yu T, Jing X, et al. Exosomal circSHKBP1 promotes gastric cancer progression via regulating the miR-582-3p/HUR/VEGF axis and suppressing HSP90 degradation. Mol Cancer. 2020;19(1):112. Published 2020 Jun 29. doi:10.1186/s12943-020-01208-3
.png)