
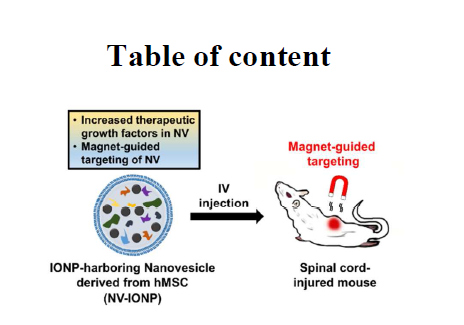
近年来,在无细胞再生医学领域,人间充质干细胞(hMSC)来源的外泌体可作为理想的治疗药物。但是器官靶向性差和治疗效果差是未来临床应用的关键问题。来自韩国国立首尔大学的Byung-Soo Kim教授的研究团队最近在Nano Letters杂志(IF=12.08)上在线发表了题为“Therapeutic Efficacy-potentiated and Diseased Organ-targeting Nanovesicles Derived from Mesenchymal Stem Cells for Spinal Cord Injury Treatment”的研究。研究人员利用氧化铁纳米颗粒(IONP)处理hMSCs后,可制造含有IONP的类似外泌体的纳米囊泡(NV-IONP),用于评估这种NV-IONP对于脊髓损伤(SCI)的治疗效果。相比于不含有IONP的NV,NV-IONP不仅包含用于磁铁导向的IONP,还携带着大量的治疗性生长因子到靶细胞。NV-IONP由于携带着的IONP在内体或者溶酶体的酸性条件下会被慢慢电离成铁离子,继而活化hMSCs中的JNK和c-jun信号通路,促进治疗生长因子的表达。体内回输NV-IONP的同时给予磁铁导向至脊髓,NV-IONP可以显著在损伤的脊髓聚集,增强血管形成、减轻局部炎症和减少损伤脊髓的细胞凋亡,从而改善损伤脊髓的功能。该研究进一步证明了经改造后的仿生NV-IONP对于治疗SCI具有增强的治疗效果和靶向器官效应,为修复损伤脊髓提供治疗新的备选药物。
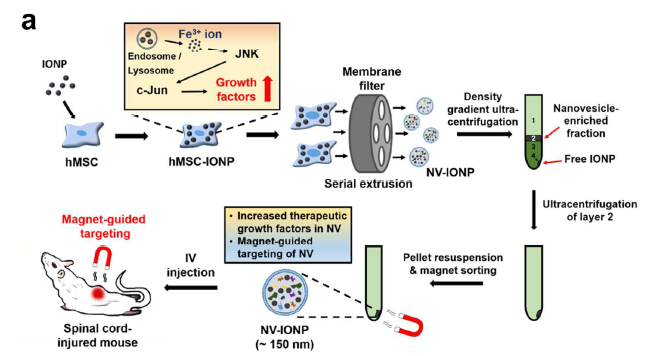
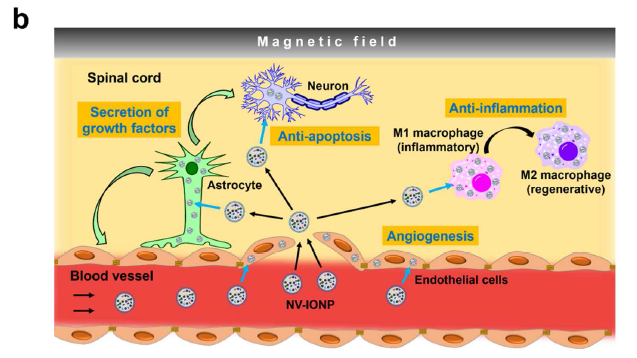
氧化铁纳米颗粒IONP进入体内可以被离子化和同化吸收,并且已被FDA批准临床使用,可被外部磁场导向,从而作为NV-IONP的导航工具。IONP处理hMSCs后成为hMSC-IONP,IONP进入细胞内的内体和溶酶体后被离子化,活化JNK、c-jun通路,导致胞内的生长因子表达上调,再对hMSC-IONP细胞挤压后膜过滤,经密度梯度离心获得第二层的纳米囊泡,再经超离富集后磁铁吸附收集这种NV-IONP囊泡,体外磁场导向用于SCI回输治疗(a)。NV-IONP经磁场导向可以有效到达病灶,促进内皮细胞血管再生,促进星形胶质细胞分泌神经营养因子给神经元,防止神经元细胞过度凋亡,促进M1促炎型巨噬细胞转换成M2抗炎型巨噬细胞以抗炎症效应(b)。
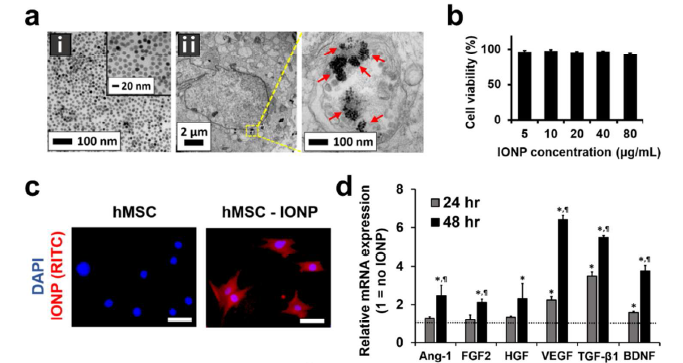
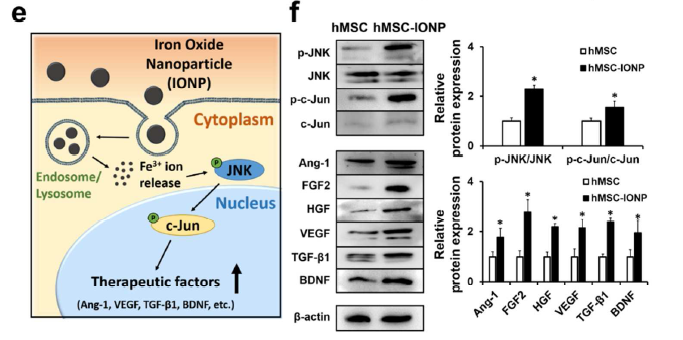
- INOP被hMSC吸收后,hMSC内的血管生成、抗凋亡、抗炎和神经营养因子基因表达有什么变化?
电镜观察INOP的形态和胶体稳定性(a-i),以及吸收了INOP的hMSC-IONP细胞的形态(a-ii)。给予不同浓度的INOP处理hMSCs,CCK8检测发现其无明显毒性(b)。RITC标记INOP后,confocal荧光观察hMSCs摄取了INOP的变化(c),摄取INOP后去掉含有INOP的培养基,换成新鲜培养基再继续培养24h和48h后,qRT-PCR检测在hMSCs中血管生成基因(Ang-1, FGF2, HGF, VEGF),抗凋亡基因(FGF2, HGF, VEGF), 神经营养因子BDNF和抗炎因子TGF-β1的表达在48h后明显上调了(d)。同时利用WB技术在蛋白层面检测了JNK和c-jun的磷酸化, Ang-1, FGF2, HGF, VEGF,BDNF,TGF-β1的蛋白水平也明显上调了(f)。图e为INOP进入细胞内活化JNK和c-jun通路的原理示意图。
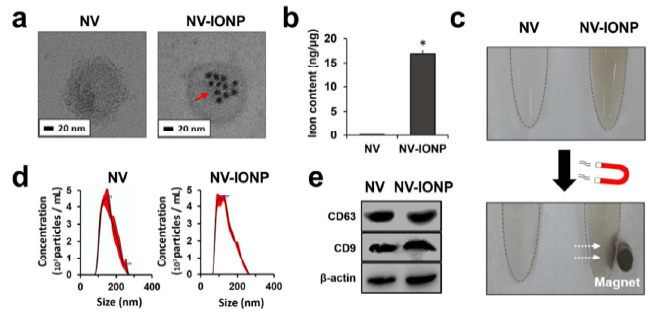
- 对hMSCs和hMSCs-INOP细胞来源的纳米囊泡NV和NV-INOP的鉴定
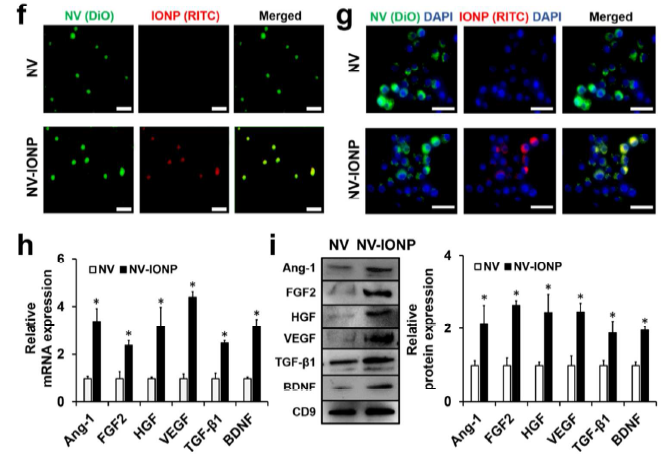
纳米囊泡NV和NV-INOP的电镜形态鉴定(a); 电感耦合等离子质谱法(ICP-MS)验证NV-INOP中包含铁离子的INOP(b);外部磁铁吸附NV-INOP,证明其中含有铁离子的INOP(c); NTA分析NV和NV-INOP的直径大小分布(d);WB鉴定NV和NV-INOP含有外泌体特征性marker蛋白CD9和CD63(e)。RITC红色荧光标记INOP,DiO绿色荧光标记NV,confocal显微成像证明INOP存在于NV-INOP里面(f); DiO标记NV,RITC和DiO标记NV-INOP,confocal显微成像证明NV和NV-INOP被小鼠巨噬细胞Raw 264.7摄取的情况(g)。qRT-PCR分析相比于NV,NV-INOP中的Ang-1, FGF2, HGF, VEGF,BDNF,TGF-β1的基因表达和蛋白水平也明显上调了(h, i),说明摄取了NV-INOP的hMSCs的相关基因和蛋白水平上调,同时其分泌的外泌体中的相关基因和蛋白水平也上调。
- NV和NV-INOP体外应用对内皮细胞、神经元细胞、星形胶质细胞和巨噬细胞的影响?
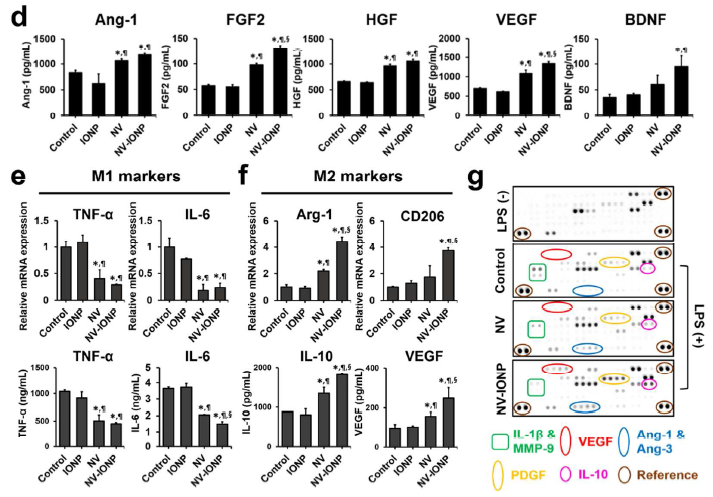
体外毛细血管形成实验检测,发现相比于NV组,NV-INOP刺激8h后更能促进DiI红色荧光标记的HUVECs的毛细血管形成和血管数量增加(a); CCK-8实验检测,相比于其他组,NV-INOP处理后的HUVECs的增殖能力最强(b);在LPS和缺氧条件下,FDA绿色标记活细胞,EB红色标记死细胞,相比于其他组,NV-INOP处理后的神经元样的PC12细胞的存活率明显升高(c); 相比于其他组,NV-INOP处理后的星形胶质细胞会分泌和在mRNA水平表达更多的Ang-1, FGF2, HGF, VEGF,BDNF(d); 相比于其他组,NV-INOP处理后的Raw 264.7表达的M1型巨噬细胞相关基因TNF-α 和 IL-6 下调,表达的M2抗炎型巨噬细胞相关基因Arg-1、CD206、IL-10、VEGF明显上调(e, f)。血管生成和炎症蛋白芯片分析,显示相比于其他组,NV-INOP处理组的M1型基因(IL-1β and MMP-9)下调,而M2型基因(VEGF and IL-10)上调(g)。总之,NV-INOP促进内皮细胞血管生成、防止神经元细胞凋亡、促进星形胶质细胞分泌营养因子和促进M1向M2型巨噬细胞转化以抵抗炎症的能力最强。 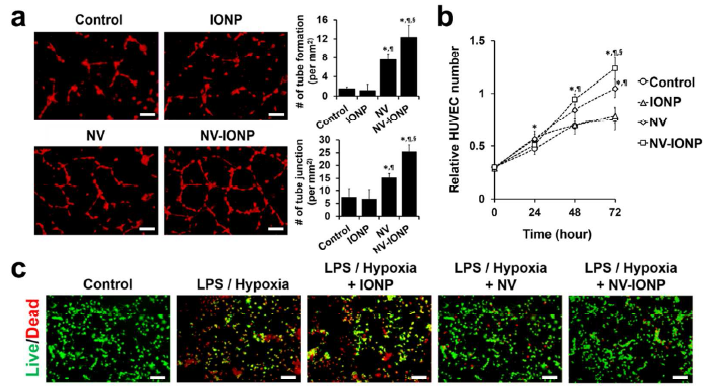
- 体内应用NV和NV-INOP对于治疗SCI的效果是怎么样?
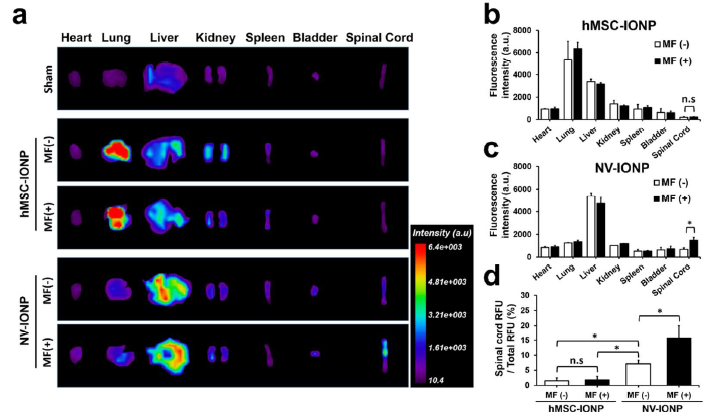
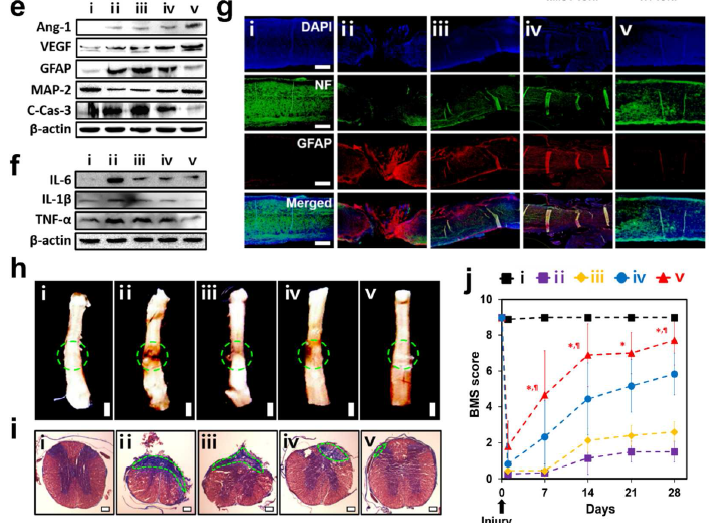
体内回输不同囊泡,24h后IVIS成像观察荧光在体内的各器官分布情况,在无磁场诱导(MF-)的情况下,NV-INOP很少聚集在受损的脊髓而是聚集在肝和肺器官;当在受损部位给予磁场引导(MF+),hMSC-IONP还是无法在受损的脊髓聚集,而NV-INOP则明显在受损的脊髓聚集(a)。hMSC-IONP在MF+ 或者 MF-情况下,体内分布无明显差异(b);NV-INOP在MF+ 或者 MF-情况下,在受损的脊髓聚集的效果有明显差异(c、d); 接下来作者分五组进行体内实验,(i) sham, (ii) injury + PBS, (iii) injury + NV, (iv) injury + NV-IONP (MF-), (v) injury + NV-IONP (MF+),NV-INOP在MF+情况下到达靶器官受损脊髓,WB检测发现血管形成蛋白Ang-1、VEGF明显增加,而胶质细胞增生蛋白GFAP、MAP-2和凋亡蛋白C-Cas-3明显减少,同时炎症蛋白IL-6、TNF-α和IL-1β明显减少(e, f)。confocal显微成像检测NV-INOP在MF+情况下,促进NF神经元的存活和降低胶质细胞增生蛋白GFAP的水平(g)。NV-INOP在MF+情况下,SCI损伤28天后,可以很好地保护脊髓的结构(白灰色区域)不被破坏,减轻纤维化的区域面积(绿色虚线圆圈)(h);同时给予BMS评分,发现NV-INOP在MF+情况下,可明显提高SCI后的BMS评分,显示脊髓的功能恢复得很好(j)。
- 整篇文章的研究与应用思路模型
参考文献
- Kim HY , et al.. Therapeutic Efficacy-potentiated and Diseased Organ-targeting Nanovesicles Derived from Mesenchymal Stem Cells for Spinal Cord Injury Treatment. Nano Lett. 2018. DOI: 10.1021/acs.nanolett.8b01816.
.png)