外泌体领域著名巨头公司Codiak BioSciences的科学顾问Raghu Kalluri博士,他主要身份是德州大学MD安德森癌症中心癌症生物学系研究员,之前在《Nature》主刊发表了题目为“Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer”[1],在外泌体靶向治疗癌症方面引起重大关注。不到一年的时间,该通讯作者在《JCI insight》上发表了题为” Generation and testing of clinical-grade exosomes for pancreatic cancer”,关于如何采用GMP级规范来大规模生产携带特异性siRNA用于靶向治疗胰腺癌的外泌体[2],里面的实验方法超级详细,从外泌体的大规模分离纯化、鉴定和体内体外实验功能验证,外泌体小白可以多多学习和借鉴别人实验方法和实验思路。
PS: 暂时还查不到《JCI insight》的IF,可能是一个新的杂志,其包括自身免疫,肠胃病学,免疫学,代谢,肾脏病学,神经科学,肿瘤学,肺病学,血管生物学等在内的所有生物医学专业领域发表了良好的执行,高质量,深入的研究。建立在《JOURNAL OF CLINICAL INVESTIGATION》 IF=12.784的编辑领导之上,JCI是最古老和最受尊敬的生物医学研究期刊之一,由美国临床研究学会(ASCI)出版,该学会是 1908年成立的非营利性医学科学家荣誉组织。JCI Insight通过出版临床相关的研究报告来实现ASCI通过推进医学科学的目标。

外泌体是由细胞分泌的30-150nm直径大小的双层脂质膜囊泡,其中包含蛋白质、脂质、DNA和RNA,可以稳定存在血液中和有效地作为天然的运输载体,也可以被肿瘤细胞摄取。受此启发,作者去年的研究就是对成纤维细胞来源的外泌体经电转后,装载靶向KrasG12D突变的siRNA,利用胰腺癌的大泡饮特性促进癌细胞有效摄取改造后的外泌体,达到有效地杀伤胰腺癌的目的。但是现在的问题是如何将该技术应用于临床治疗,而对于临床应用的瓶颈就是如何大规模和有效地生产出装载siRNA的批次差异、疗效差异最小的用于治疗癌症的外泌体。由于之前的研究[1]表明,骨髓来源的间充质干细胞/基质细胞(MSCs)可回输治疗各种疾病,而不引起重大副作用。所以作者想采用临床级别的MSCs分泌的外泌体结合电转siRNA技术,利用体内和体外实验检测这种GMP级别的外泌体是否能够治疗人胰腺导管腺癌(PDAC)异体移植瘤和小鼠胰腺癌模型。
- 携带靶向致癌基因KrasG12D的外泌体(iExosomes)可以抑制病人来源PDAC异体移植物生长。(治疗模拟人胰腺癌的体内治疗)
作者首先用iExosomes刺激Panc-1 细胞(携带KrasG12D突变)和BxPC-3 cells(正常Kras)后,全基因组分析两种细胞差异性基因表达,发现iExosomes主要和特异性影响Panc-1 细胞中Kras信号通路相关基因表达。利用小鼠胰腺原位移植病人来源的胰腺癌组织模型(PDX), 证明iExosomes腹腔回输治疗显著减轻肿瘤负担和提高小鼠的生存率。 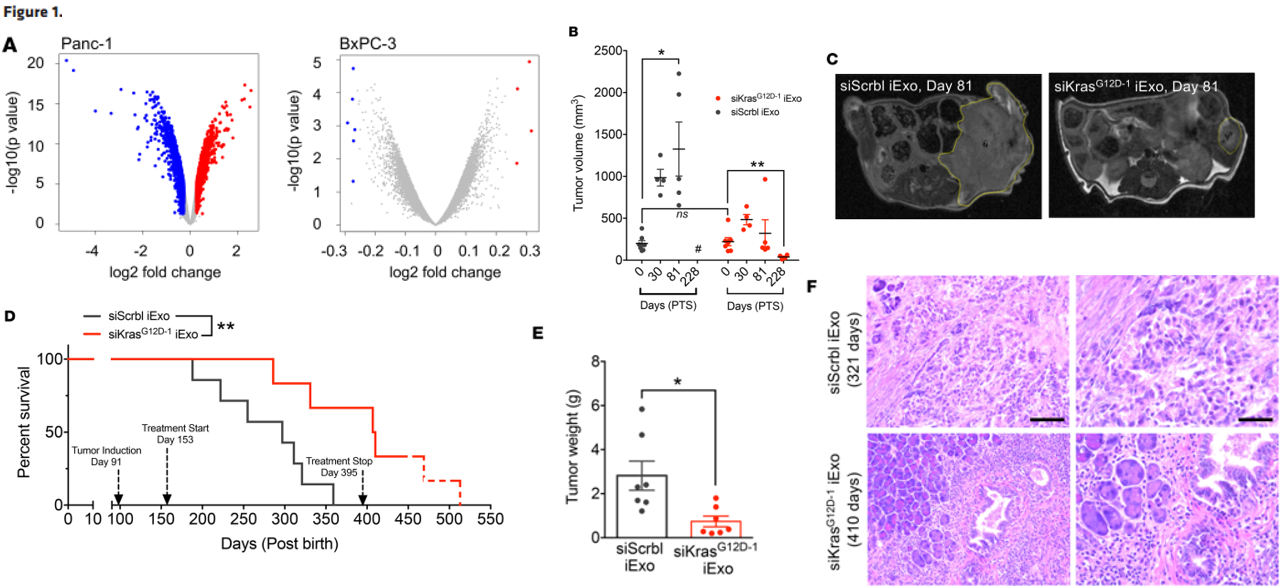
(A)火山点图描述iExosomes刺激两种细胞后的差异基因表达(红色代表上调基因,蓝色代表下调基因);(B)在第30、81、228天开始iExosomes治疗,MRI检测胰腺瘤大小;(C)MRI检测中黄色区域为肿瘤;(D)iExosomes治疗后小鼠的生存率;(E)体内异体移植物成瘤实验终止时两组小鼠体重对比;(F)iExosomes治疗组和对照组在第321天的胰腺癌H&E染色结果。
2. GMP级别MSCs来源外泌体的质控
①人包皮成纤维细胞(作者之前研究[1]用到的细胞株BJ 成纤维细胞,作为阳性对照)和人MSCs在显微镜下具有相似的形态,流式检测细胞和其分泌外泌体的表面都有CD9、CD63、CD81和CD47分子,MSCs外泌体则表达CD29、CD90特异性分子。

(A)人包皮成纤维细胞和人MSCs细胞的显微镜形态;(B)两种细胞外泌体的颗粒数目比较;(C)颗粒直径大小分布;流式检测两种细胞外泌体表面的分子,(D)人包皮成纤维细胞的流式结果,(E)人MSCs细胞的流式结果
②大量制备GMP级别MSC来源外泌体:这里,作者采用Terumo BCT牌的大量生物反应器培养系统,用1L 1×PBS进行预处理(自动化处理),并用稀释在250ml 1×PBS中的5mg人纤连蛋白(BD Biosciences)包被24小时。然后,用500ml 含有1% L-谷氨酰胺和5%人血小板裂解物的α-MEM(完全培养基)洗涤反应器并加入用25ml完全培养基稀释的20×106个MSC(第3代),并使用完全培养基扩增9天。将新鲜的完全培养基连续添加到细胞中,并根据每日葡萄糖和乳酸含量调整入口速率。 9天后通过葡萄糖和乳糖测量所确定的细胞达到约80%,用2L 1×PBS洗涤细胞,用不含PLT的培养基(补充有1%L-谷氨酰胺的αMEM)代替完全培养基。然后每隔48小时在密封袋(密闭系统)中收集生物反应器条件培养基(250ml),共6次收集(收获)。在这12天里,每日测量恒定的葡萄糖水平表示细胞没有出现问题。6次收集到的培养上清经过滤和超离后获得6种外泌体,经电镜鉴定、NTA分析直径大小和数目、流式检测外泌体表面分子,都没出现明显的批次质量差异问题。
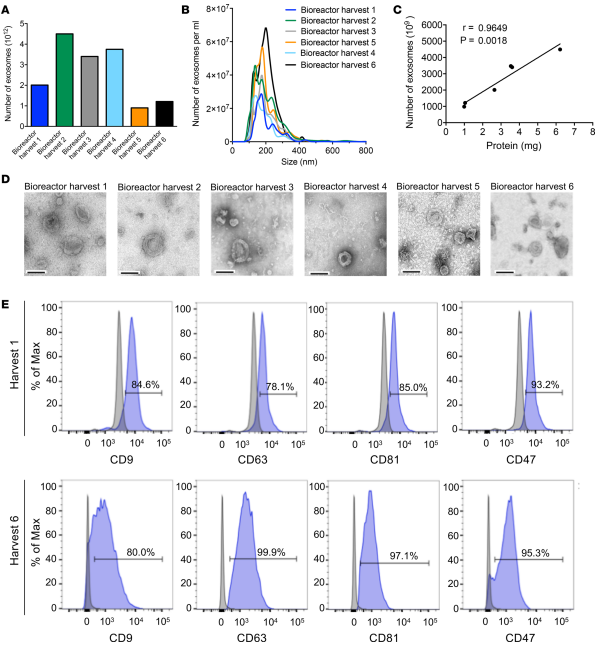
经6次收集的培养基分离外泌体的颗粒数目(A)、直径大小分布(B)、纯度(C)、电镜形态(D)和流式分析表面marker表达(E)。
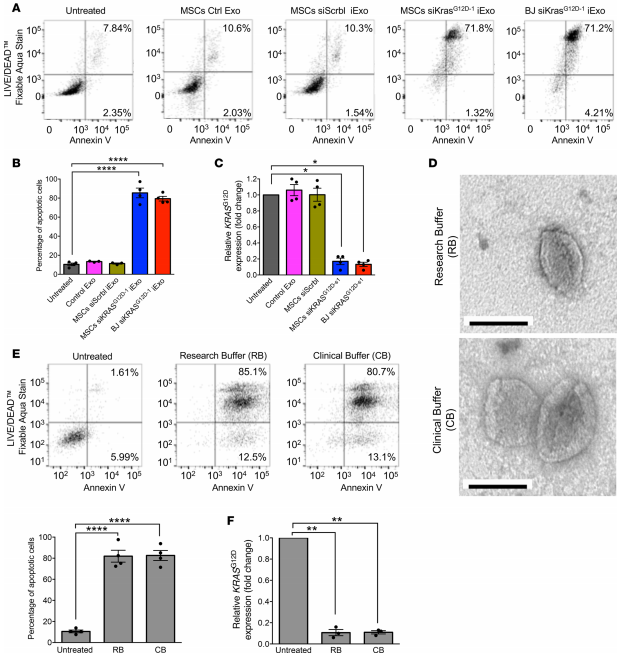
③外泌体的体外功能验证:GMP级别的MSC细胞和BJ成纤维细胞外泌体经电转siKRASG12D后,获得MSC siKrasG12D–1 iExo和BJ siKrasG12D–1 iExo,两种外泌体在促进Panc-1细胞凋亡(A, B)和下调癌细胞KrasG12D基因表达(C)方面有相似的作用。作者之前研究中使用研究型buffer(RB)不适用于临床回输测试,所以采用临床型buffer(CB)稀释siKrasG12D–1 iExo,在该buffer下它的电镜形态(D),促进Panc-1细胞凋亡能力(E)和下调癌细胞KrasG12D基因表达能力(F)都没有受到影响。所以临床应用可以采用Plasma-Lyte (CB) buffer,可以获得最好的治疗效果,减少副作用。
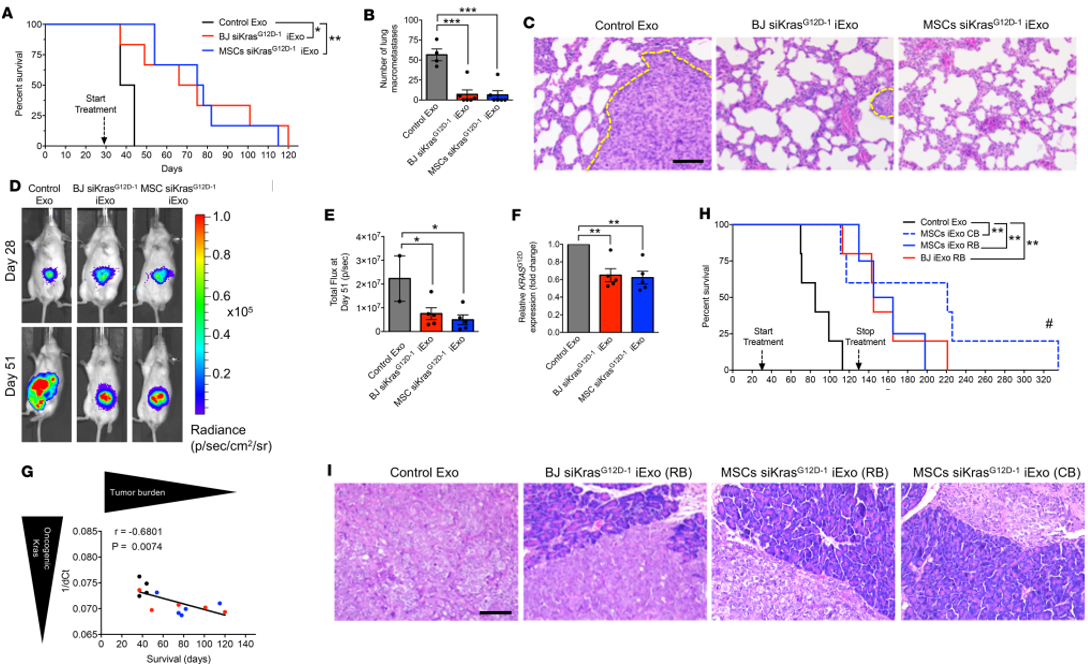
3. MSC来源的iExosomes可以抑制小鼠体内PDAC肿瘤形成
作者利用高转移性KPC689细胞构建原位癌模型[2],验证RB buffer稀释的MSC siKrasG12D–1 iExo和BJ siKrasG12D–1 iExo在第29天开始体内治疗效果,iExosome显著提高PDAC小鼠的总生存率(A),减轻癌转移负担(B),肺转移减少(C),IVIS成像观察iExosome治疗组在不同天数后肿瘤大小(D, E)和肿瘤Kras突变基因表达减少(F),致癌基因Kras表达和小鼠的生存率成负相关(G)。另外,作为采用了Panc-1细胞原位癌模型,给予iExosome治疗,MSC siKrasG12D–1 iExo和BJ siKrasG12D–1 iExo治疗无论用RB还是CB稀释都可以显著提高了小鼠的总生存率(H),改善胰腺的病理症状(I)。
4. 制备大量的GMP级别iExosome可用于PDAC治疗研究。之前的是小规模电转siRNA(LS: 109外泌体+1ug siRNA+400RB),现在成比例放大的大规模电转siRNA(HS: 2*109外泌体+2mg siRNA(两个公司来源相同序列)+20ml CB),两种方法电转获得的MSC siKrasG12D–1 iExo都可有效促进Panc-1的凋亡(A, B)和抑制KrasG12D基因表达(C),但是外泌体这个效应会受到Triton X-100处理影响(D)。采用晚期KPC689癌细胞原位癌模型证明了MSC siKrasG12D–1 iExo和吉西他滨(临床治疗PDAC标准化疗药)联合治疗能提高成瘤小鼠的生存率(E),而且提前11天iExo和吉西他滨联合治疗更能显著提高成瘤小鼠的生存率(F)。
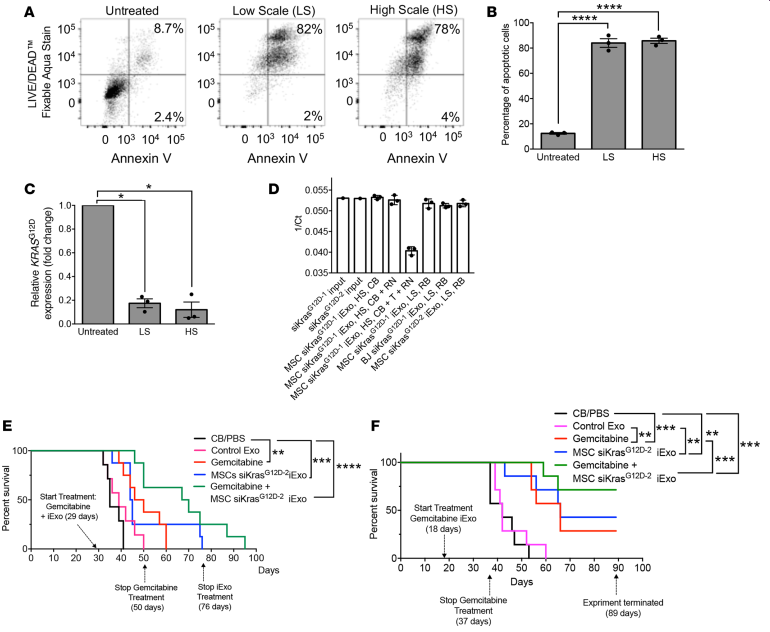
5. 那长期回输iExosome会不会有什么毒性反应和免疫反应呢?作者在免疫能力正常小鼠每两天一次腹腔回输iExosome,持续4个月后,检测血液生化指标没有明显变化,只有轻微的肝和胆囊炎症和各个器官轻微病理症状。另外在免疫能力正常小鼠每两天一次腹腔回输iExosome,持续3周后,免疫器官的淋巴细胞和髓细胞比例正常,血液炎症因子正常。那外泌体被回输到小鼠体内后的分布情况呢?无论是成瘤小鼠还是不成瘤小鼠,外泌体经腹腔回输后主要分布于肝、脾、肺、胰腺,而且主要累积和特异性分布在胰腺。回输24和48小时后,iExosome还会滞留在胰腺一段时间。经过静脉回输iExosome,也有特异性累积和分布在胰腺的特点。那这种iExosome的保质期会有多久呢?作者也进行相应的研究,以适应未来临床大量存储需要。iExosome经过-80冻存45天或者6个月后再解冻,NTA分析直径大小分布正常,电镜分析形态正常,流式分析外泌体标志分子和CD47分子表达正常。体外功能验证发现,复苏的iExosome还可以有效地促进Panc-1细胞凋亡和抑制KrasG12D的表达;体内功能实验验证,发现复苏的iExosome应用于体内PDAC成瘤小鼠的治疗后,小鼠的生存率依然得到提高。但是如果iExosome复苏解冻后放在室温或者四度≥2天,促进Panc-1细胞凋亡和抑制KrasG12D的表达的能力明显下调,这主要是因为外界温度不适合siRNA的保存,qPCR检测iExosome包裹的siRNA量明显降低。(具体图看原文)
总结:该研究提供了可以大规模生产GMP级别的可以携带针对胰腺癌的特异性siRNA的外泌体的思路和策略,对生产出来的iExosomes进行质控,进行NTA分析,电镜形态分析,流式表型分析,体外功能实验验证后,采用适合临床使用的CB buffer应用于体内功能实验,同样获得很好的疗效和靶向性。同时这种GMP级别iExosomes的毒性反应和免疫原性非常低,保质期长,适合未来临床的大量需要。当然也有很多问题存在,有大规模的生产iExosomes,超离大量上清耗时耗力,得到的外泌体纯度还是不够,可能会对临床应用有限制,所以关于外泌体的提取还得继续优化,已达到省时省力高纯度的外泌体的标准。也给我们留下悬念,这种iExosomes能不能针对其他癌症也同样获得好的疗效。对于人体试验,iExosomes的使用剂量如何控制?等等
牛的不能再牛,发过science, 5篇nature,超多篇nature med等47篇高分杂志的通讯作者:  Raghu Kalluri出生在密苏里州的圣路易斯。他在堪萨斯大学医学中心的生物化学和分子生物学的Ph.D.学位以及布朗大学医学院的M.D. 学位。Kalluri是宾夕法尼亚大学医学院的研究助理,研究方向是免疫学和器官纤维化。1997年,他转到哈佛医学院担任医学助理教授,并在贝斯以色列女执事医疗中心担任医学系的教员。2006年,Kalluri被任命为矩阵生物学系主任,并被提升为哈佛医学院医学教授。他曾经在哈佛大学麻省理工学院健康科学与技术部和哈佛干细胞研究所生物化学与分子药理学系任职。Kalluri于2012年受聘于MD安德森癌症中心,担任癌症生物学部主席和肿瘤转移研究中心主任。他的实验室广泛地研究细胞和组织微环境及其对癌症进展和组织纤维化的影响。https://www.mdanderson.org/research/departments-labs-institutes/labs/kalluri-laboratory/lab-members.html
Raghu Kalluri出生在密苏里州的圣路易斯。他在堪萨斯大学医学中心的生物化学和分子生物学的Ph.D.学位以及布朗大学医学院的M.D. 学位。Kalluri是宾夕法尼亚大学医学院的研究助理,研究方向是免疫学和器官纤维化。1997年,他转到哈佛医学院担任医学助理教授,并在贝斯以色列女执事医疗中心担任医学系的教员。2006年,Kalluri被任命为矩阵生物学系主任,并被提升为哈佛医学院医学教授。他曾经在哈佛大学麻省理工学院健康科学与技术部和哈佛干细胞研究所生物化学与分子药理学系任职。Kalluri于2012年受聘于MD安德森癌症中心,担任癌症生物学部主席和肿瘤转移研究中心主任。他的实验室广泛地研究细胞和组织微环境及其对癌症进展和组织纤维化的影响。https://www.mdanderson.org/research/departments-labs-institutes/labs/kalluri-laboratory/lab-members.html
参考文献
- Kamerkar S, et al. Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer. Nature. 2017;546(7659):498–503
- Mendt M, et al. Generation and testing of clinical-grade exosomes for pancreatic cancer. JCI Insight. 2018; 3(8)
.png)