9月11日,Nature Communications在线发表了一篇circRNA的研究文章,报道脊髓中circAnks1a在神经性疼痛的啮齿类模型中调节超敏反应。文章的通讯作者是中山大学医学院信文君教授,徐婷和中山大学孙逸仙纪念医院马超教授([1])

啮齿动物脊髓背角神经元可介导神经损伤诱导的疼痛样超敏反应。本文作者发现脊神经结扎后可诱导circAnks1a的表达增高,circAnks1a在胞浆和核内都有分布。circAnks1a的siRNA处理后可降低神经损伤诱导的疼痛样表型。机制方面,circAnks1a可促进YBX1与 transportin-1的相互作用,促进YBX1的入核。在核内,circAnks1a能促进YBX1与Vegfb基因启动子的结合并促进Vegfb的表达。circAnks1a还可以通过竞争性结合miR-324-3p在转录后水平调控VEGFB的稳定性。下面就让我们一起了解一下这篇文章:
如何发现circAnks1a的?
为探索circRNA是否在神经性疼痛中发生变化并具有相关的生理功能,作者分离了脊神经结扎前后的背脊神经组织,进行了RNA-seq测序分析。共测到61883种circRNA分子。差异分析后QPCR验证,最终锁定circAnks1a。作者进一步验证了circAnks1a在神经结扎后不同时间段的表达变化趋势,结果表明随着结扎时间的延长,circAnks1a的表达也呈现梯度的上升趋势,说明circAnks1a的表达可能与脊神经结扎后的生理变化有关。
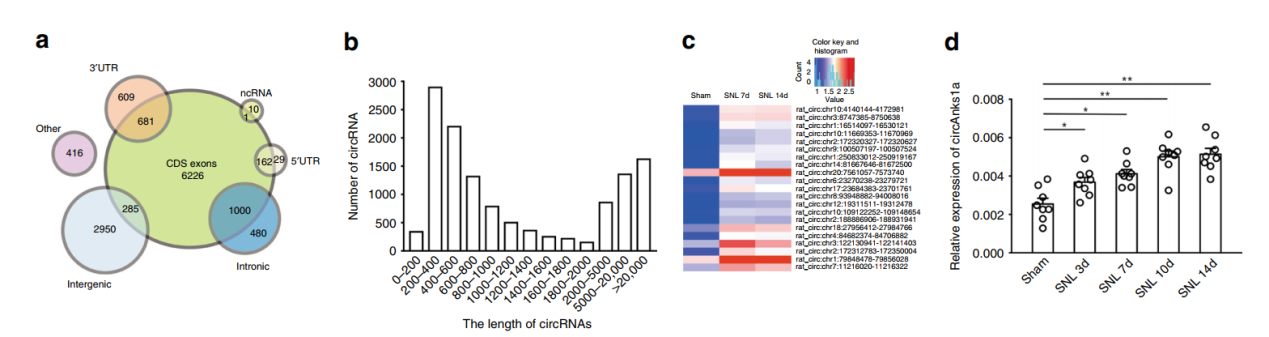
图1 大鼠脊髓背角circRNA测序分析 ([1])
验证circAnks1a的与神经性疼痛的关系
Sanger测序验证了circAnks1a的序列,耐受RNase R消化作用和亚细胞定位情况。circAnks1a由Anks1a基因的5-11外显子构成,长度988bp。亚细胞定位分析结果显示circAnks1a在细胞质和细胞核中均有分布。
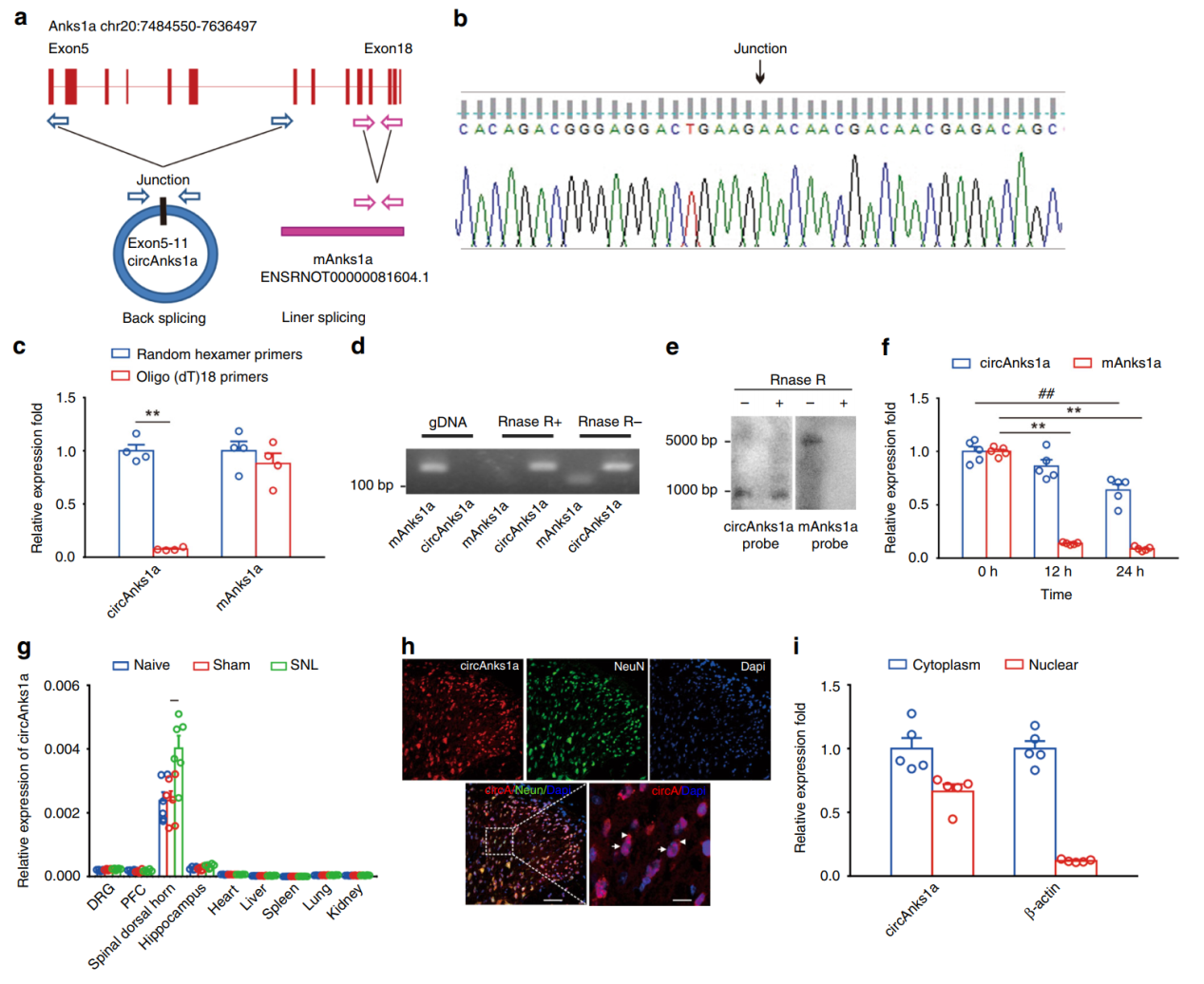
图2 circAnks1a的验证和分析 ([1])
为分析circAnks1a的是否在神经性疼痛模型中发挥功能,作者在脊神经结扎的模型中通过注射给药的方式给大鼠模型注射circAnks1a的siRNA,分析神经电生理变化情况。结果显示,干扰circAnks1a后可显著改善mEPSCs的幅度和频率增加,表明可以缓解神经结扎诱导的疼痛超敏反应。
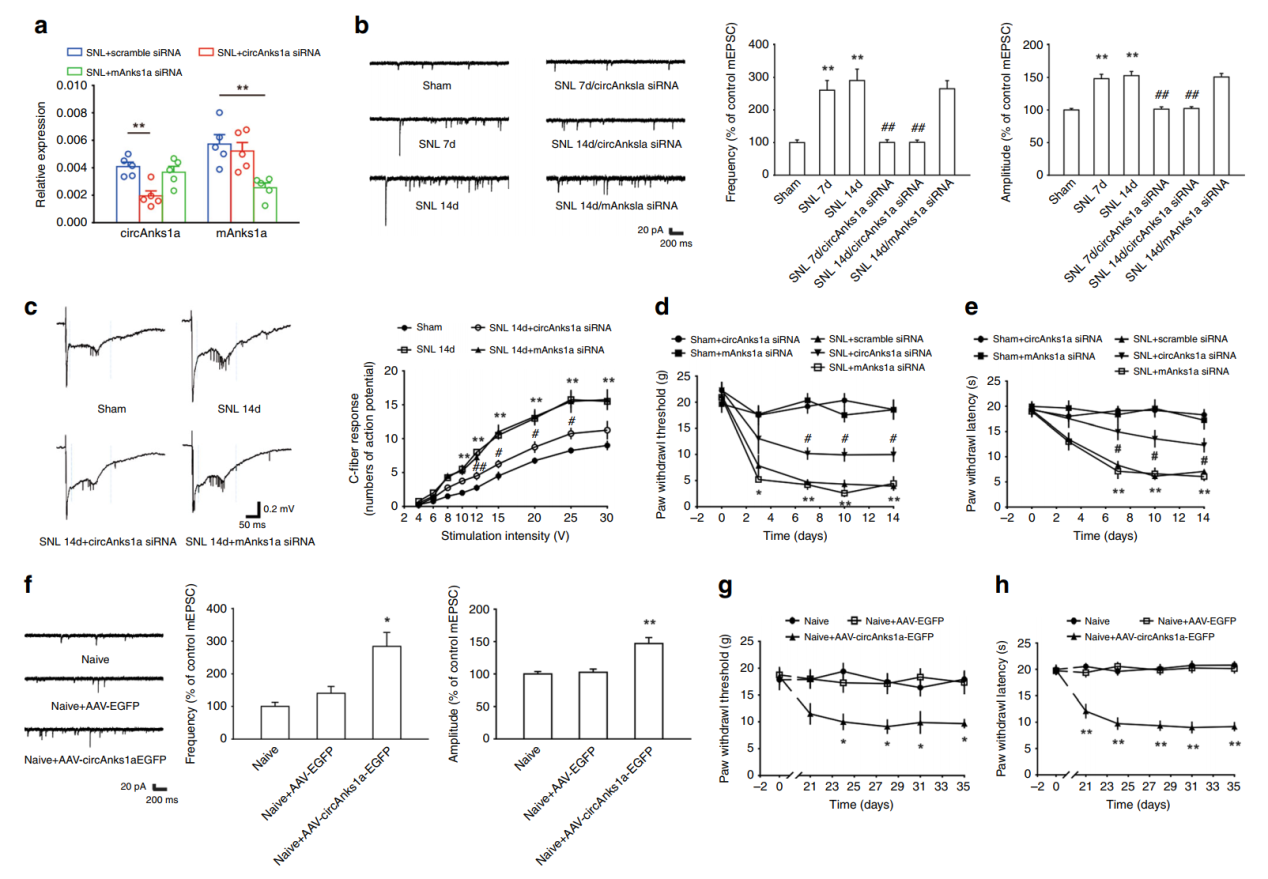
图3 circAnks1a与神经性疼痛表型相关性分析 ([1])
VEGFB与结扎后脊髓背角神经性疼痛有关
为探索circAnks1a在神经性疼痛过程中的作用机制,作者通过注射circAnks1a的AAV过表达载体,分析过表达前后变化显著的基因,然后分析其中可能介导circAnks1a在神经性疼痛中作用的相关分子。作者通过芯片法分析后找到了29种差异显著的基因,其中VEGFB变化最明显。结扎后不同时间点样品中VEGFB的mRNA和蛋白的变化趋势也是逐渐增高的。VEGFB仅在神经元中表达,胶质细胞不表达。体内注射VEGFB的siRNA也可以显著抑制mEPSCs的幅度和频率增加,说明VEGFB在神经性疼痛中的作用。
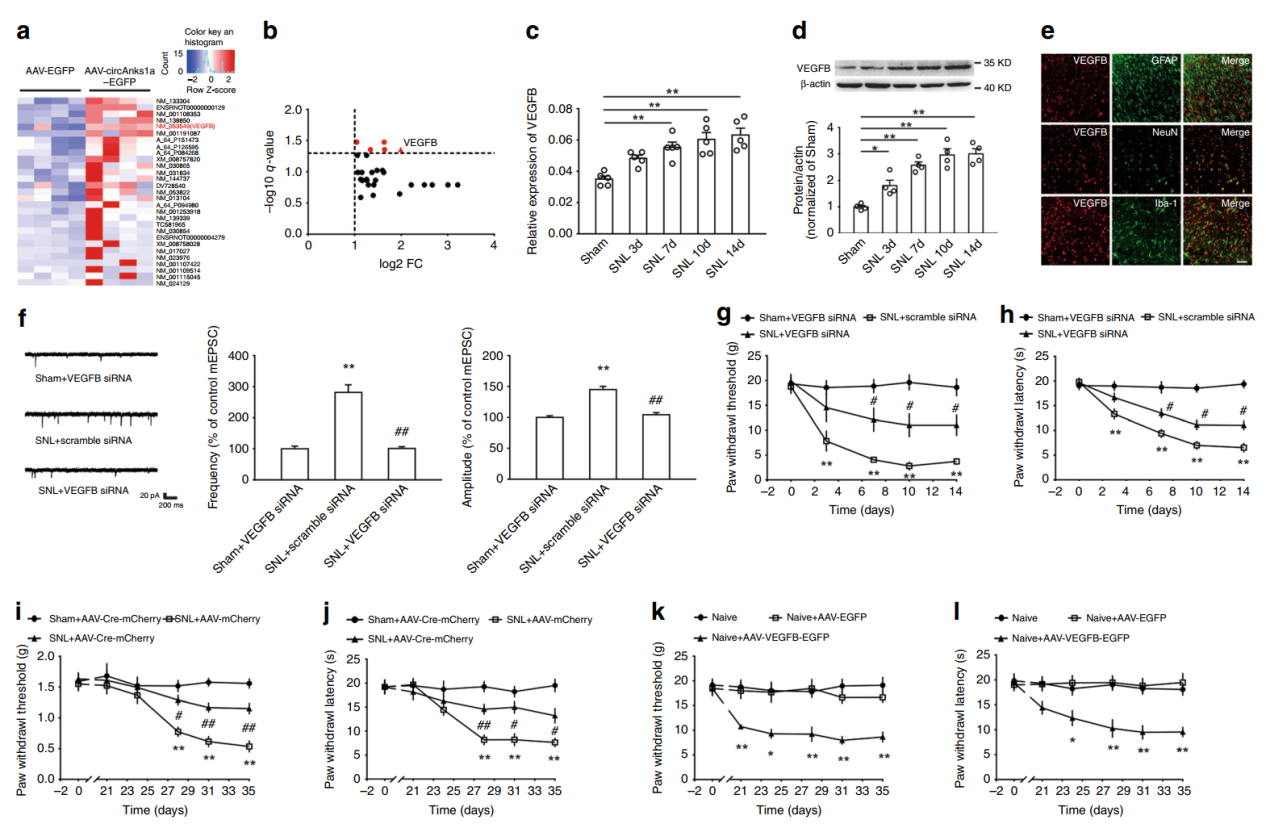
图4 VEGFB与神经性疼痛有关 ([1])
circAnks1a促进VEGFB表达
芯片实验中VEGFB是表达增高最显著的基因,那么circAnks1a是如何促进VEGFB表达的?作者首先验证了circAnks1a对VEGFB表达的作用情况。结果显示circAnks1a与VEGFB在细胞内有共定位,干扰circAnks1a后VEGFB的mRNA和蛋白水平均下降,而过表达circAnks1a则促进VEGFB的表达。
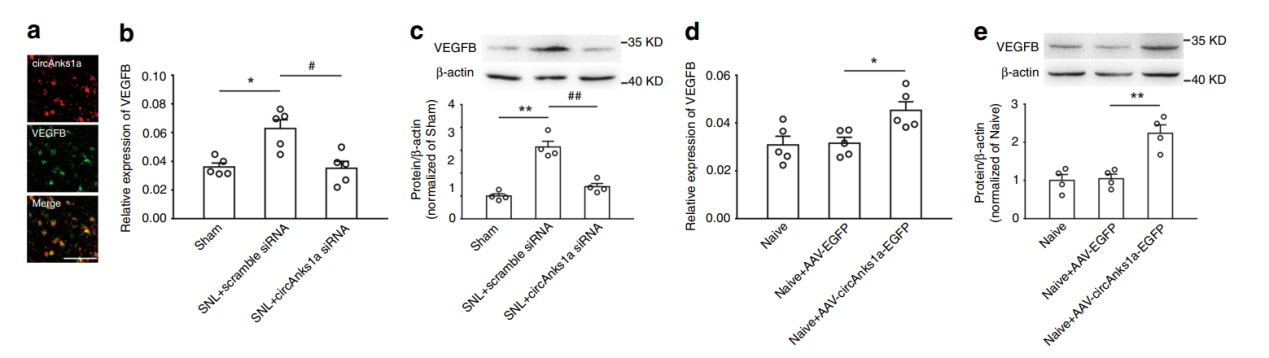
图5 circAnks1a促进VEGFB表达 ([1])
circAnks1a调控VEGFB表达的机制
为探索circAnks1a调控VEGFB表达的机制,作者进行了RNA pull-down实验,捕获的蛋白中发现了YBX1。进一步的实验分析验证表明circAnks1a可以与YBX1结合。结扎后circAnks1a与YBX1的相互作用加强。作者还发现随着结扎时间的延长,YBX1在细胞核中的定位也会增加,干扰circAnks1a后,YBX1在核内增加的趋势受到抑制。反之,过表达circAnks1a则促进YBX1的核定位。进一步的分析表明YBX1入核的过程与transportin 1相关。circAnks1a可以促进YBX1与transportin 1的相互作用和入核。
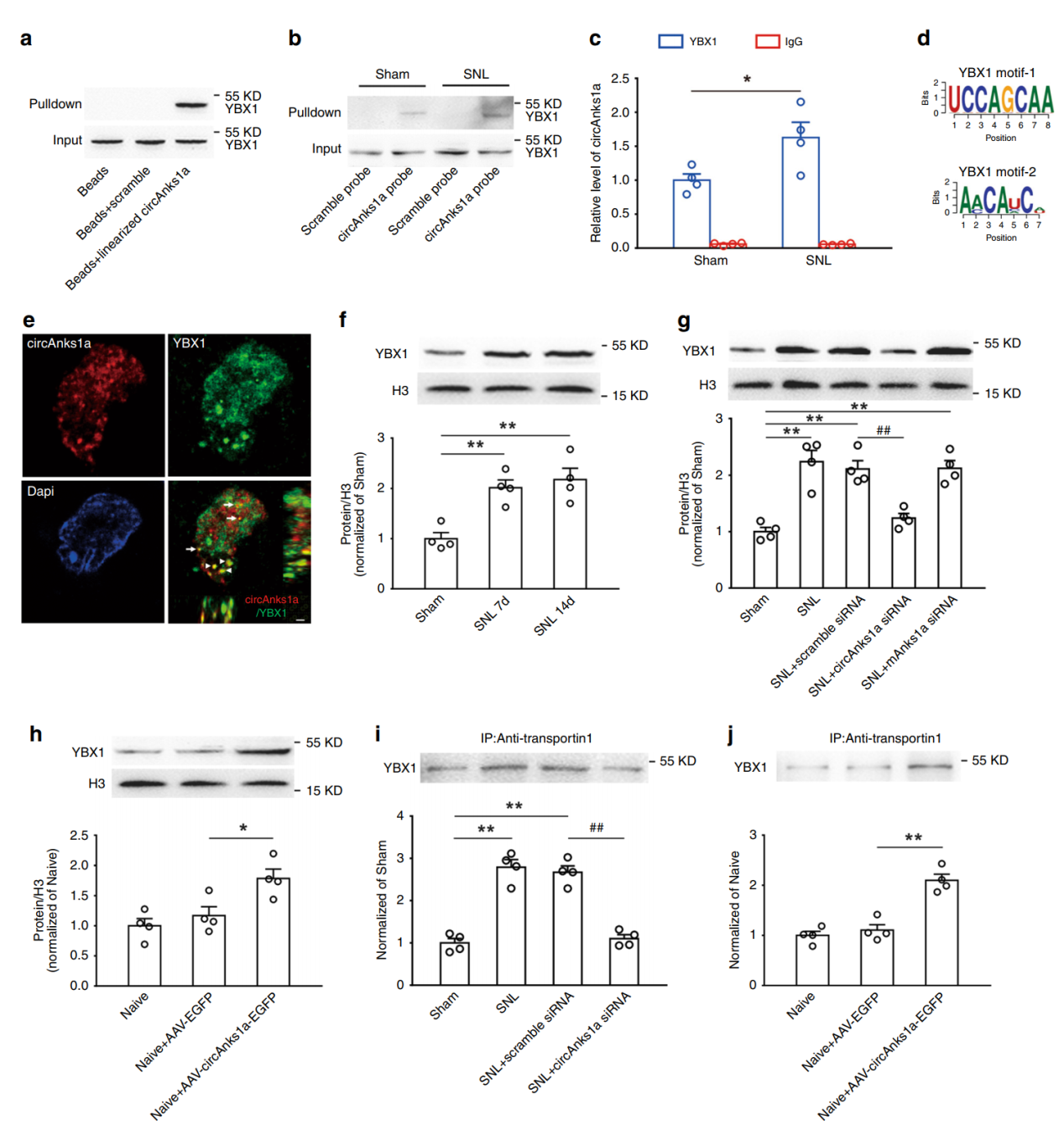
图6 circAnks1a与YBX1相互作用促进后者入核 ([1])
YBX1入核后如何促进VEGFB的表达的?FISH共定位分析表明YBX1可以结合VEGFB基因的启动子
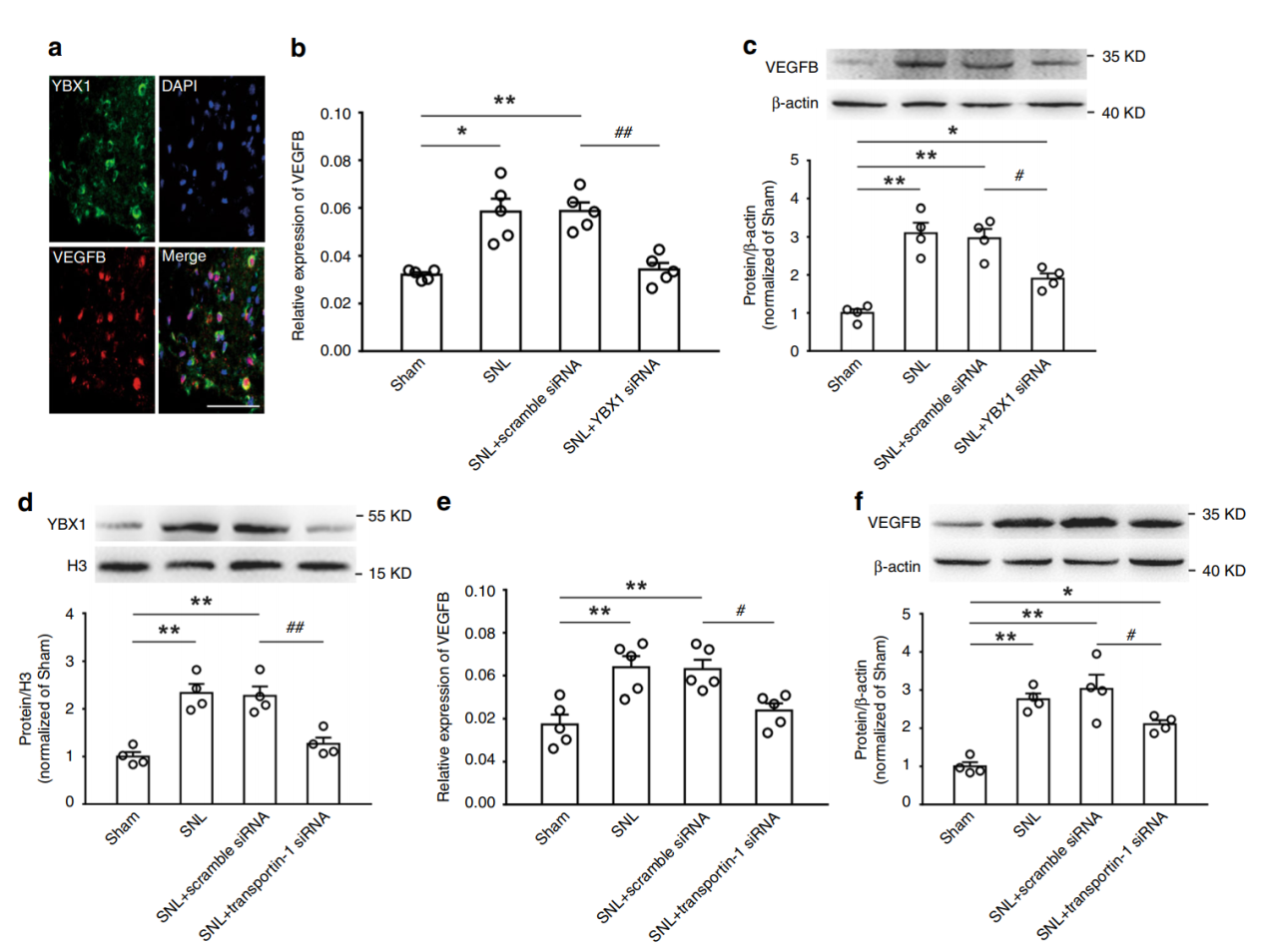
图7 YBX1可以结合VEGFB基因启动子 ([1])
ChIP分析表明,circAnks1a可以促进YBX1结合到VEGFB基因的启动子区,促进VEGFB的转录和表达。
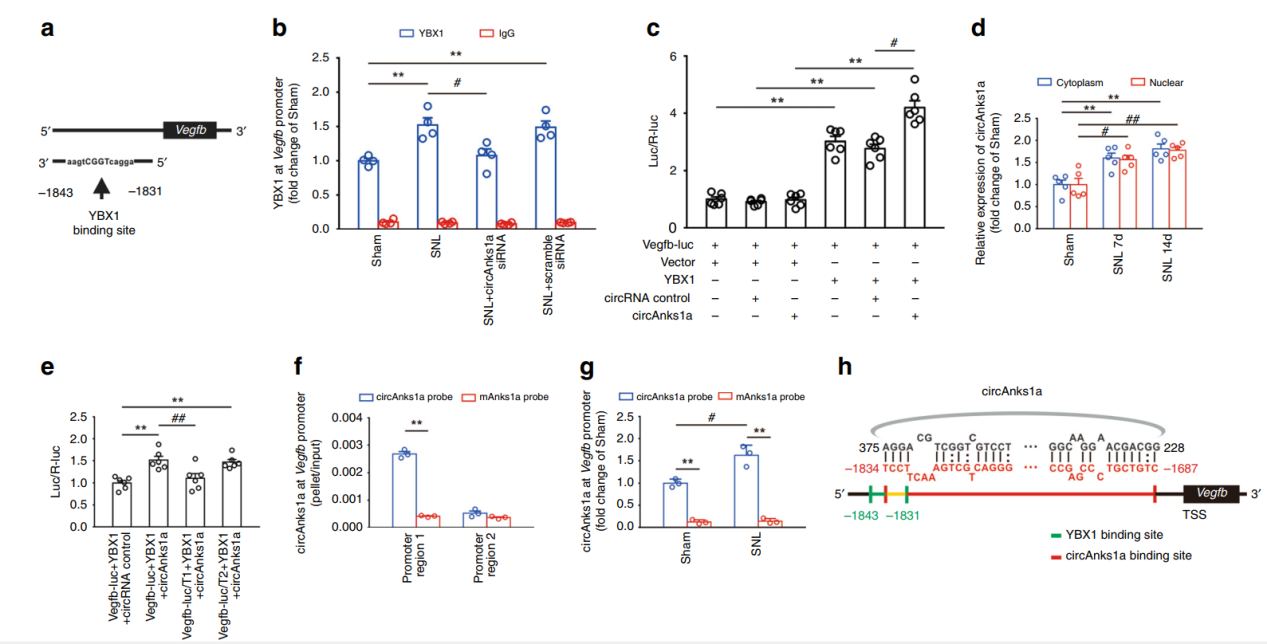
图8 circAnks1a促进YBX1结合VEGFB基因启动子 ([1])
除了结合YBX1并促进其入核和促进VEGFB基因的转录表达。作者还分析了circAnks1a作为ceRNA的机制。作者发现circAnks1a可以通过竞争性结合miR-324-3p调控VEGFB基因的稳定性,促进VEGFB的表达。
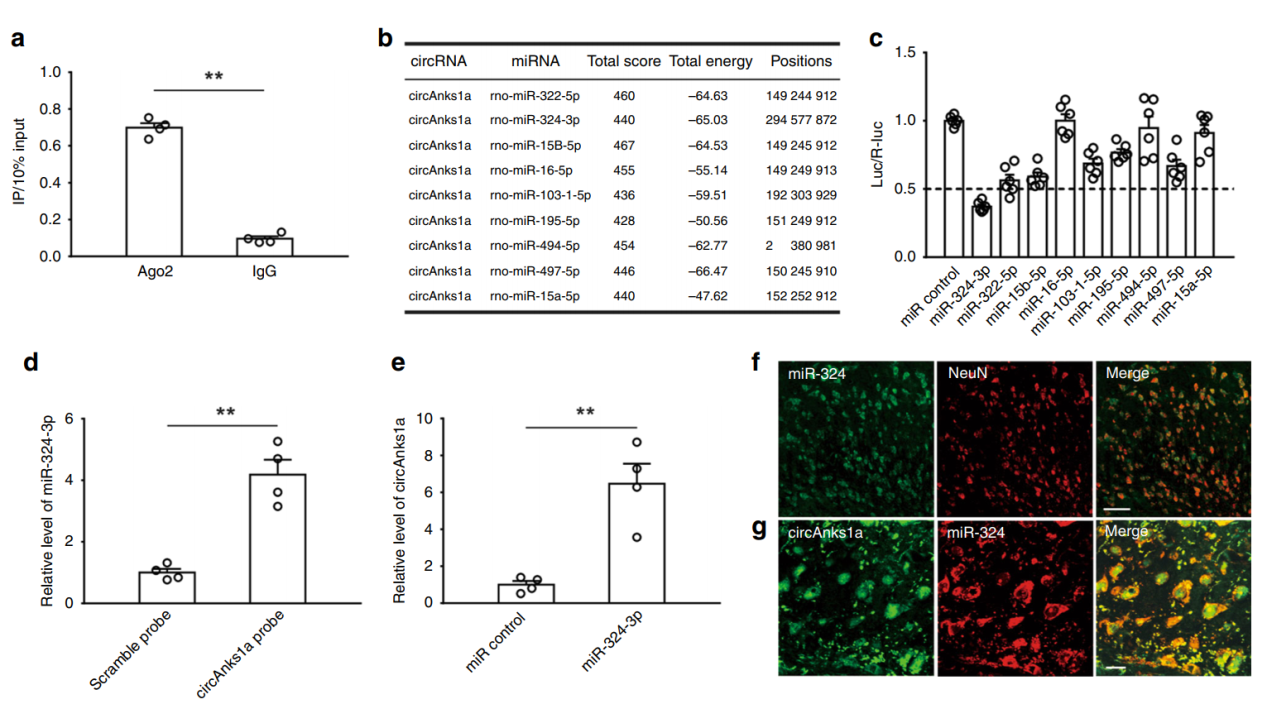
图9 circAnks1a通过竞争性结合miR-324-3p调控VEGFB ([1])
总之,本文主要基于大鼠脊神经结扎的模型分析了差异变化的circRNA,找到了circAnks1a,并验证了circAnks1a与神经性疼痛的相关性。机制方面作者发现circAnks1a可以促进YBX1的入核和结合VEGFB启动子,促进其表达,还可以通过竞争性结合miR-324-3p调控VEGFB的表达。两种机制共同促进了VEGFB的表达,最终介导神经性疼痛的生理过程。本文的主要工作都是在大鼠模型中完成的,目前很多疾病中均没有特别好的体外细胞模型,者也为这类疾病中研究circRNA增加了难度。本文的一些做法为这类疾病中开展circRNA研究提供了非常好的借鉴,值得从事非肿瘤疾病的研究者学习参考。
参考文献
1. Su-Bo Zhang, S.-Y.L., Meng Liu, Cui-Cui Liu, Huan-Huan Ding, Yang Sun, Chao Ma, Rui-Xian Guo, You-You Lv, Shao-Ling Wu, Ting Xu & Wen-Jun Xin, CircAnks1a in the spinal cord regulates hypersensitivity in a rodent model of neuropathic pain. Nature Communications, 2019.
.png)