6月23日,Autophagy杂志在线发表了南方科技大学陈国安副教授和北京大学人民医院王俊为共同通讯作者的文章,介绍发现在肺癌中circHIPK3参与调控自噬通路([1])。

circHIPK3在肺癌中高表达
来自HIPK3第二外显子形成的circRNA(circHIPK3)已经在多篇文章中报道其功能研究,但在肺癌中的功能研究此前尚未开展。本文作者因此尝试分析circHIPK3在肺癌中的作用机制。circHIPK3在肺癌细胞中广泛高表达,主要定位于胞质中。为分析circHIPK3的功能和机制,作者设计并验证了特异性靶向circHIPK3的siRNA(si-circ-1和si-circ-2),靶向线性HIPK3的siRNA(si-lin),同时靶向circHIPK3和线性HIPK3的siRNA(si-both),经验证这些siRNA都可以有效的对靶分子产生干扰作用,非特异性的干扰效果较低。
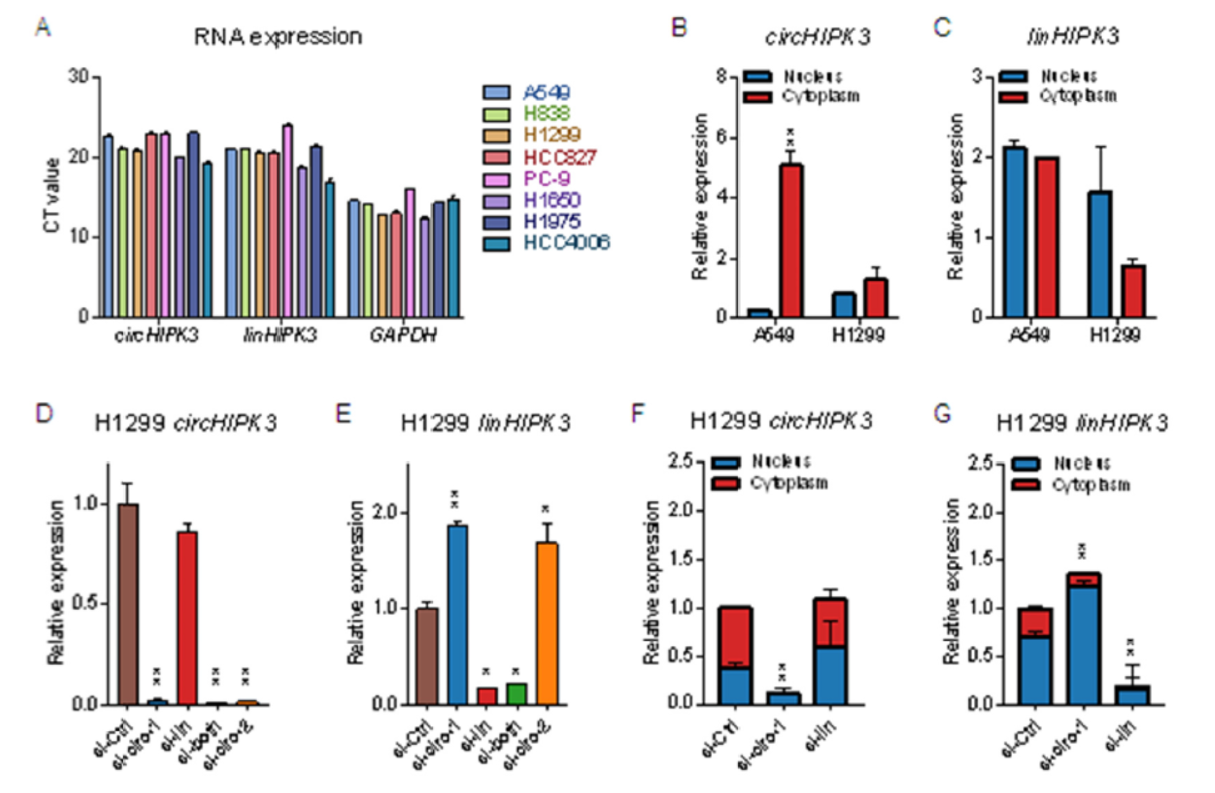
图1 circHIPK3在肺癌细胞中广泛表达 ([1])
干扰circHIPK3抑制细胞增殖和侵袭
上述各种siRNA转染不同的肺癌细胞,分析细胞增殖曲线,结果表明干扰circHIPK3可显著抑制细胞增殖,但干扰线性HIPK3则不能明显抑制细胞增殖。克隆形成实验表明干扰circHIPK3可显著抑制克隆形成,但干扰线性HIPK3效果不明显。细胞侵袭实验也得到类似效果,circHIPK3可显著抑制细胞侵袭,但干扰线性HIPK3没有明显变化。
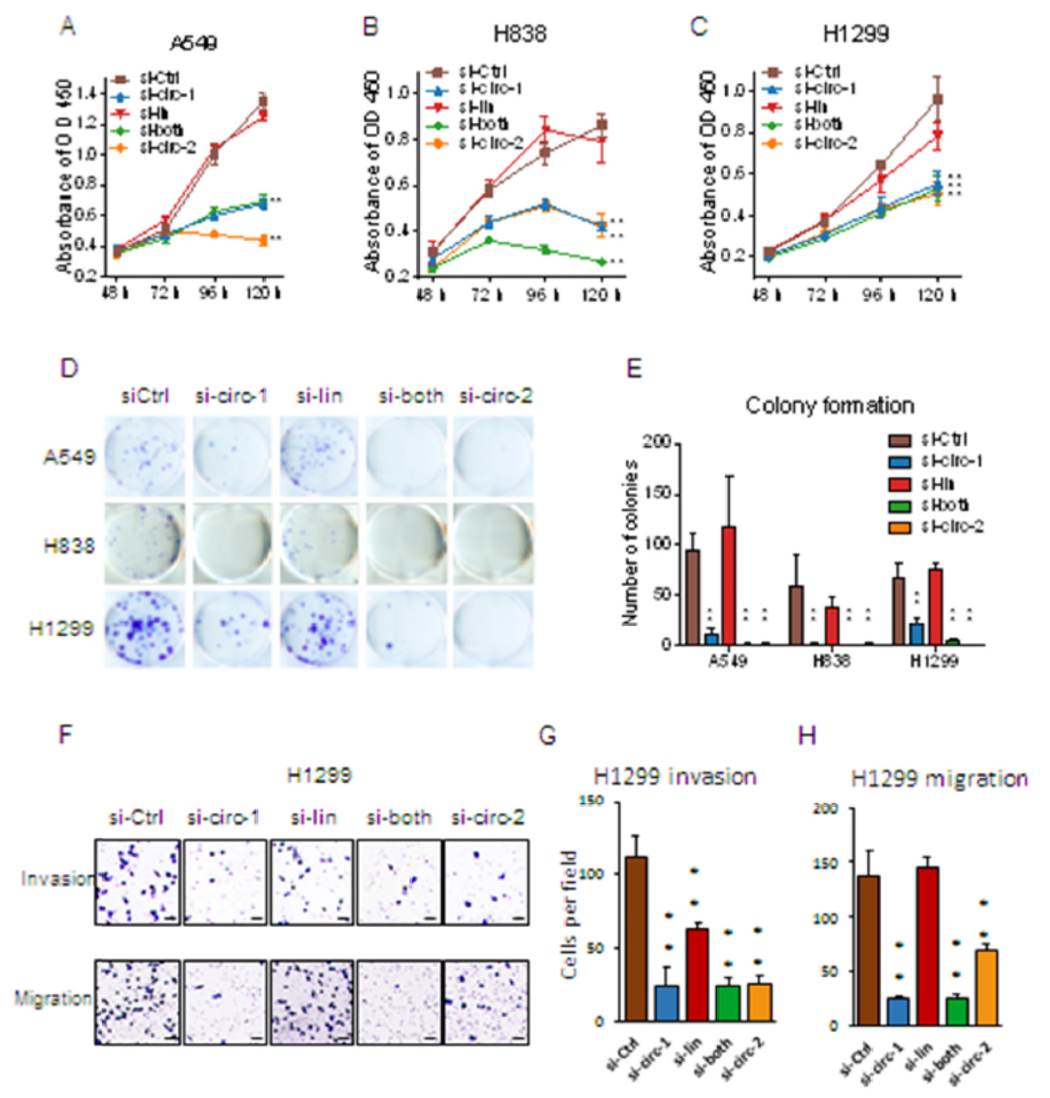
图2 干扰circHIPK3显著抑制细胞增殖和侵袭 ([1])
circHIPK3参与调控细胞自噬
已知HIPK3基因参与细胞自噬调控,那么circHIPK3在肺癌细胞中对自噬的作用是怎样的?作者针对所设计的siRNA干扰条件分析细胞自噬的情况,结果发现在A549细胞和H838细胞中干扰circHIPK3可显著增强LC3B-I,降低p62(SQSTM1),表明可显著诱导细胞自噬。但在H1299细胞中,这一现象却并不明显。
RFP-GFP-LC3B在自噬体中可同时发绿色和红色荧光,但当它们进入自噬溶酶体后,因pH较低,GFP失活,仅能发出红色荧光。基于这一载体,可测试自噬流(autophagic flux)变化。利用这一检测体系,作者分析了A549,H838和H1299中自噬体和自噬溶酶体的比例,以分析自噬流的变化趋势。A549和H838中干扰circHIPK3可同时增加自噬体和自噬溶酶体的数量,说明干扰circHIPK3能够诱导自噬,但干扰线性HIPK3却导致自噬流下降10-20%。Si-both则逆转干扰线性HIPK3的现象。但在H1299细胞中,干扰circHIPK3和线性HIPK3均降低自噬流。
3-MA和Bfa-1是常用的细胞自噬抑制剂,A549 和H838细胞中两种药物分别处理后,干扰circHIPK3后细胞增殖的影响减弱,说明在这两种细胞中干扰circHIPK3导致的细胞增殖抑制的确与细胞自噬有关。但在H1299细胞中,两种药物处理后不能逆转干扰circHIPK3抑制增殖的现象。这些发现表明circHIPK3部分通过细胞自噬作用影响细胞增殖。
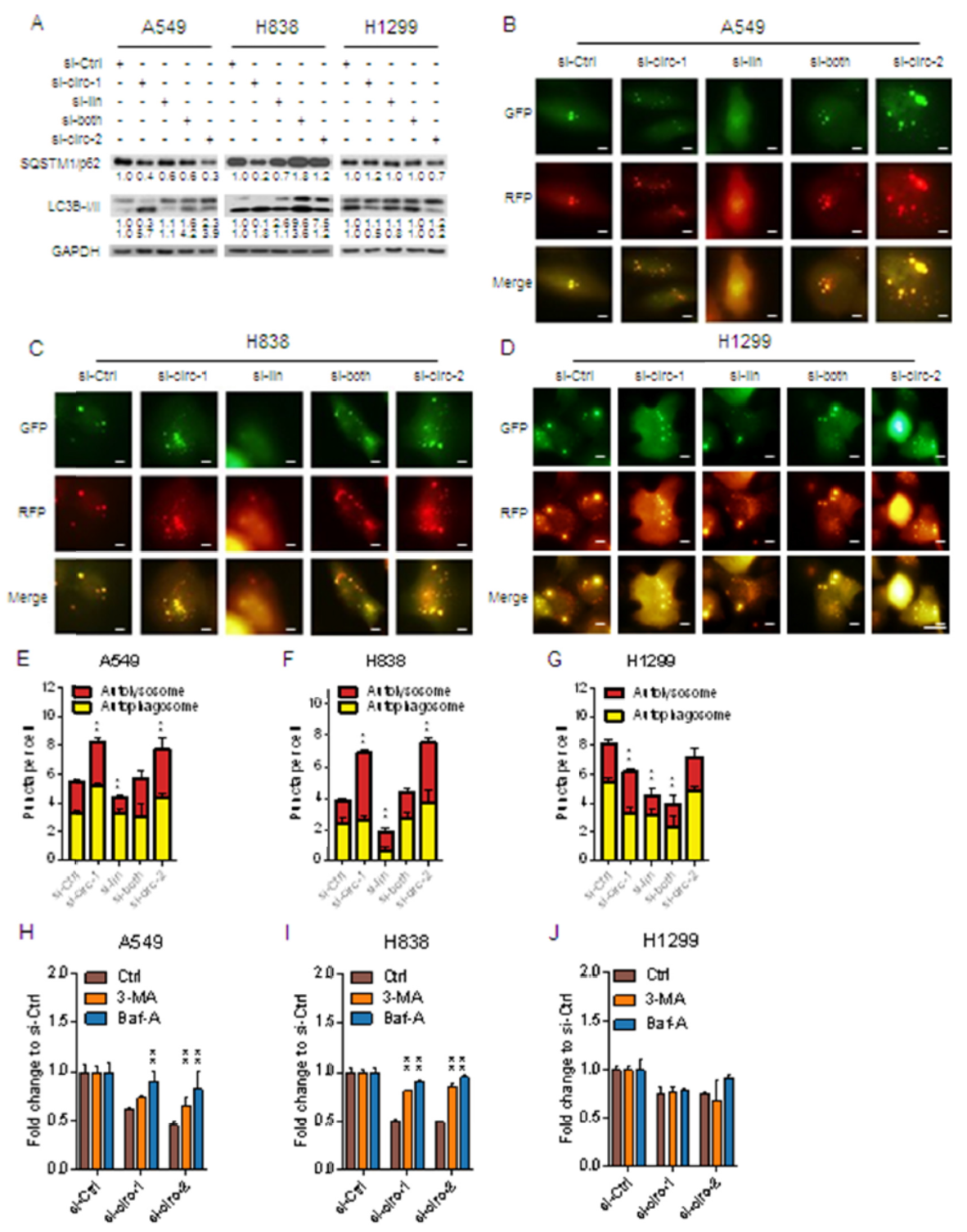
图3 cirHIPK3部分通过细胞自噬作用影响细胞增殖 ([1])
circHIPK3通过MIR124-3p/STAT3/PRKAA通路影响细胞自噬
MIR124-3p是已报道的有抑癌功能的miRNA,circHIPK3中存在MIR124-3p的结合位点,同时,MIR124-3p还可以靶向IL6R和STAT3。基于这些已知信息,作者验证了MIR124-3p/STAT3通路在circHIPK3与细胞自噬的相关性的机制,结果表明circHIPK3可通过竞争性结合MIR124-3p,促进STAT3通路的激活。三种细胞中干扰circHIPK3均可抑制STAT3通路,MIR124-3p的mimic也验证了这一现象,MIR124-3p的inhibitor阻断干扰circHIPK3对STAT3的影响。在三种细胞中STAT3的变化均可影响细胞自噬,A549 和H838中干扰circHIPK3能促进自噬,但H1299中却不能。三种细胞中干扰circHIPK3都可以影响STAT3的磷酸化,而干扰STAT3后三种细胞自噬均升高。这些发现表明circHIPK3对细胞自噬的影响与STAT3有关,但不是唯一的决定性因素。
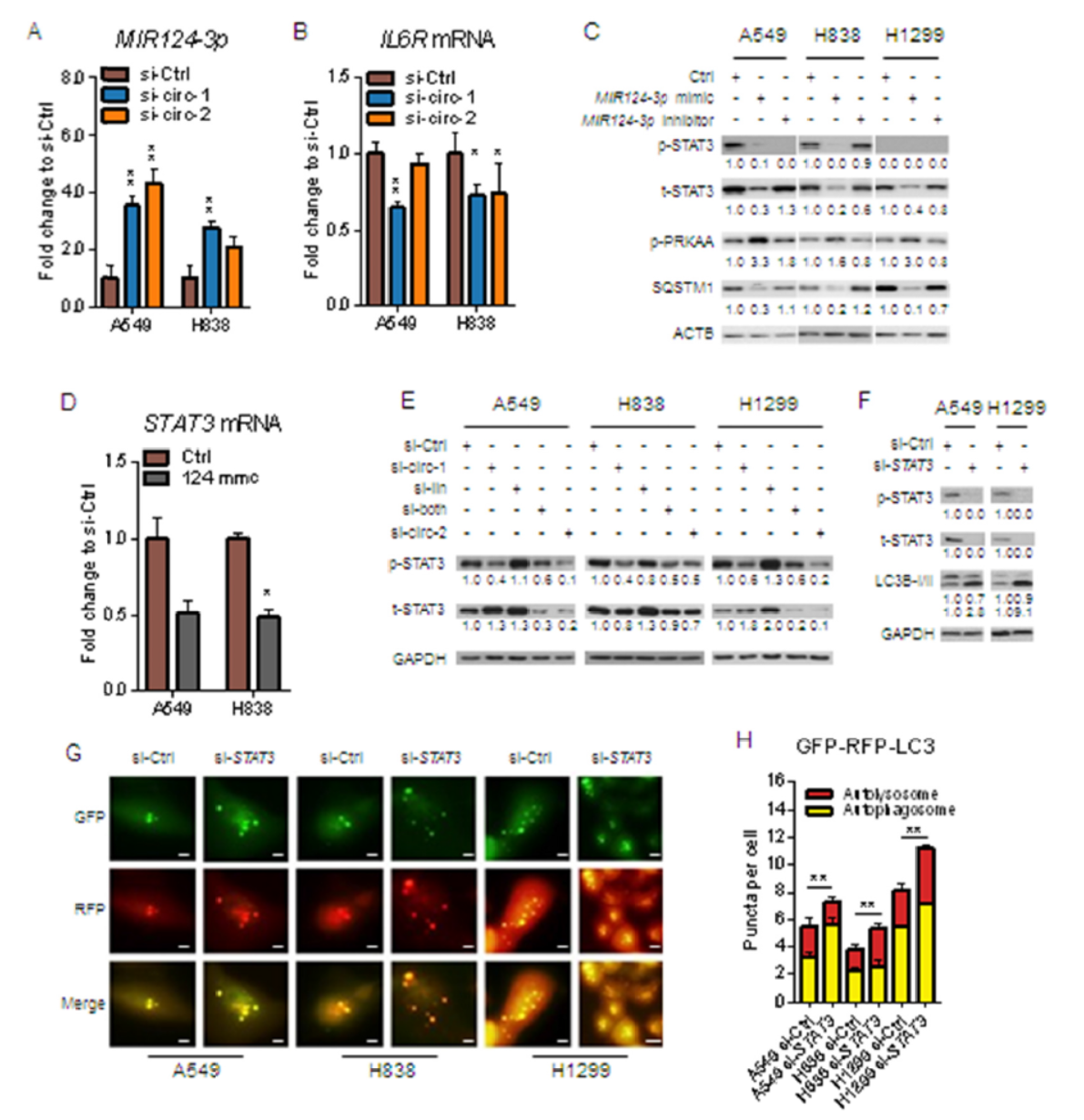
图4 circHIPK3通过MIR124-3p/STAT3通路影响细胞自噬 ([1])
为找出造成A549 和H838与H1299中干扰circHIPK3对细胞自噬影响差别的原因,作者Western分析了STK11和phospho-PRKAA/AMPKα的变化。结果发现干扰circHIPK3时A549 和H838中phospho-PRKAA/AMPKα增高,但在H1299中却降低。circHIPK3和线性HIPK3对phospho-PRKAA/AMPKα的效应也是相反的。在A549和H838中phospho-PRKAA的水平与STAT3磷酸化水平也是负相关的。在A549和H838中干扰PRKAA后,LC3B-I增多,自噬流降低,细胞自噬受到抑制。分别干扰STAT3和PRKAA看相互影响情况,结果表明在三种细胞系中均存在STAT3对PRKAA的调控作用,而PRKAA对STAT3的调控作用仅能在A549细胞中检测出。H1299细胞中,干扰circHIPK3可降低PRKAA的磷酸化,但干扰STAT3后PRKAA磷酸化却升高,说明H1299中存在其他的调控PRKAA的机制。
CCLE数据库中分析表明A549 和H838中STK11表达较低,但H1299中STK11表达丰度很高。H1299中干扰STK11后,再干扰circHIPK3就可以显著提高细胞自噬。这表明H1299中出现之前的特殊现象主要是因为存在高活性的STK11,导致PRKAA的旁路激活,抵消了circHIPK3通过STAT3影响PRKAA的效应。
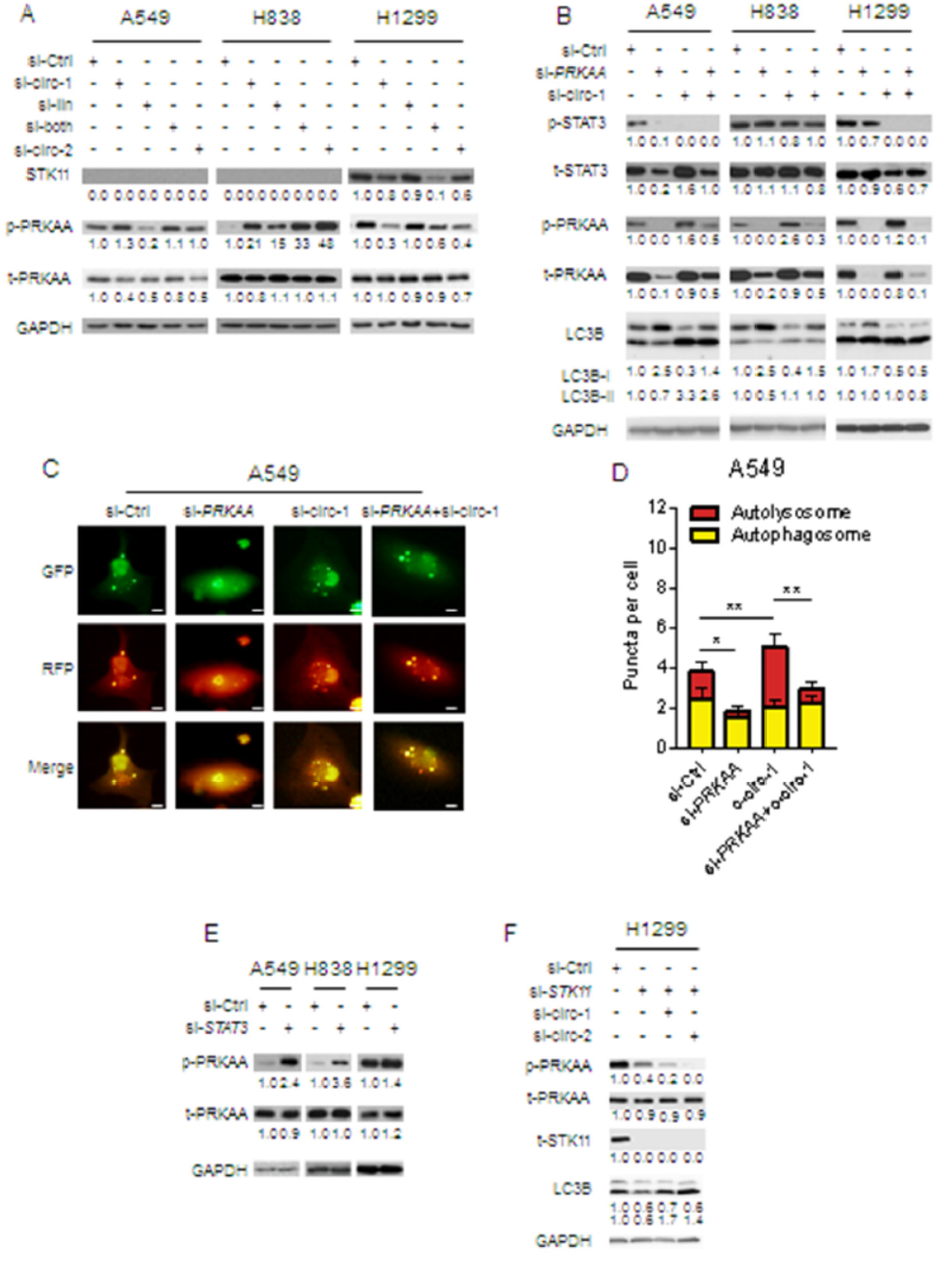
图5 MIR124-3p/STAT3/PRKAA通路影响细胞自噬 ([1])
肺腺癌中circHIPK3:linHIPK3升高与患者生存状态有关
临床标本中分析表明,癌组织与癌旁组织中circHIPK3表达丰度相近,但线性HIPK3的表达差别较明显,癌组织中线性HIPK3显著降低。通过统计circHIPK3:linHIPK3,发现在癌组织中这一指标显著增高,且与临床分期和预后有很高的相关性,这一比值越高,预后越差。
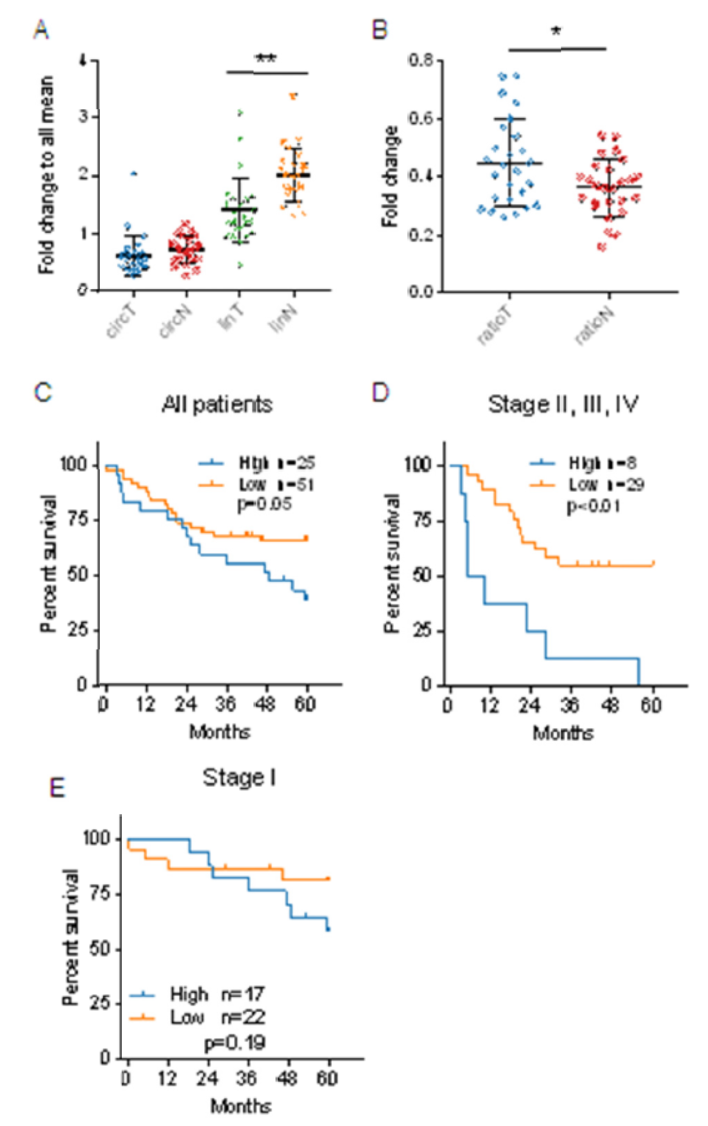
图6 circHIPK3:linHIPK3指标与肺腺癌临床预后关系 ([1])
circHIPK3调控细胞自噬机制模型
最后,本文通过较详细的探索分析,找出了一个circHIPK3调控细胞自噬的机制模型。在A549和H838细胞中,STK11携带突变,且表达较低。circHIPK3可竞争性结合并抑制MIR124-3p,STAT3和IL6R都是MIR124-3p的靶基因。高丰度的circHIPK3吸附了MIR124-3p,导致STAT3的磷酸化水平升高和活化,STAT3负调控PRKAA的活性。PRKAA活性与细胞自噬流正相关。因此在A549和H838细胞中,通过干扰circHIPK3能够最终促进PRKAA磷酸化和细胞自噬流升高。但在H1299中,存在野生型的STK11且表达丰度较高,该基因可直接作用于PRKAA并促进细胞自噬流,在H1299细胞中,干扰circHIPK3对PRKAA影响被高活性的STK11所掩盖。
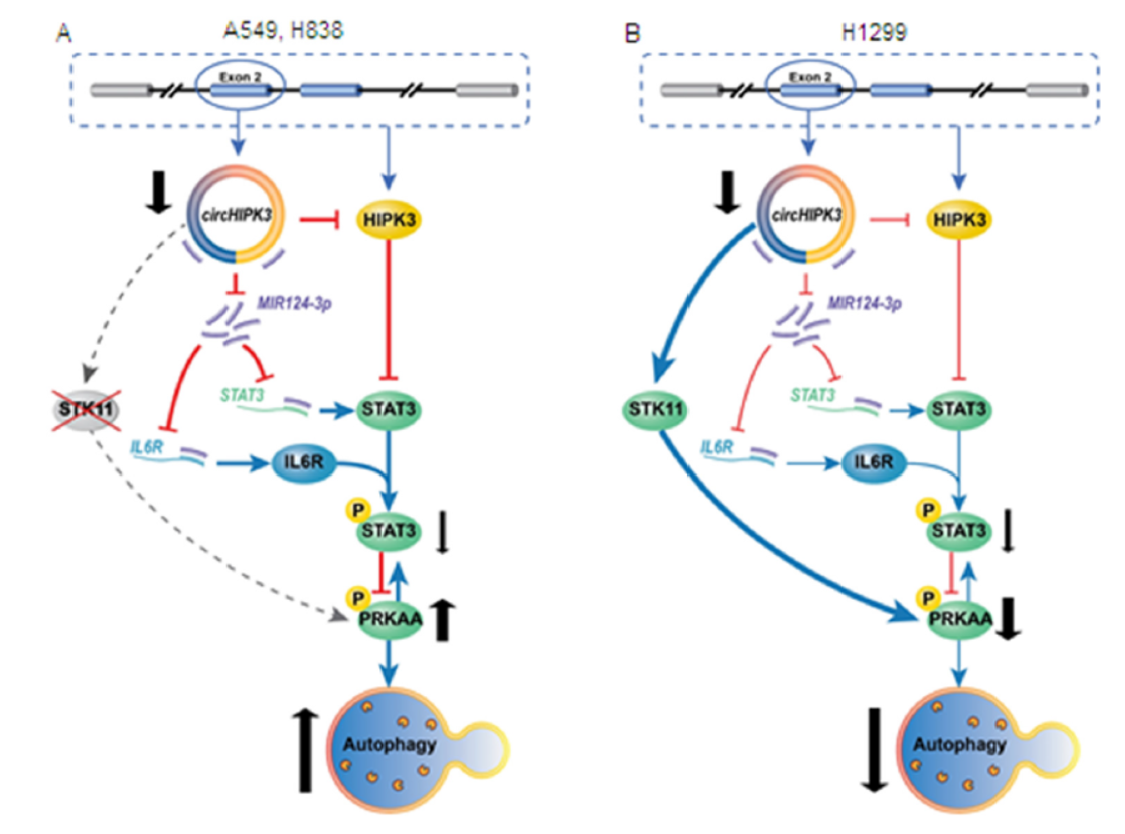
图7 肺癌中circHIPK3调控细胞自噬的机制 ([1])
参考文献:
1. Chen X, Mao R, Su W, Yang X, Geng Q, Guo C, Wang Z, Wang J, Kresty LA, Beer DG, Chang AC, Chen G. Circular RNA circHIPK3 modulates autophagy via MIR124-3p-STAT3-PRKAA /AMPKα signaling in STK11 mutant lung cancer. Autophagy, 2019 Jun 23. doi: 10.1080/15548627.2019
.png)