肿瘤恶病质是一组症状和体征,包括营养不良、厌食、虚弱、组织消耗和器官功能障碍等,常见于晚期转移的肿瘤,恶病质可在50%的肿瘤患者中出现,占恶性肿瘤患者死因的20%-40%,是肿瘤患者死亡的主要原因之一,然而,介导癌症诱发的肌肉消瘦的恶病质关键分子机制仍然不甚明确。最近发表于《Nature Communication》的最新研究成果显示肿瘤细胞通过细胞外囊泡(EVs)释放高水平的Hsp70和Hsp90分子,从而直接激活肌肉代谢,引起恶病质产生,阻断肿瘤细胞释放Hsp70和Hsp90相关EVs有望成为癌症恶病质的有效治疗策略。该研究思路清晰并提供了大量的体内外实验证据,是肿瘤微囊泡研究方面很好的范例,下面我们一起来了解下这篇文章的研究成果。
期刊: Nature communications
影响因子:12.124
作者单位:美国德克萨斯大学
研究概要
- 发现肿瘤恶病质诱导肿瘤细胞可持续释放Hsp70和Hsp90蛋白的现象;
- 发现胞外囊泡EVs是肿瘤细胞释放Hsp70和Hsp90蛋白的载体;
- 体内外实验证明肿瘤细胞释放EVs携带高表达的Hsp70/90是导致肌肉消瘦的关键步骤;
- 证明EVs (Hsp70和Hsp90)可通过TLR4诱导肌肉消瘦并引起系统性炎症反应;
研究结果
一、肿瘤恶病质诱导肿瘤细胞可持续释放Hsp70和Hsp90蛋白
首先,研究者筛选并分析了LCM(lewis肺癌细胞条件培养液)中的分解代谢成分,发现主要的分解代谢活动都集中在分子质量约为70-100kDa的片段。质谱分析揭示这些活性片段是高纯度的Hsp70、Hsp90α和Hsp90β。然后检测了不同恶病质诱导肿瘤细胞中的Hsp70和Hsp90水平,证实持续释放高水平Hsp70和Hsp90是恶病质诱导细胞的一个共同特征。体内实验也表明恶病质小鼠模型中血清Hsp70和Hsp90升高。
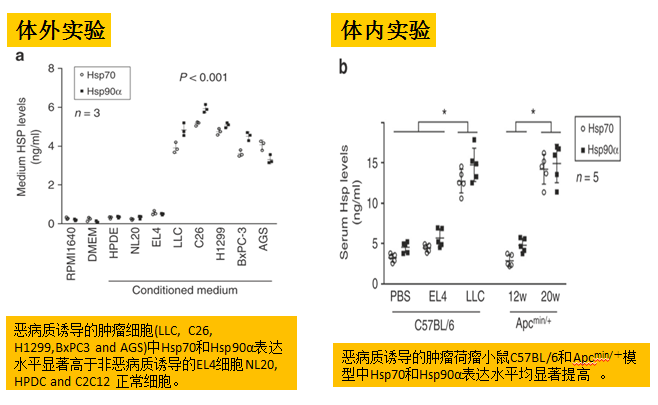
持续释放高水平Hsp70和Hsp90是恶病质诱导细胞的一个共同特征,高水平的Hsp70和Hsp90可以促进肌萎缩过程。
二、高水平的Hsp70和Hsp90与EVs相关
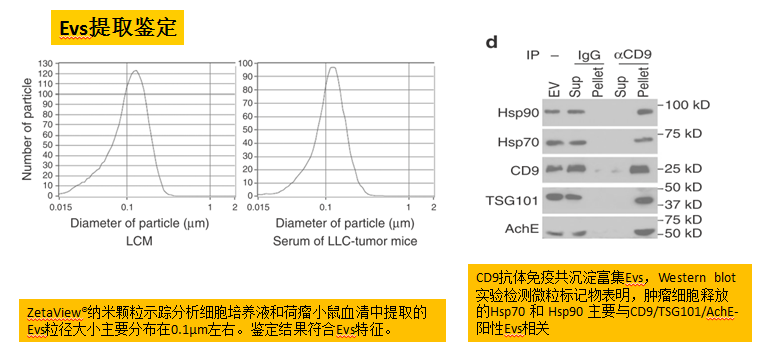
HSP分子没有信号肽序列,无法通过从内质网到高尔基体的传统路径介导蛋白分泌。不同细胞采用不同的非传统机制释放Hsp70和Hsp90,其中一种就是通过EVs在表面表达HSPs。研究者分离鉴定了LCM和LLC荷瘤小鼠血清中的EVs,并在EVs中检测到Hsp70和Hsp90。在Hsp70和Hsp90表达水平高的肿瘤细胞和荷瘤小鼠血清中均可检测到高水平的EVs,而采用去垢剂Brij98溶解EVs和血清后,Hsp70和Hsp90浓度成倍地显著上高。这些结果表明高水平的Hsp70和Hsp90与EVs相关。
肿瘤细胞释放的EVs (Hsp70和Hsp90)可诱导C2C12细胞肌萎缩
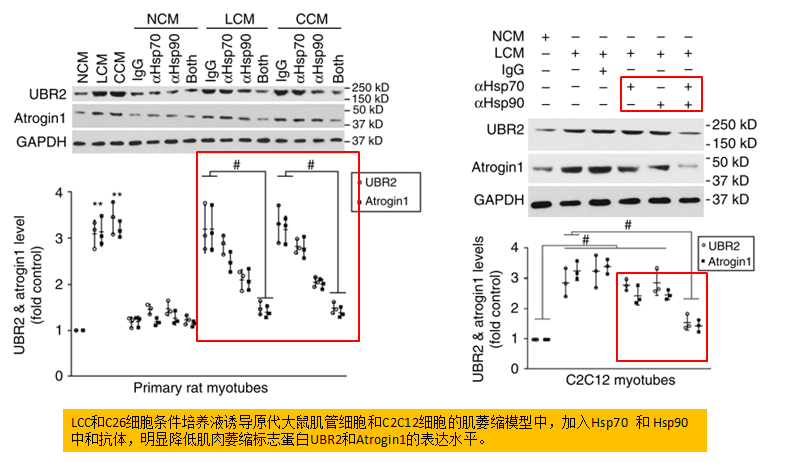
三、肿瘤细胞释放的EVs (Hsp70和Hsp90)对诱发肌肉消瘦是必要的和足够的。
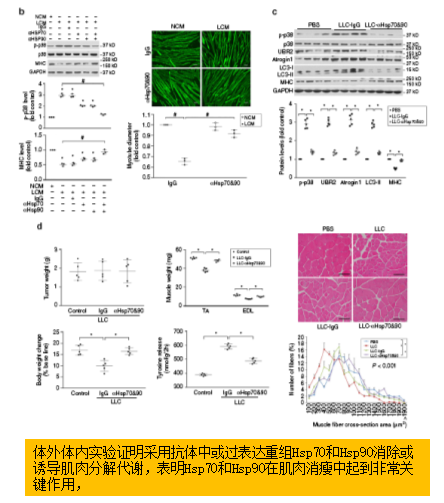
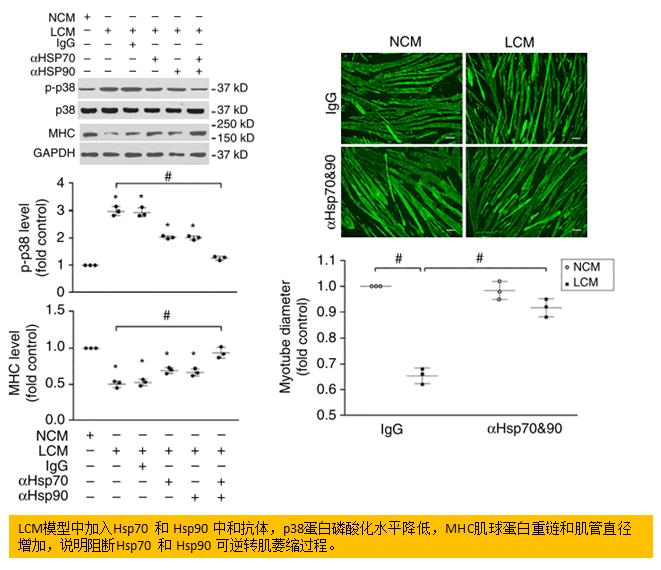
以往的研究表明,LCM通过p38 MARPK通路来激活C/EBPβ上调atrogin1和UBR2。体外体内实验中,抗体中和Hsp70和Hsp90均可阻碍LCM诱导的p38 MARPK激活,并消除对小鼠体重和肌肉等系列指标的影响,验证了Hsp70和Hsp90在诱发肌肉消瘦中的关键作用。而使用重组Hsp70和Hsp90处理肌管后可重新诱导肌肉的分解代谢。
肿瘤细胞释放的EVs (Hsp70和Hsp90)对诱发肌肉消瘦是必要的和足够的。
。
四、肿瘤细胞表达的Hsp70和Hsp90是诱发肌肉消瘦的关键。
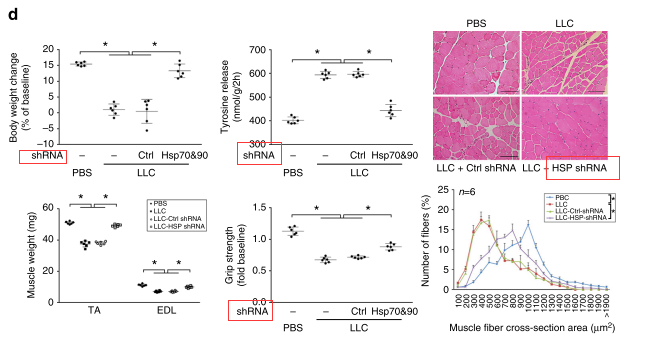
LLC细胞中,采用siRNA敲低Hsp70和/或Hsp90,而这种缺陷型细胞的调整培养基失去了诱导肌管分解代谢的能力。稳定敲低Hsp70和Hsp90构建荷瘤小鼠后发现,小鼠血清Hsp70和Hsp90也不显示升高,同时,Hsp70和Hsp90缺陷LLC肿瘤不会诱导肌肉分解代谢和肌肉消瘦。
siRNA敲低Hsp70和/或Hsp90后诱导肌管分解代谢的能力随之缺失
五、肿瘤细胞释放的EVs (Hsp70和Hsp90)可导致肌肉消瘦。
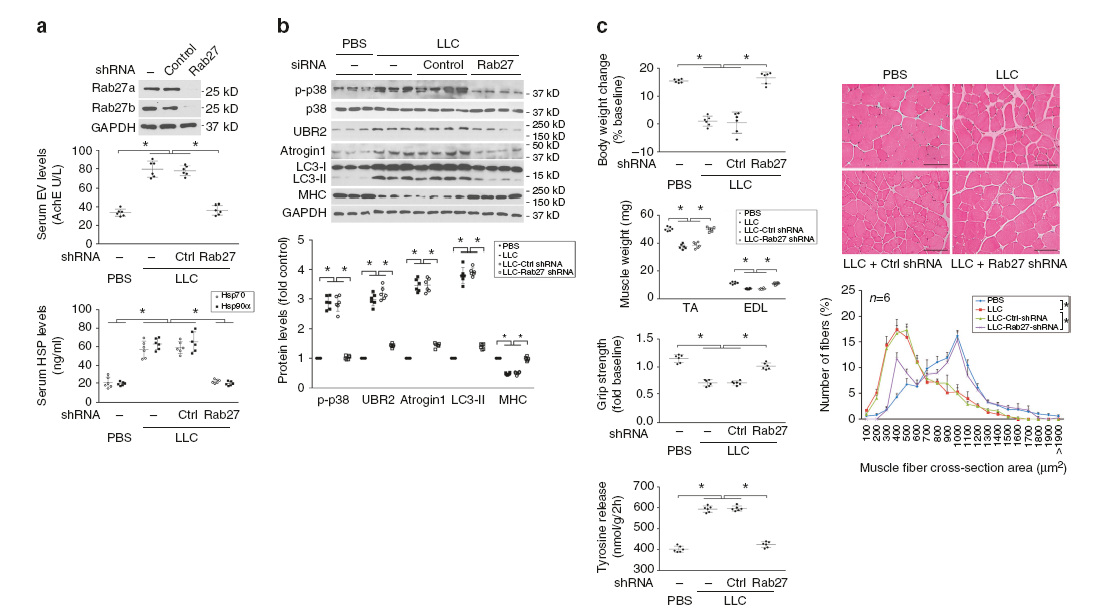
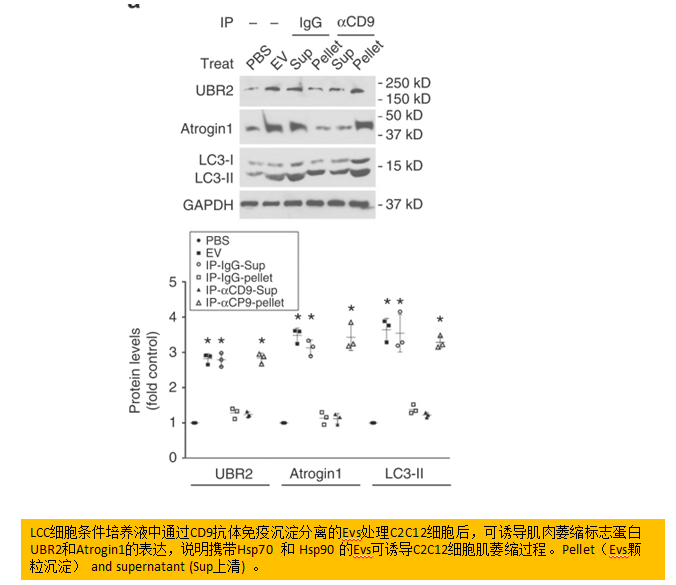
自LCM分离获取EVs并用来处理C2C12肌管,发现LLC释放的EVs以剂量依赖的方式,通过上调UBR2和atrogin1引起分解代谢反应。通过CD9-免疫沉淀的EVs处理C2C12肌管进一步验证了CD9阳性EVs在分解反应中起作用。相反地,敲低Rab27a和Rab27b(控制EVs释放的不同步骤中的GTPase)破坏肿瘤细胞释放EVs后发现,Rab27丢失会阻止EVs、Hsp70和Hsp90的释放,而不影响肿瘤细胞中Hsp70/90和AChE的表达,导致肌管的分解反应。体内实验也证明敲低Rab27a和Rab27b阻止了血清EV和Hsp70/Hsp90的非正常升高,而小鼠也免受肌肉分解代谢和肌肉消瘦。
肿瘤细胞释放EVs携带高表达的Hsp70/90是导致肌肉消瘦的关键步骤
六、肿瘤细胞释放的EVs (Hsp70和Hsp90)可通过TLR4诱导肌肉消瘦
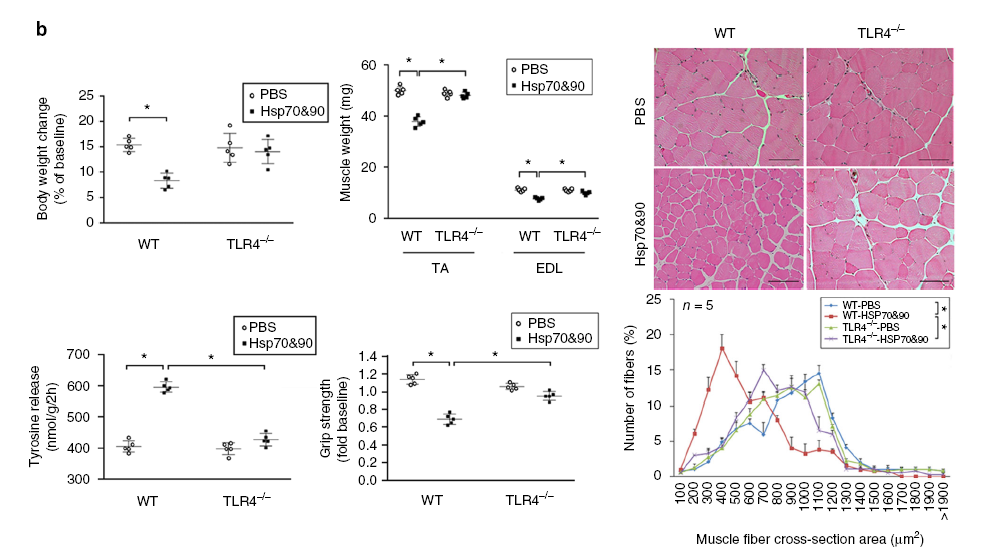
Hsp70和Hsp90被认为是DAMPs,通过激活免疫细胞上的TLR2和TLR4来驱动先天免疫反应。EV相关HSPs可以激活受体细胞上的HSP受体,而TLR2和TLR4也在骨骼肌肉细胞上表达,因此,研究者猜想Hsp70/90通过激活TLR2/4诱导肌肉代谢。
在C2C12肌管中敲低TLR2或TLR4发现肌管对重组Hsp70和Hsp90的分解反应需要TLR4而不是TLR2。细胞实验发现分解反应的激活确实表现为TLR4依赖。此外,体内实验证明TLR4在Hsp70和Hsp90诱导的肌肉代谢中至关重要,TLR4缺陷可以消除重组Hsp70和Hsp90诱导的小鼠肌肉消瘦。
七、肿瘤细胞释放的EVs (Hsp70和Hsp90)可引发系统炎症
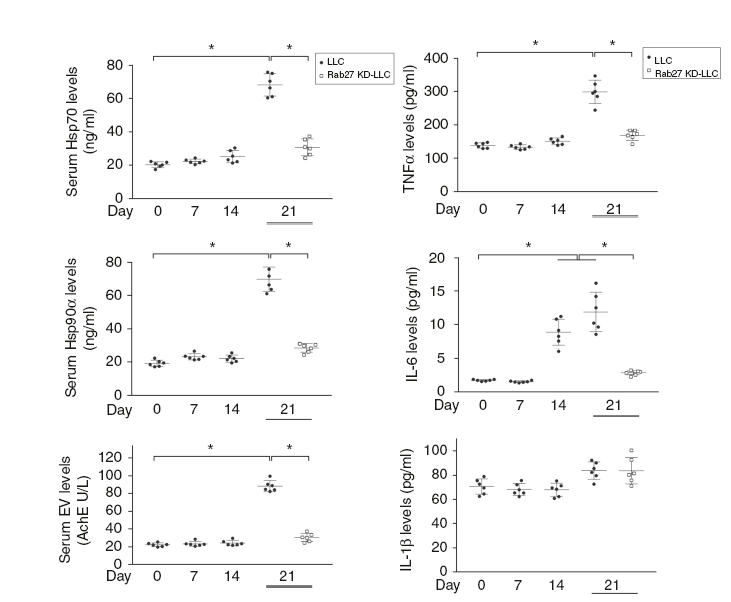
在LLC荷瘤小鼠发展为恶病质的不同时间点,检测血清中的细胞因子包括TNFα、IL-6、IL-1β和EVs、Hsp70和Hsp90。TNFα在21天后发展为恶病质时升高,IL-6在14天后升高;而在EVs、Hsp70和Hsp90未升高的Rab27缺陷小鼠中,血清TNFα和IL-6也未见升高,表明血清Hsp70和Hsp90介导肿瘤宿主中炎症细胞因子的升高。至于PTHrP,之前曾有报导可能通过将白色脂肪组织转化为棕色而又打肌肉消瘦,但在本文的恶病质模型中并未发现异常释放。
小鼠血清来源的EVs(Hsp70和Hsp90)可介导炎症细胞因子的升高,引发系统炎症
结语
EVs是细胞释放的膜囊泡,可以分为三类:微泡、凋亡小体和外泌体。外泌体一般为30-150nm,是三者中最小的一类,由肿瘤细胞大量释放到调整培养基和体液中。本研究中检测到的肿瘤释放到调整培养基和血清中的EVs大小约为110nm、表达标志物CD9/TSG101/AchE,这些特征均与外泌体一致。作者为了遵循外囊泡国际协会的建议采用了“外囊泡”的说法。本研究中多次运用功能缺失性和获得性实验证实了,肿瘤细胞通过释放细胞外Hsp70和Hsp90促进肌肉消瘦,引起恶病质。此外,Hsp70和Hsp90可能通过直接作用于受体或间接地增加循环炎症因子,在不同器官上发挥着肿瘤病理效应。这不仅有助于阐述Hsp70和Hsp90在肿瘤诱导肌肉消瘦中的作用,也有助于理解肿瘤是如何影响机体全身代谢的,为癌症恶病质的有效治疗策略方面提供了理论基础。
.png)