图片摘要:circRNA翻译越来越受到关注,这种“没头没尾”的RNA分子是怎么被翻译的?这篇综述汇总了目前circRNA研究的进展,值得一读。
2019年6月29日,法国图卢兹大学的Eric Lacazette在Biochimie (IF=3.362)杂志上发表了一篇题为“How are circRNAs translated by non-canonical initiation mechanisms?”的综述,阐述了circRNA如何在非帽子依赖启动过程中的翻译,并将这种非传统的翻译途径与细胞应激联系起来,介绍了这一新兴领域的最新进展。([1])。

环状RNA(circRNA)是由大量真核基因产生的共价闭合RNA环。由于其呈圆形,因此最初被归类为非编码RNA。然而,最近基于质谱分析的研究表明,某些胞质circRNA可有效翻译为可检测的肽。这就提出了一个有趣的问题,由哪种机制来调节circRNA的翻译起始,即无法通过5’帽募集小核糖体亚基。
circRNA的产生、分类和功能
circRNA作为一种新兴的ncRNA,它们是由部分的蛋白质编码基因或其它转录本反向剪接或环化而产生的。circRNA产生过程中,下游剪接供体与上游剪接受体共价连接,产生环状ssRNA产物。反向剪接是通过重复序列的互补配对来实现,例如Alu元件、侧翼环状区和RNA结合蛋白(RBP)。
circRNA大致可分为三种类型:外显子circRNA(EcircRNA),它只包含外显子,代表了circRNA的大部分;内含子circRNA(CiRNA),它只包含内含子;外显子-内含子circRNA(EIciRNA),它同时包含外显子和内含子。
circRNA经典和主要功能是作为特定miRNA的分子海绵,调节mRNA的稳定性和翻译。此外,circRNA还作为蛋白质的海绵,作为蛋白质、mRNA和DNA的辅助或调控分子,以及作为翻译的模板。
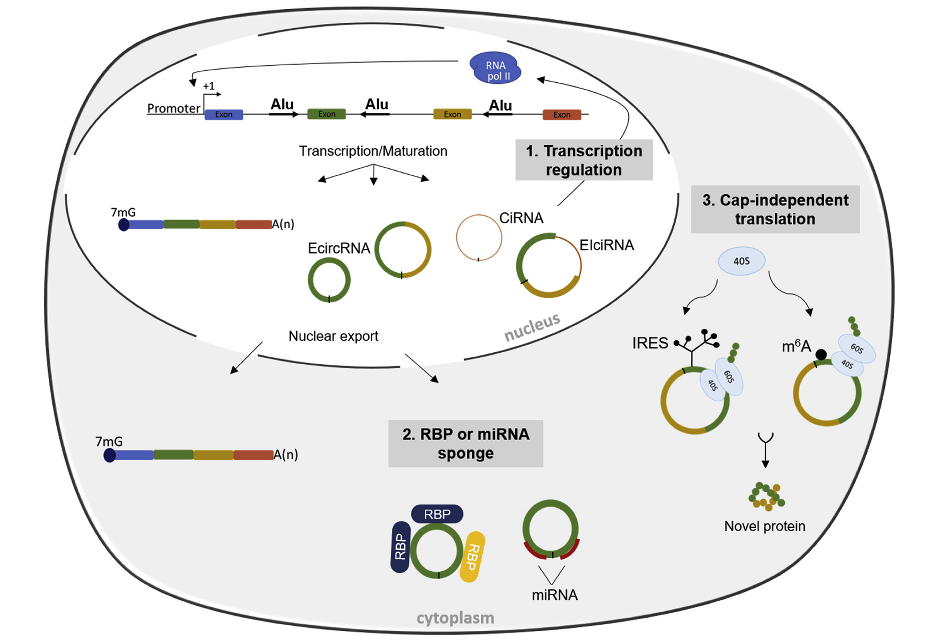
图1 circRNA的发生和功能([1])
IRES驱动的circRNA翻译
circRNA的环状结构表明必然存在非帽子依赖性的翻译机制。目前有两种机制,一种可能性是IRES(内部核糖体进位点)的存在,IRES是可以在RNA上形成二级结构的序列,在完全或部分缺乏经典翻译起始因子的情况下允许翻译启动。IRES在应激条件下具有特别的功能,它们允许维持或激活装有IRES的RNA翻译,为细胞提供生存所需的重要蛋白质。
IRES驱动的circZNF609翻译
circZNF609是ZNF609基因外显子2的反向剪接产物,编码锌指蛋白家族中一个特征不佳的转录因子。有趣的是,circZNF609的开放性阅读框(ORF)与其mRNA对应的ORF起始于相同的AUG起始密码子,但是终止密码子在circZNF609反向剪接位置后。在RNaseR处理后的重多核糖体组分中发现了circZNF609,这支持了它在细胞翻译中的作用。报告分析中,在IRES的萤火虫荧光素酶构建体中加入内源内含子序列的小片段,获得了比EMCV更强的IRES活性。它表明IRES活性所必需的因子可能是通过剪接招募的。例如,参与剪接的hnRNP家族的蛋白可以被招募到细胞核的circRNA上,然后在胞浆中作为IRES反式作用因子(ITAF)。此外,circZNF609的蛋白质产量在热休克应激后增加,这被认为可以激活IRES活性并调节选择性剪接。压力和circRNA翻译启动之间可能存在功能联系。
IRES驱动的circSHPRH翻译
circSHPRH与circZNF609相同,它的翻译也依赖于反向剪切。值得注意的是,circSHPRH产生了一种新的含有146个氨基酸的蛋白质,通过质谱检测到了该蛋白质,并作为诱饵显示抑制肿瘤的活性,保护了相关的全长SHPRH蛋白不被降解。
IRES驱动的circFBXW7翻译
circFBXW7,来源于FBXW7, 是由外显子3~4的反向剪接,形成620nt的环状RNA。在circFBXW7中发现了一个120nt长的IRES,它位于AUG的上游和反向拼接接头的下游。反向拼接接头序列的部分缺失导致IRES活性下降。circFBXW7可以翻译成含有185个氨基酸的蛋白质(FBXW7-185aa)。不幸的是,并没有证明IRES的功能可以跨越剪接位点。胶质母细胞瘤临床标本表达分析证实了FBXW7-185aa在体内的有效翻译和潜在的抑瘤活性。
IRES驱动的circβ-catenin翻译
circβ-catenin是由β-catenin基因的第2-7外显子反向剪接而成,形成一个1129nt的环状小分子。它与线性β-catenin的mRNA有相同的起始密码子,ORF的终点跨越剪切位点。它通过IRES启动翻译编码含370个氨基酸的蛋白质。进一步的实验表明,该蛋白通过激活Wnt通路促进肝癌细胞在体内外的生长。通过充当β-catenin的诱饵,保护它免受降解,从而促进其活性。
m6A驱动的circRNA翻译
另一种机制是N6-甲基腺苷(m6A)残基的存在,它是启动真核细胞翻译的第三种方式。m6A残基在所有circRNA序列上都是富集的,并且单个的m6A足以启动翻译。circRNA m6A启动的翻译依赖于eIF4G2因子和YTHDF3 m6A阅读器。m6A启动翻译的机制尚不清楚,但涉及甲基转移酶METTL3、METTL14和Wilm肿瘤相关蛋白。这个过程是可逆的,因为m6A的翻译可以被去甲基化酶FTO和ALKBH5抑制。它在热休克或METTL3/14过表达的应激条件下被激活,并被FTO去甲基化酶抑制。有趣的是,依赖m6A的翻译的启动似乎在压力条件下受到精确调控,并可能构成一种额外的机制,以调节在压力状况下特定转录库的翻译,与IRES同行。
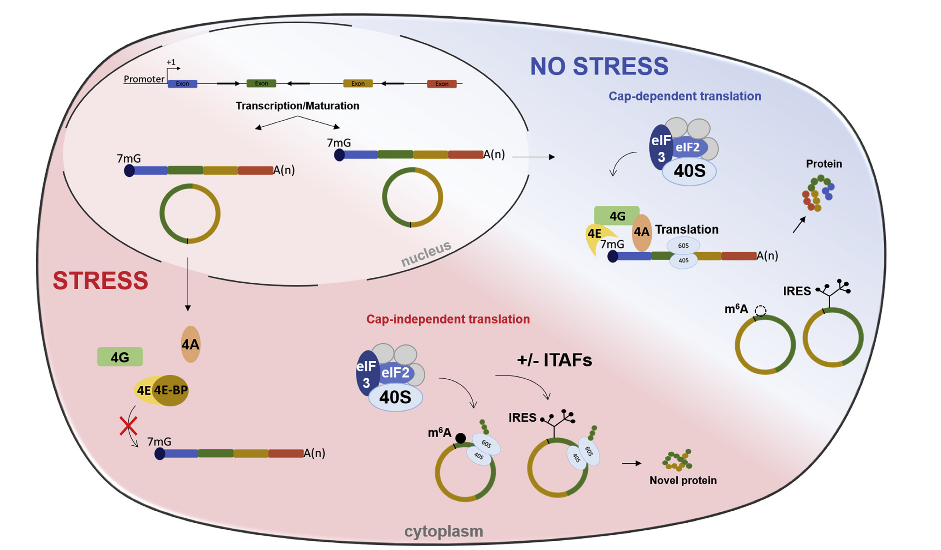
图2 circRNA的翻译([1])
参考文献:[1]Leïla Halidou Diallo, Tatin F , Florian D , et al. How are circRNAs translated by non-canonical initiation mechanisms?[J]. Biochimie, 2019, 164.
.png)