图片摘要:m6A修饰可调控circRNA的生成和翻译,本文在circZNF609上进行了验证分析。
近期不断有circRNA m6A修饰相关的研究报道。5月12日,Cell Reports在线发表了一项研究,系统分析了m6A修饰对circZNF609的生成和翻译调控的机制([1])。文章的通讯作者是意大利罗马萨皮恩扎大学的Irene Bozzoni教授。Irene Bozzoni教授主要研究非编码RNA的功能和机制,此前曾报道发现circZNF609可以以不依赖帽子的方式翻译(推荐阅读:Cell子刊连续两篇环状RNA翻译蛋白文章发表!),也曾分析了circZNF609在横纹肌肉瘤中的作用,报道了FUS介导运动神经元circRNA 表达(推荐阅读:运动神经元中FUS介导环状RNA形成)。

敲低METTL3影响circRNA的m6A修饰和表达
基于meRIP-QPCR检测,作者发现Hela细胞中circZNF609和对应线性lin-ZNF609均携带了m6A修饰。METTL3是主要的介导RNA m6A修饰的Writer,敲低METTL3后,作者发现意外的发现circZNF609的表达下降了,而lin-ZNF609及转录前体pre-ZNF609均升高。这似乎暗示m6A修饰可以介导转录产物的去向,是生成circRNA还是加工成mRNA。那么这个现象是ZNF609基因特异的,还是普遍存在的?作者通过高通量测序分析了敲低METTL3前后Hela细胞的转录组,发现circRNA和mRNA的表达均有变化,其中下调的circRNA有442种,上调226种,也有一些mRNA表达值发生了变化。那么这些有变化的circRNA所对应的mRNA是否也有变化呢?统计发现只有18.6%的circRNA所对应的mRNA也存在变化。这些测序数据分析表明,大部分的circRNA 表达变化不与母基因同步,可能存在特异性的机制。
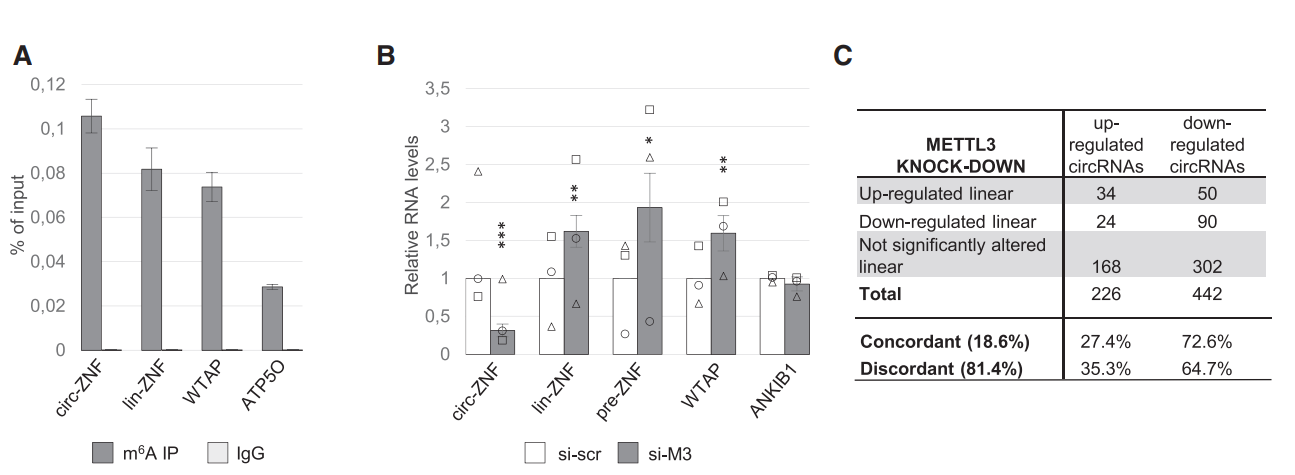
图1敲低METTL3影响circRNA的m6A修饰和表达 ([1])
YTHDC1调控circRNA反向剪切
YTHDC1是核内m6A Reader的一种,之前曾报道它与RNA可变剪切有关。YTHDC1是否与circRNA的生成有关呢?为探索这个问题,作者设计分析敲低YTHDC1对circRNA的影响。结果表明,敲低YTHDC1后circZNF609下降,lin-ZNF609不变,而pre-ZNF609升高。高通量测序分析结果显示,敲低YTHDC1显著改变了一些circRNA和mRNA的表达状态。Anti-YTHDC1 RIP测序表明,78%的circRNA能被显著富集2倍以上,但它们所对应的线性RNA没有这么显著的差异。敲低YTHDC1后测序结果,有482种circRNA下调,278种上调。为方便分析,作者把敲低METTL3和YTHDC1后测序的结果中下调的circRNA分为三组:只在敲低METTL3下调的(227种),只在敲低YTHDC1下调的(247种),敲低METTL3和YTHDC1均下调的(45种)。通过与meRIP,Anti-YTHDC1 RIP测序结果对比,发现敲低METTL3和YTHDC1均下调的circRNA被m6A-RIP富集的程度显著高于其他组。最后作者挑选了几个circRNA分子验证了敲低YTHDC1或METTL3前后的变化情况,与测序的结果基本一致。
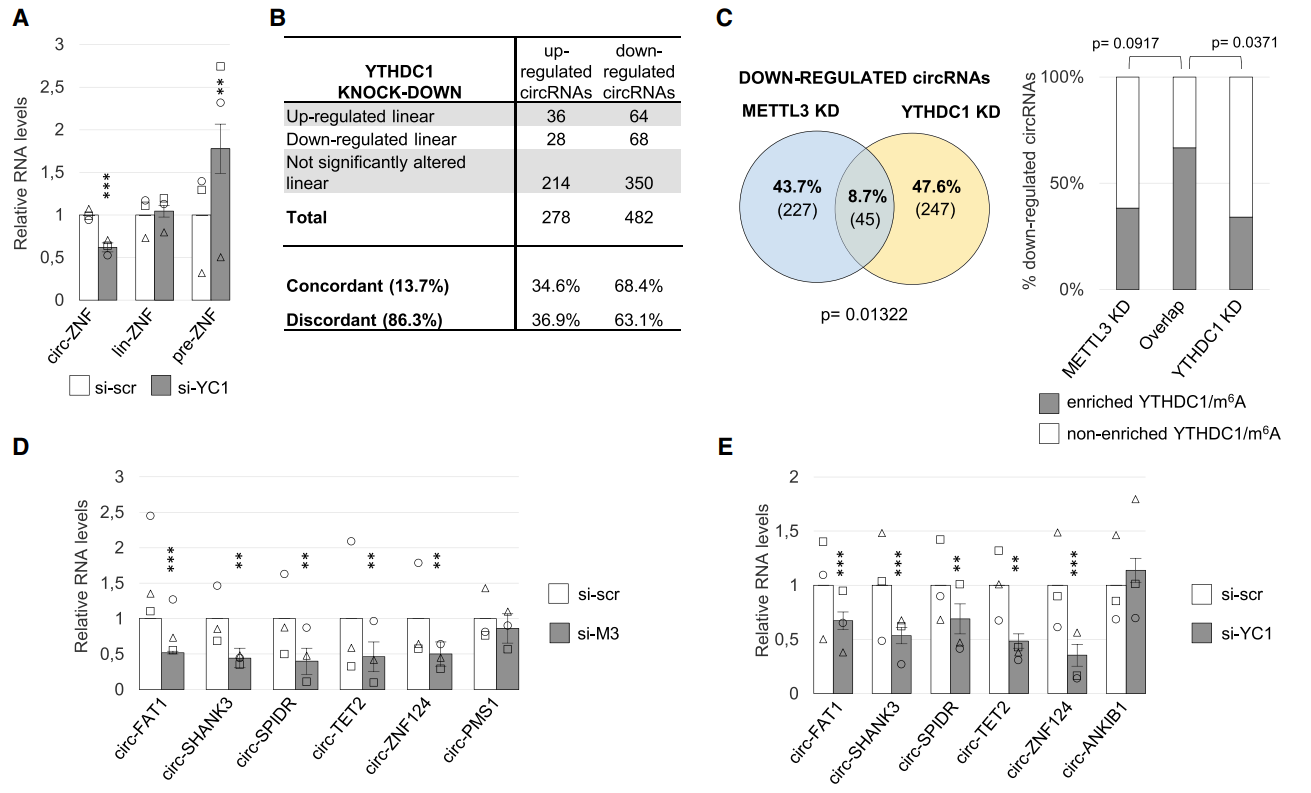
图2 YTHDC1调控circRNA反向剪切 ([1])
受METTL3/YTHDC1调控表达的circRNA有特殊的m6A修饰
上面的结果显示,有一些circRNA的生成是受到METTL3/YTHDC1调控的,那么这些circRNA外显子的m6A修饰是否有不一样的地方呢?m6A CLIP数据能更准确的定位m6A修饰位点,实验中input的RNA可以是PolyA(+)-RNA,也可以是总RNA,并且可以通过分离胞质和核组份进一步分类。为获得circRNA的m6A修饰位点信息,作者采用比较总RNA和PolyA(+)-RNA的m6A CLIP数据,那些存在于总RNA中,但不在PolyA(+)-RNA的m6A CLIP数据信息(total-only m6As),可以理解为circRNA特异性的m6A修饰信息。分析表明,敲低METTL3和YTHDC1均下调的circRNA所携带的total-only m6As的比例显著高于其他组,胞质和核内均呈现出这一趋势。以ZNF609的第二外显子为例,这个外显子形成了circZNF609,m6A CLIP数据显示,扣除了PolyA(+)-RNA的m6A位点(位点2,3)后,circZNF609有三个total-only m6As(位点α,β,γ),胞质和核内的基本一致。
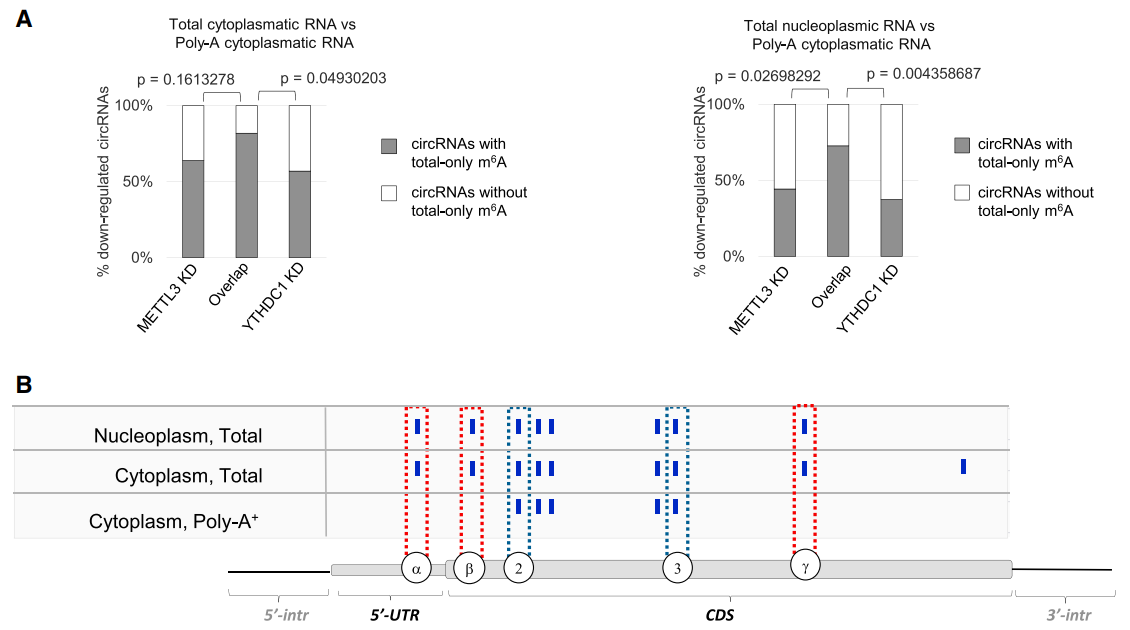
图3受METTL3/YTHDC1调控表达的circRNA有特殊的m6A修饰 ([1])
特殊m6A修饰调控circANF609的生成
上述结果表明,一些circRNA特有的m6A位点与circRNA的生成可能有关系,为分析具体的机制,作者基于过表达载体进行了分析。该载体的侧翼序列与基因组中的侧翼内含子不同。鉴定实验表明,这个过表达载体可以有效表达circZNF609,产物也可携带m6A修饰,敲低METTL3和YTHDC1均可影响这一载体的表达效率。为分析不同m6A修饰位点对m6A修饰生成效率的影响,作者将上述的PolyA(+)-RNA m6A位点(位点2,3),circZNF609特有的total-only m6As(位点α,β)以及阴性对照位点1分别构建了突变体,分析突变对对应产物表达效率的影响情况。结果显示,突变1,2,3位点不影响circRNA和前体RNA的生成效率,仅突变α,β位点也不能影响,但如果同时将位点2 与α,β一起突变,circZNF609生成显著受到抑制,转录前体RNA增多,与细胞中敲低YTHDC1的现象吻合。进一步,作者设计了不成环的载体作为对照,中间的序列与上述载体一致,这种不成环的载体中单独突变位点2或与α,β一起突变均不能影响RNA的表达。能成环的载体不突变的时候,敲低YTHDC1可降低成环产物表达,但位点2或与α,β一起突变后这种降低效应消失。
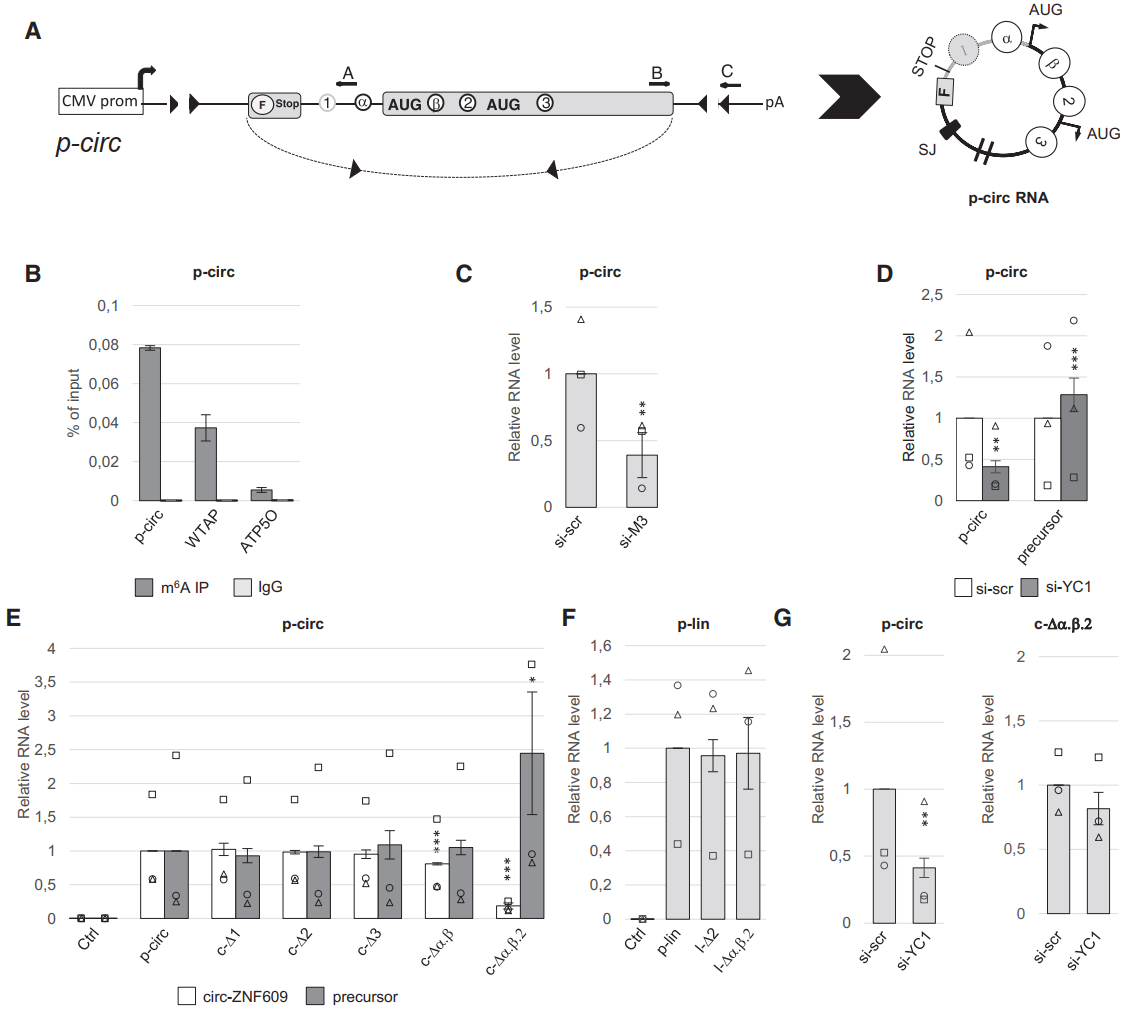
图4特殊m6A修饰位点调控circANF609的生成 ([1])
m6A修饰调控circZNF609翻译
已知m6A修饰可以介导circRNA的翻译起始,在circZNF609中,这些m6A修饰位点是否也可以有这个作用呢?基于上述的载体设计,作者构建了Flag融合的in-frame的过表达载体,然后分别针对几个位点进行突变,比较突变前后蛋白翻译产物的影响。结果表明,位点2或与α,β一起突变能显著抑制蛋白产物的翻译,但对应的线性RNA转录产物表达没有受到影响。分别敲低YTHDF1-3,看circZNF609翻译产物的变化,表明YTHDF3与circZNF609的翻译有关,过表达YTHDF3能促进circZNF609的翻译。如果对应的序列以线性RNA进行表达,则没有这个现象。此前报道eIF4G2与m6A修饰介导circRNA翻译起始有关,作者也分别分析了敲低或过表达eIF4G2后circZNF609翻译的情况,表明eIF4G2参与调控了circZNF609的翻译。YTHDF3和eIF4G2的RIP实验证实了两种蛋白均可与circZNF609结合。
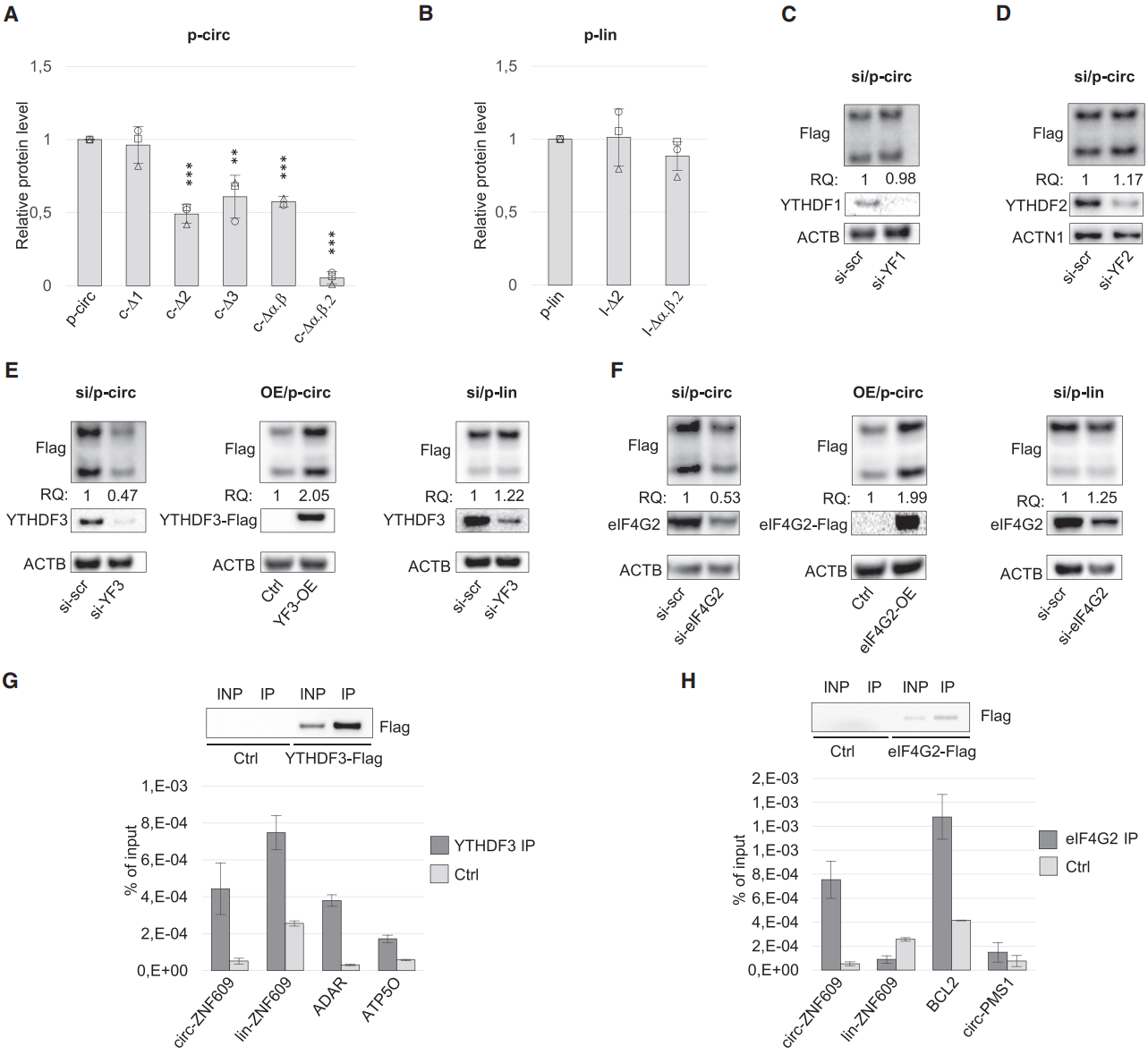
图5 m6A修饰调控circZNF609翻译 ([1])
本文的工作主要分析了circZNF609中m6A修饰对其生成效率和翻译的作用,高通量测序分析敲低METTL3,YTHDC1的表达谱结果表明体内存在一类circRNA与circZNF609一样,可以通过METTL3/YTHDC1途径调控表达,并且大部分circRNA的表达与母基因mRNA的表达没有必然关系。
参考文献:
1. Di Timoteo, G., et al., Modulation of circRNA Metabolism by m(6)A Modification. Cell Rep, 2020. 31(6): p. 107641.
.png)