Ribonuclease R (RNase R)是一种核糖核酸外切酶,广泛应用于circRNA的鉴定、富集和相关实验。笔者注意到很多研究人员在使用中碰到了一些问题和“奇怪”的现象,下面就来简单的梳理一下,并在参考文章和资料的基础上给出解释和建议。
1 RNase R的功能
RNase R来源于大肠杆菌RNR超家族,可以从3’-5’方向切割降解RNA,能够消化几乎所有的线性RNA分子,但不易消化呈环形的RNA、套索结构或3’端突出末端少于7 nt的双链RNA分子(Cheng ZF et al., 2002)。
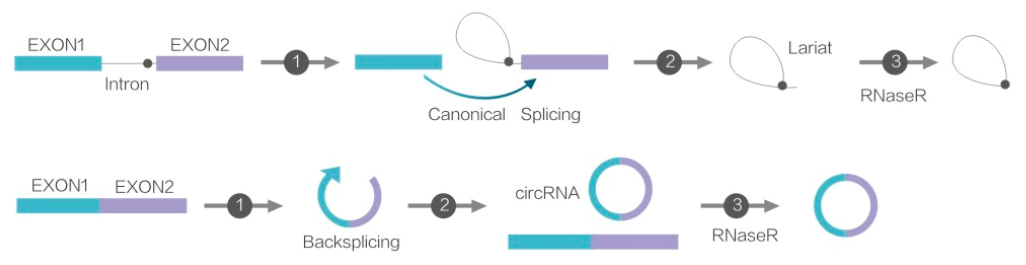
图1 RNase R消化RNA示意图(吉赛生物)
2 RNase R的反应体系
关于RNase R的具体使用量和反应体系,不同参考文章里也有差别,常见的为10 μL或20 μL反应体系,使用比例为3U RNase R/μg RNA,下图是一个推荐的反应体系。
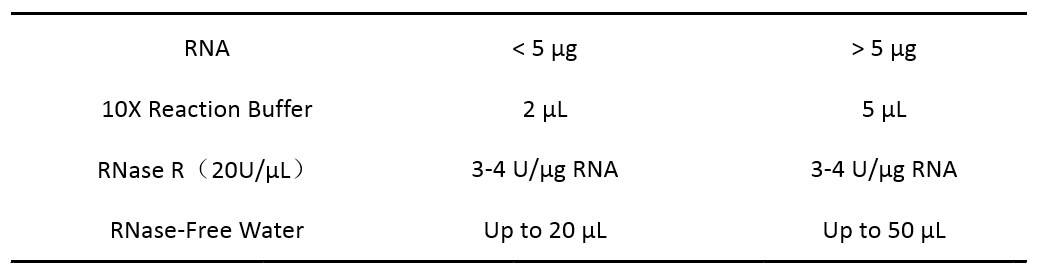
图2 RNase R消化反应体系(吉赛生物)
3 什么时候用?
RNase R主要用于circRNA的鉴定和富集实验,需要根据具体的实验内容和目的来决定是否进行RNase R消化。
3.1 circRNA的鉴定
circRNA的鉴定常使用RT-PCR(图3, 4)和Northern blot实验(图5,6),根据RNase R(+)和RNase R(-)组中是否检测到条带来证明检测的分子是circRNA。
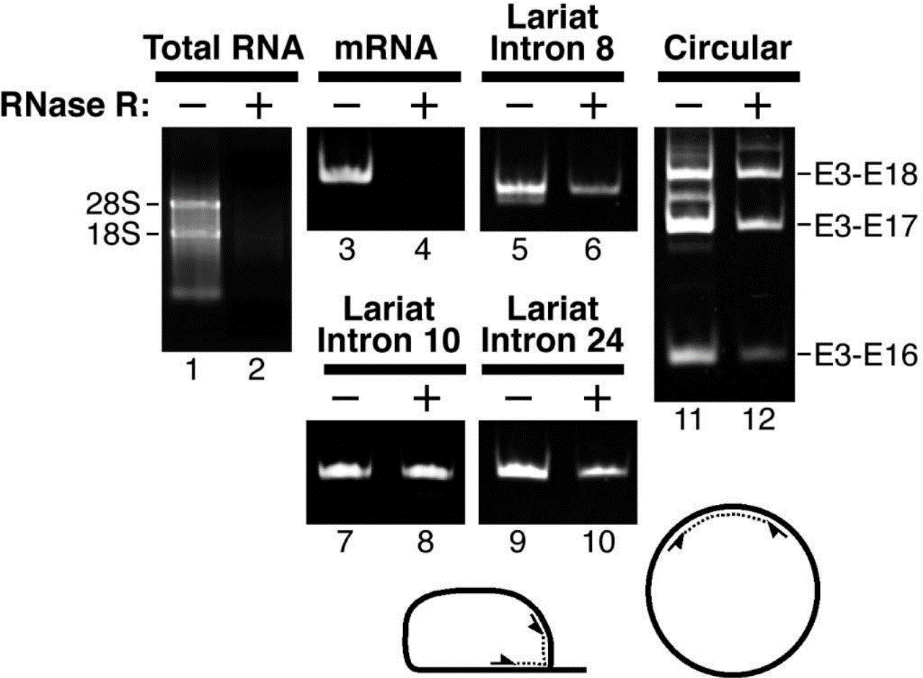
图3 使用RT-PCR检测mRNA,在RNase R(-)中有条带,在RNase R(+)中无条带;检测Lariat/Circular RNA,在RNase R(-)和RNase R(+)样品中都有条带,表明mRNA被消化,而Lariat/Circular RNA耐受消化(Suzuki H et al., 2006)
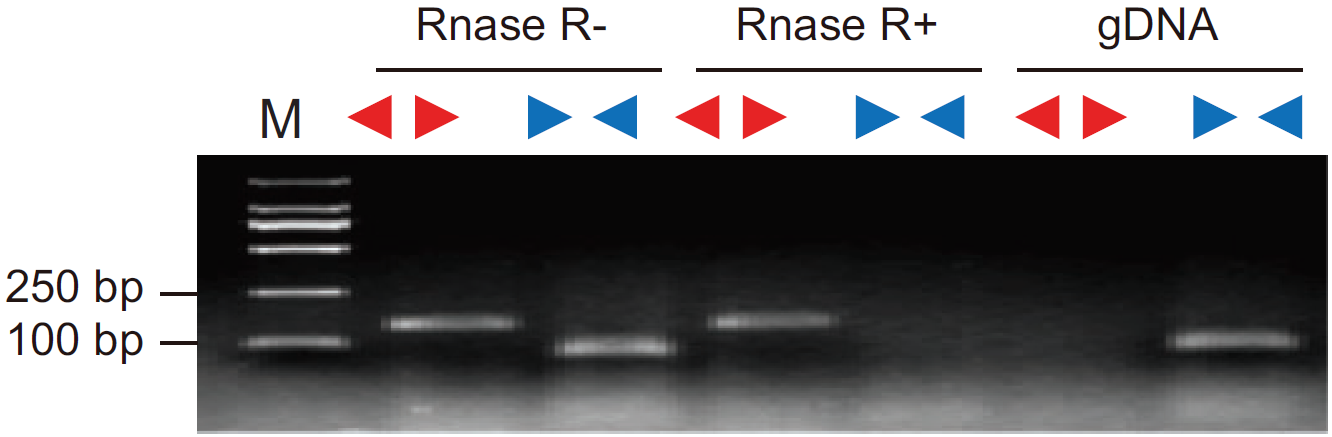
图4 RNase R消化后分别以Divergent Primer和Convergent Primer检测cDNA样品。RNase R(+)中Divergent Primer有条带,Convergent Primer无条带;RNase R(-)中Divergent Primer和Convergent Primer都有条带,表明检测的基因为circRNA,并且耐受RNase R消化(Yibing Y et al., 2018)
RT-PCR中若要证明检测的基因是否为circRNA,需要体现在RNase R(+)和RNase R(-)组中条带有无和丰度高低有差异,这种情况是需要做RNase R消化的,也可以和分别使用Divergent Primer和Convergent Primer检测cDNA和gDNA样品的结果结合起来。如果是以qPCR进行定量检测,一般可以不做RNase R检测,即不需要对circRNA进行富集(线性RNA被消化),因为Divergent Primer和Convergent Primer基本可以保证检测的特异性。
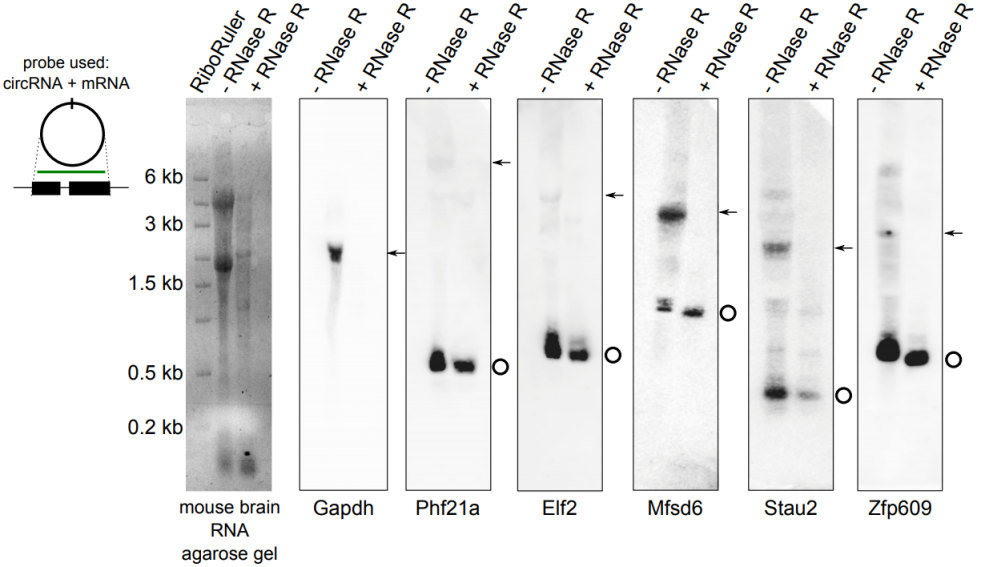
图5 以3U RNase R/µg RNA 进行RNase R消化15分钟,电泳显示RNase R(+)组中28S/18S条带变淡。使用同时检测circRNA和mRNA的探针进行Northern blot实验,结果显示RNase R(+)组检测不到线性的Gapdh、Phf21a、Elf2、Mfsd6、Stau2或Zfp609,可以检测到对应的circRNA,表明mRNA被消化,而circRNA耐受消化(Rybak-Wolf, A. et al., 2015)
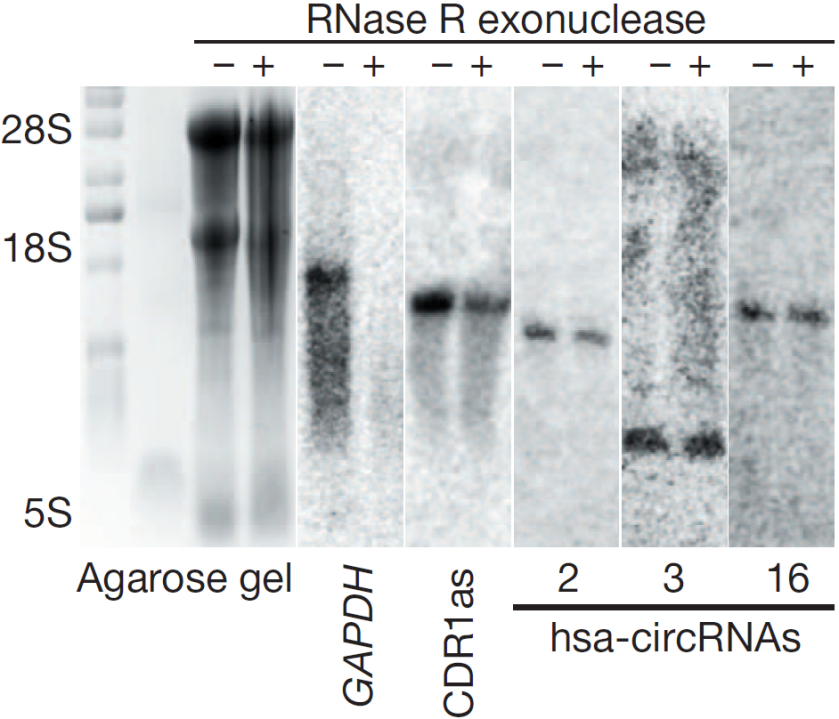
图6 RNase R消化产物电泳显示RNase R(+)组中28S/18S/5S条带变淡。Northern blot检测显示RNase R(+)组中无线性GAPDH的条带,CDR1as和hsa-circRNA 2/3/16能检测到条带,表明线性RNA被消化,而circRNA耐受消化(Memczak S et al., 2013)
Northern blot实验使用探针特异性检测内源的circRNA和线性RNA,过程中无PCR扩增,能够真实地反映circRNA和线性RNA的定性定量分析结果,是circRNA鉴定中必不可少的一个实验。
3.2 circRNA的富集
高通量测序时常需要对circRNA进行富集,此时RNase R消化就是必须的。为探究RNase R消化后circRNA的富集程度和相关基因的变化,可以同时做RNase R(+)和RNase R(-)组样品的测序。笔者实验室的测序显示RNase R(+)组中junction reads相对于RNase R(-)样本有5-10倍的富集,可鉴定出几千到上万个circRNAs。
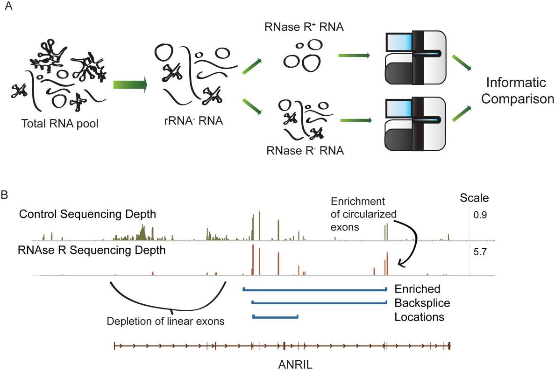
图7 RNase R(+)和RNase R(-) RNA测序示意图(Jeck WR et al., 2014)
4 RNase R消化的效果
Total RNA经消化后直接进行电泳检测,RNase R(-)组中28S/18S/5S三条带单一明亮,而RNase R(+)组中28S/18S/5S条带会变淡或不可见(Rybak-Wolf, A. et al., 2015; Suzuki H et al., 2006)。但如果RNase R+组中5S条带加亮,且28S/18S条带处有拖尾,则可能是RNA被外源RNA酶降解,而不是RNase R消化产生的,如不能确定降解是发生在电泳过程中还是RNase R消化反应中,可以尝试在RNase R消化反应体系中加入RNase inhibitor。
a 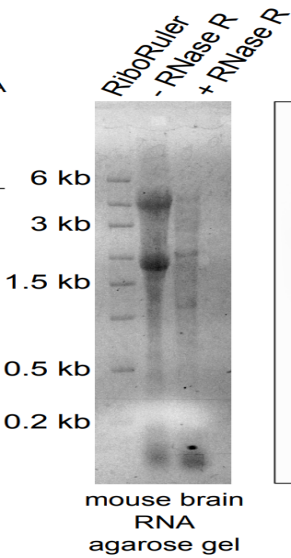 b
b 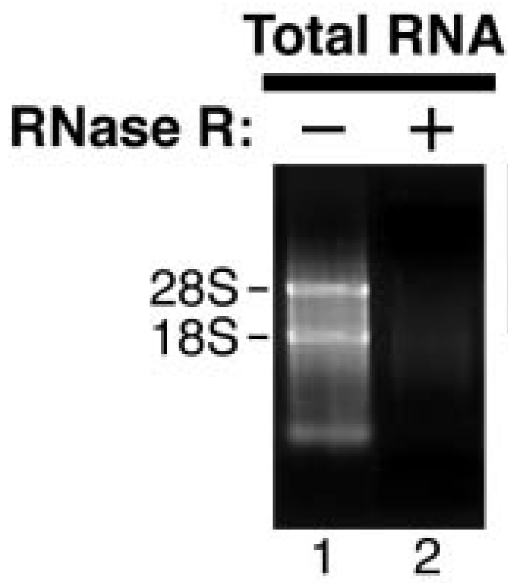
图8 a, RNase R消化后条带变淡;b, RNase R消化后条带不可见(Rybak-Wolf, A. et al., 2015; Suzuki H et al., 2006)
5 实验细节和常见问题
5.1 测量浓度
实验中要先对total RNA测量浓度,以计算相应的比例和使用量来进行RNase R消化。消化后的产物无需测量浓度,实际上因为反应体系内的蛋白质、盐离子等成分影响,测量到的浓度也不会准确。
5.2 纯化回收
经RNase R消化后的RNA可使用苯酚:氯仿:异戊醇(25: 24:1, V: V)溶液抽提,再使用乙醇沉淀回收;或者使用RNA纯化柱和磁珠进行纯化回收。经RNase R消化后直接进行RT-PCR的,一般可以不做纯化,酶失活后直接进行逆转录反应即可(Legnini I et al., 2017; Guarnerio J et al., 2016)。
注:苯酚:氯仿:异戊醇(25: 24:1, V: V)溶液最好现配现用,没有试剂也可以Trizol Reagent代替。
5.3 RNase R消化反应温度和时间
RNase R消化一般于37℃进行反应,时间10-30 min为宜(Memczak S et al., 2013; Legnini I et al., 2017),不推荐过长时间的消化。另外检测不同的基因可能也需要摸索反应时间,笔者实验室直接用于RT-PCR检测时常用5-15 min消化就能得到很好的结果,线性基因丰度可以降低几十到几百倍,circRNA丰度则基本不变。
经RNase R消化后直接进行逆转录反应的,推荐在37℃反应结束后保持70℃ 10 min使RNase R灭活(Cheng ZF et al., 2002)。如果消化后要进行纯化回收,也可以不做酶的失活。
5.4 qPCR定量计算
RNase R消化后不能再使用ACTB或GAPDH作为内参,此时可以将原始的RNA等分为两份,一份进行RNase R处理(RNase R(+)),另一份不处理(RNase R(-)),统一以RNase R(-)组中的内参为计算标准(Zhang Y et al., 2016)。
另外在RNase R消化后如果进行纯化回收,RNA的浓度可能会有变化,不适宜再以RNase R(-)组中的内参为计算标准。此时可以在纯化回收前加入少量其他物种的RNA作为外参,统一以外参标准化样品后进行计算(Rybak-Wolf, A. et al., 2015; Pamudurti NR et al., 2017)。
5.5 circRNA也被消化?
实验中有时会发现经RNase R消化后部分circRNA丰度也有明显降低,此时要检查消化反应体系有无问题,考虑是否被外源RNA酶降解。另外有些circRNA在经长时间RNase R消化也会丰度降低,可能是因为其耐受RNase R消化力弱(Zhang Y et al., 2016)。
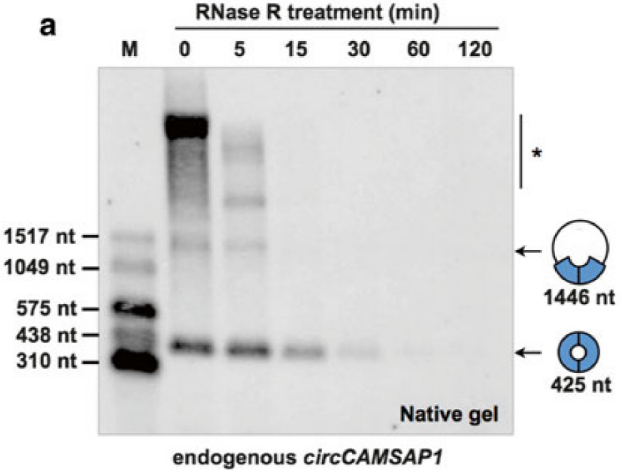
图9 RNase R消化0-120 min,检测circCAMSAP1在15 min时就被明显消化(Zhang Y et al., 2016)
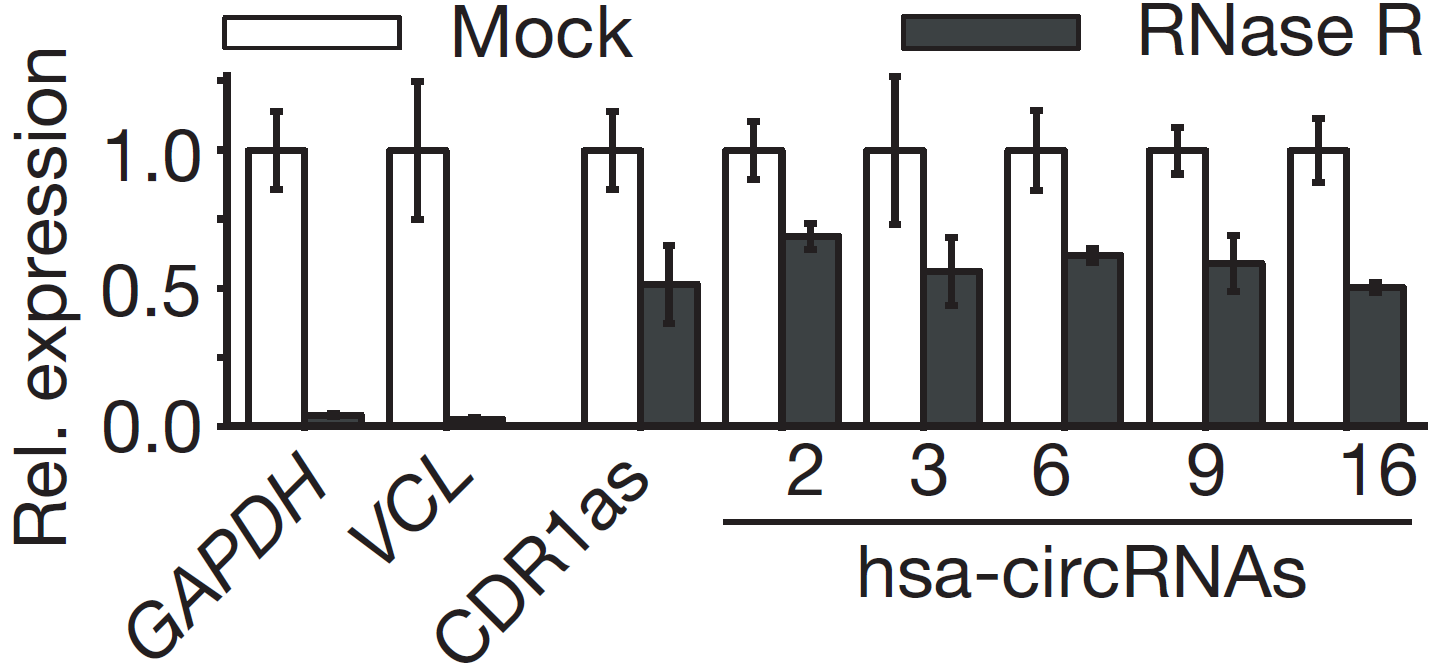
图10 RNase R消化后进行qPCR检测,RNase R组中has-circRNA 2/3/6/9/16和CDR1as丰度有轻微降低,但和GAPDH相比,circRNAs显示有不低于10倍的耐受RNase R消化力(Memczak S et al., 2013)
笔者实验室也经常会检测到RNase R消化后circRNA丰度会降低的情况,一般缩短消化时间可以减少circRNA被消化的可能,另外对比线性RNA和circRNA消化后丰度降低的倍数,是明显能看到circRNA比线性RNA耐受消化的。
参考文献:
- Cheng ZF, Deutscher MP. J. Purification and characterization of the Escherichia coli exoribonuclease RNase R. Comparison with RNase II. Biol. Chem. 2002; 277:21624–21629.
- Rybak-Wolf, A. et al.. Circular RNAs in the mammalian brain are highly abundant, conserved, and dynamically expressed. Mol. Cell. 58, 870–885 (2015).
- Yibing Yang et al.. Novel Role of FBXW7 Circular RNA in Repressing Glioma Tumorigenesis. J Natl Cancer Inst. 2018 Mar 1;110(3).
- Suzuki H et al.. Characterization of RNase R-digested cellular RNA source that consists of lariat and circular RNAs from pre-mRNA splicing. Nucleic Acids Res. 2006; 34(8), e63.
- Memczak S, Jens M, Elefsinioti A, et al.. Circular RNAs are a large class of animal RNAs with regulatory potency. Nature. 2013;495(7441):333–338.
- Jeck WR, Sharpless NE. Detecting and characterizing circular RNAs. Nat Biotechnol. 2014; 32:453–61.
- Guarnerio J, Bezzi M, Jeong JC, Paffenholz SV, Berry K, Naldini MM et al.. Oncogenic Role of Fusion-circRNAs Derived from Cancer-Associated Chromosomal Translocations. Cell. 2016 Aug 11;166(4):1055-1056.
- Legnini I, Di Timoteo G, Rossi F, Morlando M, Briganti F, Sthandier O, Fatica A, Santini T, Andronache A, Wade M, et al.. Circ-ZNF609 Is a Circular RNA that Can Be Translated and Functions in Myogenesis. Mol Cell. 2017;66(1):22–37.e29.
- Zhang, Y., Yang, L., and Chen, L.L. (2016c). Characterization of Circular RNAs. Methods Mol. Biol. 1402, 215–227.
- Pamudurti NR, Bartok O, Jens M, Ashwal-Fluss R, Stottmeister C, Ruhe L et al.. Translation of CircRNAs. Mol Cell. 2017 Apr 6;66(1):9-21.e7.
.png)