为方便广大同行交流,公众号近期将陆续推出有关RNA互作分子研究技术的系列文章,本期将介绍最常见的实验技术:RIP。RIP(RNA Immunoprecipitation)是研究RNA-蛋白相互作用的重要实验,主要是通过抗蛋白的抗体进行免疫共沉淀,然后分析相互作用的RNA分子。有关RIP的实验技术方法文章挺多的,研究论文就更多了,这也说明RIP实验的重要性。下面我们主要参考一篇方法学的文章,详细分析RIP实验的原理和操作方法。该文章是2016年9月23日发表于Methods in Molecular Biology杂志的一篇方法学文章,通讯作者为意大利”ABT”- CNR遗传与生物物理研究所的Maria R. Matarazzo教授[1]。

材料与试剂准备:
(所有试剂均需用超纯水配制,试剂纯度级别不低于分析纯)
PBS (pH7.4);
10×多聚体裂解液:1000 mM KCl, 50 mM MgCl2 , 100 mM HEPES-NaOH pH 7, 5% NP-40。室温放置,使用前用超纯水稀释至1×并添加1 mM DTT, 200 units/ml RNase OUT,EDTA-free 蛋白酶抑制剂Cocktail。
5×NT-2 buffer:250 mM Tris-HCl(pH7.4), 750 mM NaCl,5 mM MgCl2,0.25% NP-40。 4 °C保存,
NET-2 buffer:用超纯水将NT-2 buffer稀释至1×,并添加20 mM EDTA (pH 8.0), 1 mM DTT, 200 units/ml RNase OUT。
甲醛溶液:50 mM HEPES-KOH, 100 mM NaCl, 1 mM EDTA, 0.5 mM EGTA, 11 % 甲醛。
细胞裂解液:10 mM Tris-HCl (pH 7.4),10 mM NaCl, 0.5 % NP-40。用时补加1mM DTT, 200 units/ml RNase OUT,EDTA-free 蛋白酶抑制剂Cocktail。
核重悬Buffer:50 mM HEPES-NaOH (pH 7), 10 mM MgCl2。用前添加1mM DTT, 200 units/ml RNase OUT,EDTA-free 蛋白酶抑制剂Cocktail。
IP Buffer:150 mM NaCl, 10 mM Tris–HCl (pH 7.4), 1 mM EDTA, 1 mM EGTA (pH 8), 1 % Triton X-100, 0.5 % NP-40。用前添加1mM DTT, 200 units/ml RNase OUT,EDTA-free 蛋白酶抑制剂Cocktail。
蛋白酶K消化Buffer:1× NT-2 buffer 添加1 % SDS, 1.2 mg/ml Proteinase K。
操作流程:
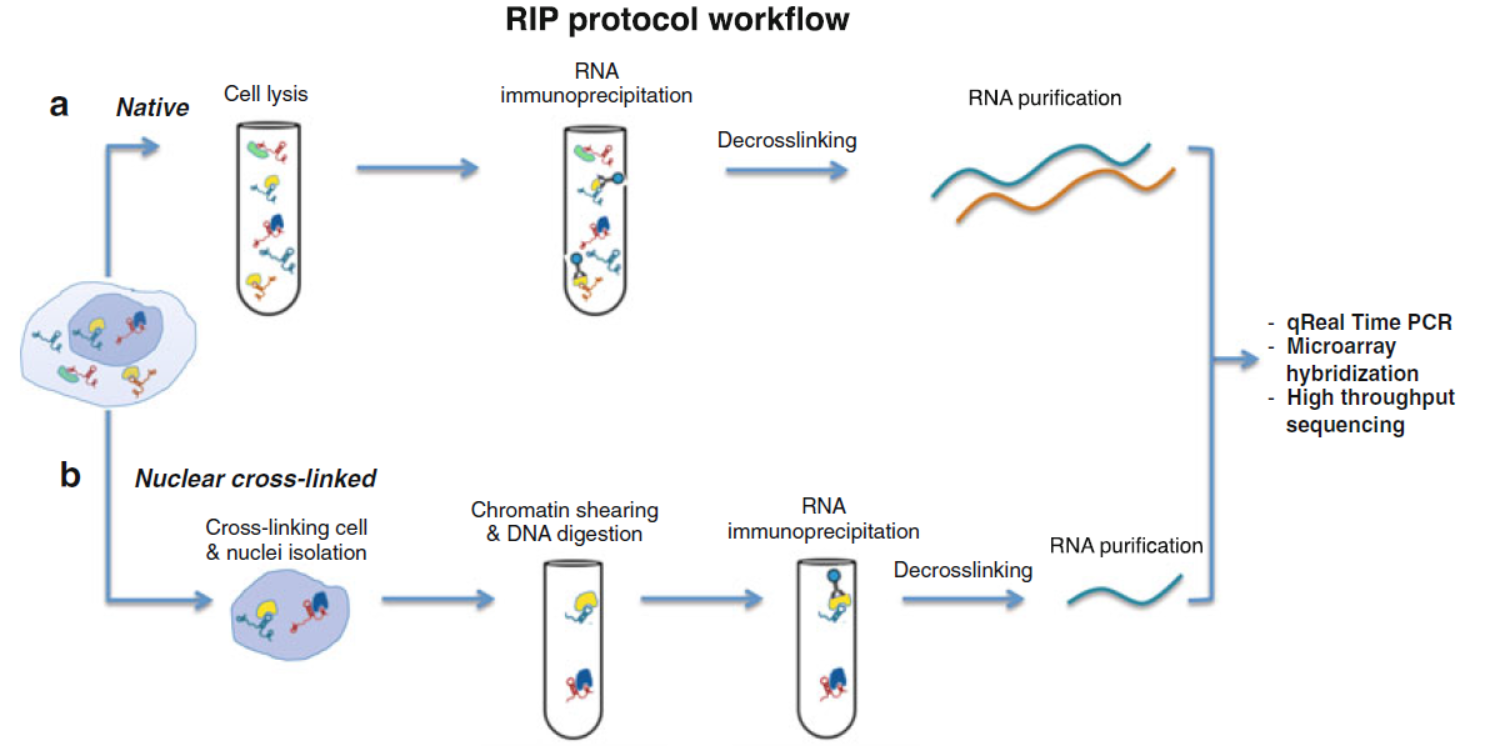
图1 RIP实验操作流程 (来自[1])
常规RIP实验:
裂解物准备:
- 细胞生长至90%覆盖度,细胞计数,满足最终获得2~5mg蛋白样品的数量,约5~20 × 10 6 细胞总数;
- 1000 ×g,4 °C离心5min,弃上清;
- 用1× 预冷PBS洗两遍,弃上清;
- 用等体积的1×多聚体裂解液重悬细胞,轻轻吹散,冰浴5min;
- −80 °C冻存促进细胞裂解,样品也可以在−80 °C放置数月。
磁珠与抗体准备:
- protein-A/G包被的磁珠充分重悬,取75μl 至1.5 ml EP管中;
- NT-2 buffer洗涤两次;
- 用100 μl NT-2 buffer重悬,加目标抗体5μg,室温混匀1h;
- 5000 × g离心 15 秒,加磁座吸附磁珠,上清用真空泵吸走;
- 从磁座上取下管子,加1ml NT-2,吹打混匀,5000 × g离心 15 秒,重复5次。(总共洗磁珠6次);
- 900μl NET-2 buffer 重悬磁珠,冰浴备用。
常规RIP:
- 将存放在-80 °C的细胞裂解物20000 × g,4 °C离心10 min;
- 取100μl上清至制备好的900μl NET-2 buffer 重悬的磁珠中,进行抗体孵育,每个体系的体积为1ml;
- 取出10μl的样品作为“Input”备份,−80 °C保存备用;
- 垂直混合器4 °C混合3小时以上或过夜;
- 短暂离心将样品甩到管底,冰浴中将样品放到磁座上,放置1min后弃上清;
- 加1ml NT-2,强力震荡混匀;
- 短暂离心将样品甩到管底,冰浴中将样品放到磁座上,放置1min后弃上清,重复5次;
- 沉淀即为RIP实验获得的样品,可进一步通过蛋白酶K消化后提取RNA进行后续分析。
甲醛交联RIP实验:
裂解物准备:
- 细胞生长至90%覆盖度,细胞计数,满足最终获得2~5mg蛋白样品的数量,约5~20 × 10 6 细胞总数;
- 向细胞悬液中加入适量的甲醛溶液,甲醛终浓度达到1%,室温放置10min;
- 向交联体系中加10倍体积的2.66 M甘氨酸,室温放置5min,冰浴10min;
- 用1× 预冷PBS洗两遍,弃上清;
- 用4ml细胞裂解液重悬,冰浴裂解10-15min;
- Dounce匀浆器的A杵匀浆10次,B杵匀浆40次;
- 1000g,4°C离心10min收集细胞核;
- 用3ml核重悬Buffer重悬,超声处理至DNA长度在1000~200bp范围;
- 加入250 unites/ml的DNase,37 °C孵育30min;
- 加入20 mM EDTA终止DNase;
- 样品重悬后通过添加相应试剂将Triton X-100浓度调至1%,脱氧胆酸钠浓度调至0.1 %, SDS浓度调至0.01 %,NaCl浓度调至140 mM,备用。
磁珠与抗体准备:
- protein-A/G包被的磁珠充分重悬;
- 取75μl 至1.5 ml EP管中,用0.5ml核重悬Buffer(添加1 % Triton X-100, 0.1 % 脱氧胆酸钠,0.01 % SDS和 140 mM NaCl)
- 用100 μl核重悬Buffer重悬磁珠,加5μg抗体或阴性对照,室温混匀1h;
- 5000 × g 离心for 15 s,管子放到磁座上,弃上清;
- 加1ml核重悬Buffer,吹打混匀,5000 × g 离心for 15 s,放到磁座上,弃上清,重复5次(总共洗6次);
- 用75μl核重悬Buffer重悬,冰浴备用。
交联RIP:
- 将细胞裂解物20000 × g,4 °C离心10 min,吸取925μl体积的上清液至包被好抗体的磁珠中,终体积为1ml;
- 取出9.7μl的样品作为“Input”备份,−80 °C保存备用;
- 垂直混合器4 °C混合3小时以上或过夜;
- 短暂离心将样品甩到管底,冰浴中将样品放到磁座上,放置1min后弃上清;
- 加1ml 预冷的IP Buffer,强力震荡混匀;
- 短暂离心将样品甩到管底,冰浴中将样品放到磁座上,放置1min后弃上清,重复5次;
- 沉淀即为RIP实验获得的样品,可进一步通过蛋白酶K消化后提取RNA进行后续分析。
RNA制备:
- 将RIP获得的样品加150 μl蛋白酶K Buffer,每个“Input”添加107μl of NT-2, 15 μl 10 %SDS,18 μl 蛋白酶K,总体积达到150 μl。55 °C孵育30min;
- 短暂离心将液体甩至管底。放置到磁座,上清转移至新的EP管中,加250 μl NT-2;
- 分别加入400μl 酚:氯仿:异戊醇(125:24:1),剧烈震荡15S,20000 × g 室温离心 10 min;
- 小心吸取350 μl上清,注意不要碰到沉淀层,上清转移至新的EP管中,加400μl氯仿,震荡15s,20,000 × g 室温离心 10 min;
- 小心吸取300 μl水相至新的EP管中,加50μl 5M的乙酸铵,15μl 7.5 M LiCl,5μl 的5 mg/ml糖原,850 μl无水乙醇;
- −80 °C放置1h或过夜,20000 × g,4 °C 离心30 min,小心弃上清;
- 500 μl预冷的80%乙醇洗涤沉淀,20000 × g ,4 °C离心15 min;
- 样品晾干,用10~20 μl 的RNase-free水溶解RNA样品。可以增加DNase处理步骤以排除DNA污染造成的干扰。
- 所收取的RNA样品可直接用于反转录鉴定,QPCR,microarray,测序等后续研究。
注意事项:
- 所有的实验用品均需保证无DNase和RNase,操作台面和移液枪等实验用品保证绝对干净;
- 细胞裂解过程中适当震荡有利于细胞充分裂解;
- IP用磁珠的选择要严格遵照说明书。一般小鼠来源的抗体与Protein G结合力较强,兔来源的抗体与蛋白A/G结合力均较强;
- 磁座吸附磁珠的时候要注意注意磁珠需完全附着在管壁,弃上清的过程要注意更换枪头;
- 存在于NET-2的EDTA能降低核糖体RNA与核糖体蛋白的结合,需要注意实验的需要;
- Input对照可用于QPCR的标准曲线。更严谨的设计里还需要有非特异性结合RNA的对照,需要慎重的选择合适非目标蛋白进行非特异性结合的对照,如果是非RNA结合蛋白有可能会大大降低非特异性结合RNA的能力,并不是最佳的非特异性RNA结合对照。
- IP效率需要要通过Western实验验证,因此需要准备更多量的input对照;
- 为了提高交联的效率,在收集完细胞并计数后最好用预冷PBS洗涤两次,甲醛交联的反应也最好在预冷PBS溶液中进行。甲醛交联的时间非常重要,太短了会造成假阴性,太长了则造成假阳性。需要设计实验逐渐摸索条件。
- 超声处理的条件也非常关键。超声处理的效果受到细胞类型,细胞密度与数量等条件的影响。超声处理中需要冰浴以减少蛋白变性的可能,超声的强度宜选择中等强度条件,分多次脉冲式处理更好。
参考文献:
1. Gagliardi, M. and M.R. Matarazzo, RIP: RNA Immunoprecipitation. Methods Mol Biol, 2016. 1480: p. 73-86.
.png)