8月30日,Molecular Cell杂志在线发表了斯坦福大学Howard Y. Chang团队的一篇circRNA研究论文,报道外源circRNA激活自身免疫效应通路的新证据,细胞通过识别是否携带m6A修饰来识别内源和外源circRNA[1]。
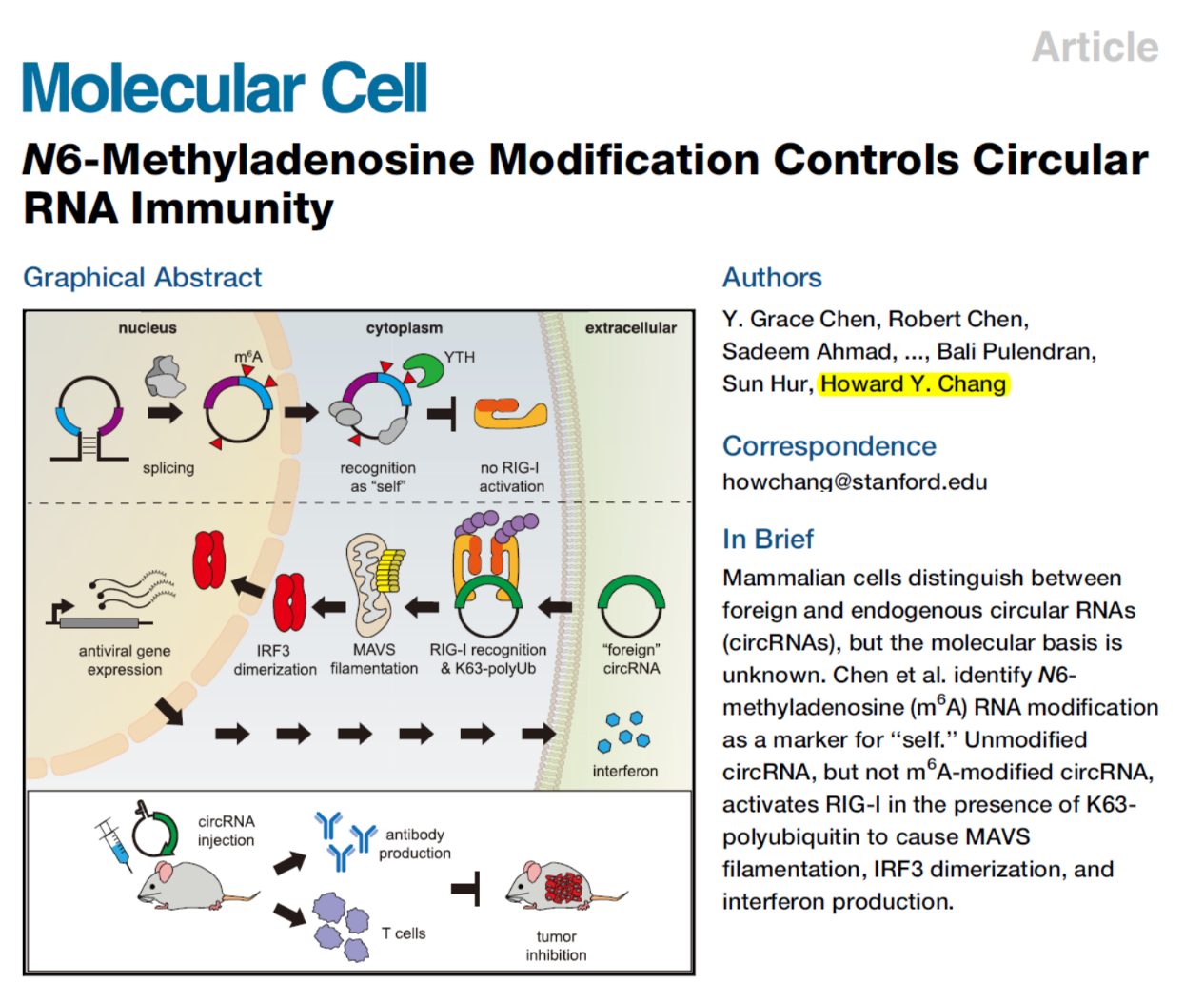
早在2017年,Howard Y. Chang就曾经在Molecular Cell杂志报道细胞可以通过RIG-I识别细胞内生成的circRNA(内源circRNA)和体外合成环化的circRNA(外源circRNA),RIG-I识别外源circRNA后可激活自身免疫效应通路[2]。(推荐阅读:Molecular Cell:细胞识别内源/外源circRNA的机制)。然而,就在2019年3月份,Molecular Cell杂志发表了麻省理工学院Daniel G. Anderson教授的文章,报道外源合成的circRNA转染细胞后并不引起免疫效应通路,他们认为Howard Y. Chang早期的这篇文章是由于样品纯度不够,可能是其中掺杂的带5’磷酸基的线性RNA引起的非特异性效应[3]。(推荐阅读:环化的RNA不诱发免疫反应,且可以高效翻译蛋白)。
关于外源circRNA是否可以激活细胞自身免疫效应通路的问题,Howard Y. Chang教授和Daniel G. Anderson教授的观点几乎完全相反,Howard Y. Chang教授认为可以但Daniel G. Anderson教授认为不能。本文中,作者还是坚持外源circRNA能够引发自身免疫效应的观点,那么作者是如何证明他们的体系是严谨可靠的?如何证明外源circRNA能够引起自身免疫效应?m6A修饰如何让内源circRNA避免激活免疫效应通路的?下面就让我们一起看看作者是如何证明他们的观点的:
如何证明他们的体系是严谨可靠的?
Howard Y. Chang教授和Daniel G. Anderson教授得出不同结论,但都是基于他们的实验证据而得出的,Howard Y. Chang教授要证明自己的观点就必须给出更有说服力的证据。文中作者针对实验体系的问题专门做了详细的说明,概括而言包括以下几个方面:
(1)样品纯度问题:样品纯度问题是两个团队得出不同结论的一个焦点,Daniel G. Anderson教授认为Howard Y. Chang教授发表文章中外源circRNA的样品中掺杂了少量带5’磷酸基的线性RNA产物([3])。对此,本文中作者给出了相应的说明,Daniel G. Anderson教授在发表的文章中用RNase R消化了30分钟,没有用碱性磷酸酶(AP)处理。但本文及2017年那篇文章中作者用RNase R消化了超过两个小时,并且后面也用了AP酶进一步的处理。作者还比较了AP和RNase R处理后纯化的外源circRNA(circFOREIGN)与含有线性RNA但经过两次AP酶处理的样品对细胞的影响,两组样品对细胞的刺激作用是相当的。但纯的线性RNA经过两次AP酶处理后,对细胞的刺激作用则显著减弱。
(2)实验体系:纯化方法也是他们有差别的地方。Howard Y. Chang教授采用的是凝胶纯化,Daniel G. Anderson教授则通过高效液相色谱(HPLC)。会不会是因为纯化体系的差别导致的?对此,本文也给出了相应的解释和分析。作者首先比较了RNase R与AP酶处理前后的样品分别经过凝胶电泳回收后的产物对细胞的作用情况,发现经过凝胶回收的circFOREIGN都具有刺激自身免疫效应通路的能力,也就是说不管是否经过RNase R和AP酶处理,凝胶回收的产物的效应是一样的。作者也尝试了HPLC纯化的方法,但所得的峰形与Daniel G. Anderson教授报道的不太一致,可能是由于使用的设备和体系差别所致。HPLC分离的RNase R处理的circFOREIGN样品能得到两个峰,对应于胶回收中的两个条带。纯化得到的circFOREIGN依然能够激活免疫通路。HPLC纯化过程中发现在circFOREIGN峰的前面有一个小分子产物的峰,主要成分是一些RNase R降解不彻底的片段或者内含子成分,但贯穿全过程的AP酶处理已经抑制了这些分子的免疫原性。作者还认为HPLC纯化的方法不如胶回收的效果好,因为HPLC处理过程会产生更多的小片段产物。
如何证明外源circRNA能够引起自身免疫效应?
circFOREIGN在体外细胞中激活免疫效应通路已经在2017年的文章中做了充分的工作。本文着重分析circFOREIGN在小鼠体内的作用情况。如果circFOREIGN在体内也能激活自身免疫效应通路,那么它有没有可能具有疫苗佐剂的功能呢?为验证这一假设,作者设计实验,在小鼠中注射鸡卵清蛋白(OVA,可模拟疫苗接种过程)。分别用Poly(I:C),单独circFOREIGN和PEI包装后的circFOREIGN,分析接种后血液中T细胞和抗体的变化情况。结果表明,circFOREIGN或PEI包装后的circFOREIGN均能与Poly(I:C)起到相似的作用,可以促进机体免疫效应。说明circFOREIGN在体内可以发挥疫苗佐剂的功能。表达OVA的B16细胞构建皮下肿瘤模型,然后通过接种OVA和circFOREIGN,分析circFOREIGN存在是否能抑制肿瘤的生长并延长小鼠寿命。结果显示,同时注射circFOREIGN可以有效促进注射OVA所激发的体内免疫效应,提高肿瘤免疫效应能力,进而抑制肿瘤生长,延长小鼠的生存。
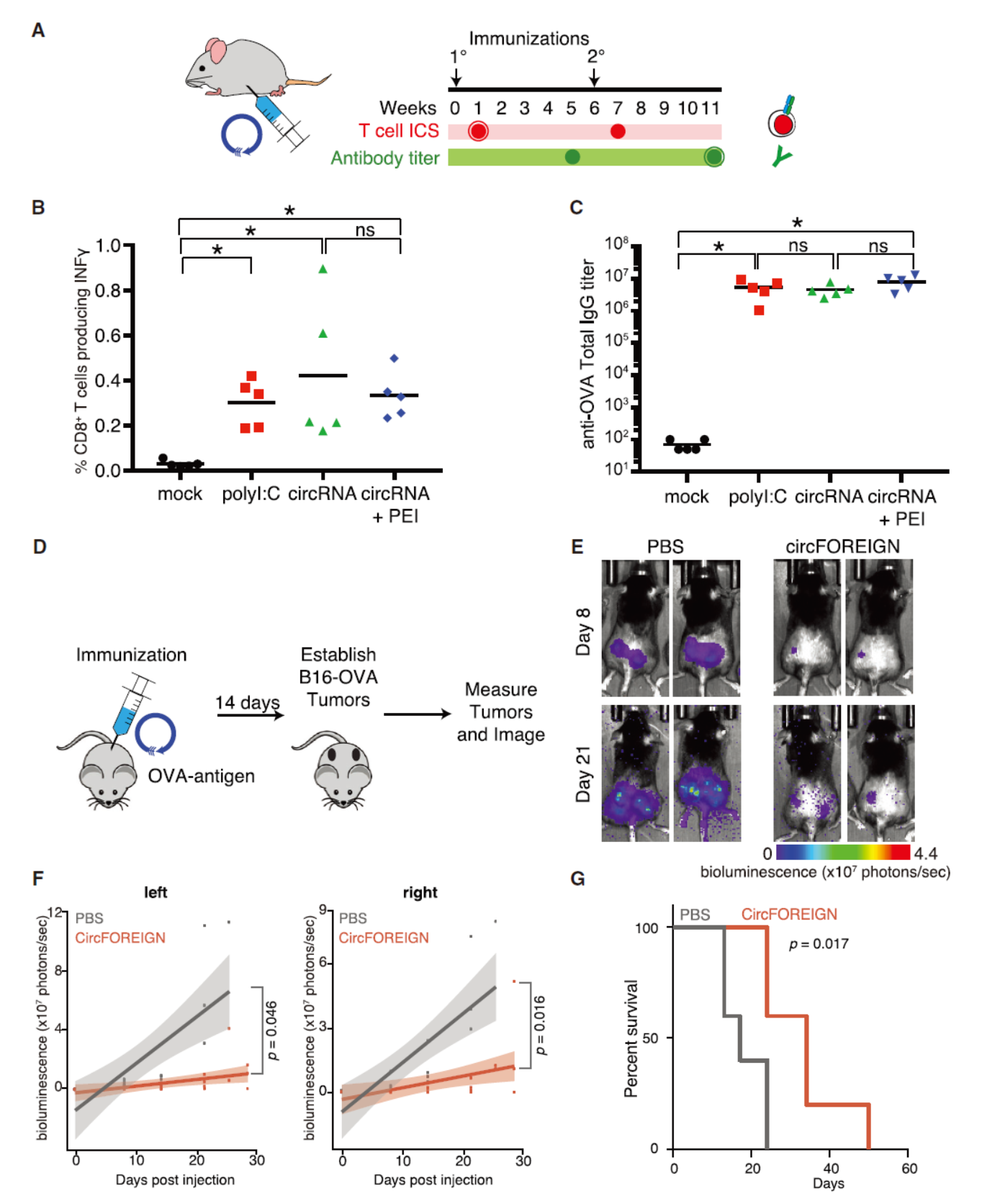
图1 circFOREIGN可以作为疫苗佐剂 ([1])
为探索细胞识别内源和外源circRNA的机制,作者设计实验进行ChIRP分析,找出各个组别相互作用的蛋白分子。设计了三个组进行实验:circFOREIGN即为上述体外纯化的circRNA分子,代表外源circRNA分子;circZKSCAN1由ZKSCAN1基因的内含子形成,是内源的circRNA分子;circSELF是将circFOREIGN的序列(GFP序列)克隆到circZKSCAN1的侧翼序列中,模拟circZKSCAN1的形成过程生成内源的circZKSCAN1分子,作者称之为circSELF。ChIRP结果表明内源的circZKSCAN1和circSELF均可以结合m6A的“Writer”和“Reader”分子,但不结合“Eraser”分子。m6A-irCLIP分析表明外源和内源circRNA分子的m6A修饰状态有非常大的差别,circSELF在靠近接口位置的3’位置有明显的m6A修饰区域,但circFOREIGN没有m6A的修饰。
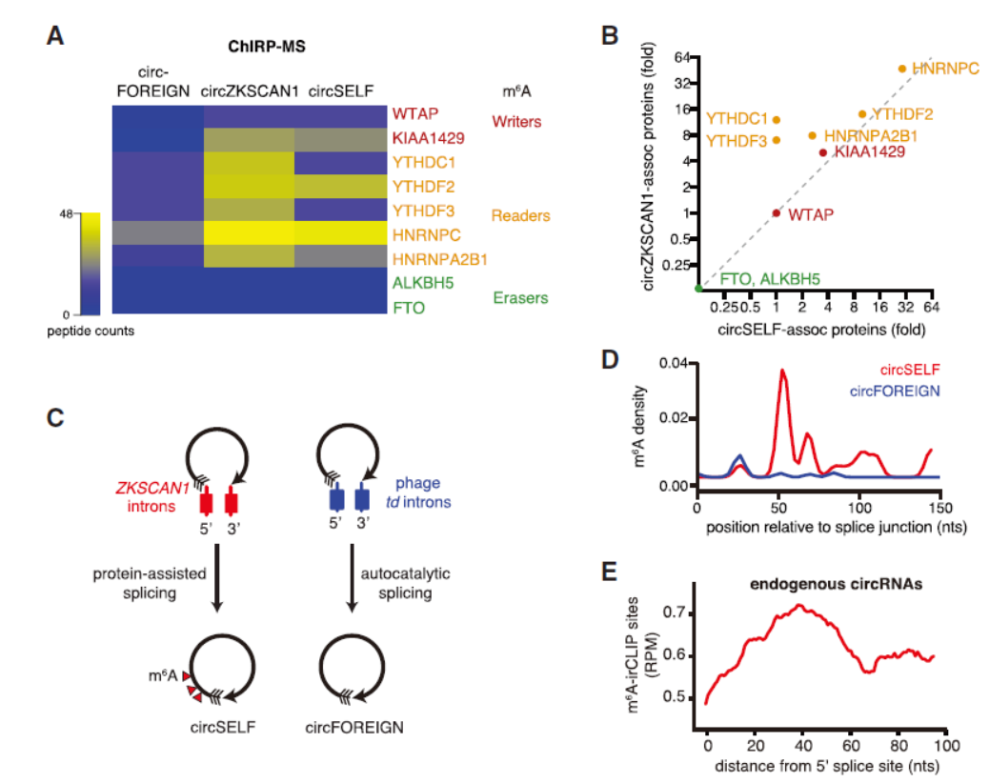
图2 内源circRNA分子结合m6A“Writer”和“Reader”分子 ([1])
m6A修饰如何让内源circRNA避免激活免疫效应通路的?
外源和内源circRNA的m6A修饰存在明显差异,那么细胞是否是通过m6A修饰来识别出它们是外源还是内源的circRNA呢?为了证明这个问题,作者分别从体外和体内设计实验进行分析:体外合成circFOREIGN的时候通过将A碱基完全置换为m6A修饰的(100% m6A circFOREIGN),仅有1%的A碱基置换为m6A的(1% m6A circFOREIGN)以及没有m6A的circFOREIGN,处理细胞后分析免疫相关通路的变化,结果表明100% m6A circFOREIGN没有影响相关基因的表达,1% m6A circFOREIGN有明显的激活作用,但弱于circFOREIGN。1% m6A circFOREIGN在小鼠体内的佐剂功能也大大减弱。为分析内源circRNA修饰状态的影响,作者设计过表达circFOREIGN(GFP序列)和突变体进行分析,设计将GFP序列中RRACH序列突变为RRUCH(circFOREIGN ΔRRACH),或者将序列中所有的A均突变为U(A-less circ-FOREIGN)。QPCR检测免疫相关通路基因的表达情况,结果表明circ-FOREIGN细胞内表达不会引起免疫效应,但circFOREIGN ΔRRACH能够较大程度刺激相关基因的表达(约100倍),而A-less circ-FOREIGN则更明显的刺激相关基因表达(约10000倍)。
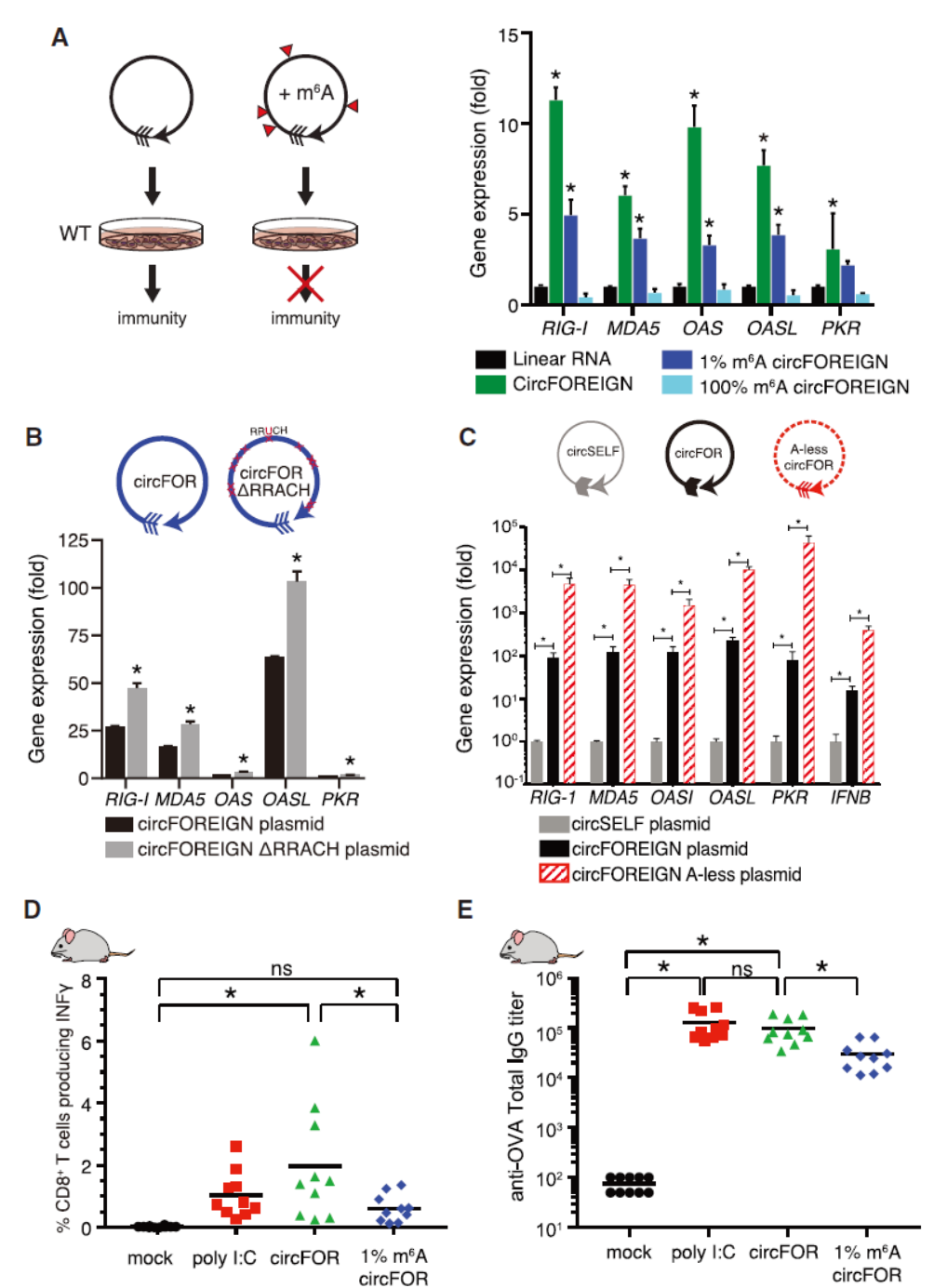
图3 m6A修饰影响circFOREIGN免疫原性 ([1])
YTHDF2是常见的m6A识别蛋白(Reader),且定位在胞质中,因此作者提出YTHDF2可能在m6A介导的内源circRNA不激活免疫效应方面发挥作用的假设。在YTHDF2-KO的Hela细胞中,携带不同比例m6A修饰的外源circRNA均能激活免疫相关基因表达,而回补表达YTHDF2后,细胞恢复识别内源/外源circRNA的功能。此外,作者还在细胞中构建了YTHDF2与circRNA强制结合的模型,YTHDF2基因融合λN肽,circRNA序列增加BoxB 序列元件(不带A碱基的突变体?),细胞中两者可以通过λN肽与BoxB的特异性结合使得YTHDF2强制与circRNA相互作用,在YTHDF2野生型和KO细胞中分别表达和共表达两种质粒,分析下游免疫效应通路的变化。结果表明,野生型细胞中单独表达circFOREIGN-BoxB可以显著促进免疫效应的激活,但共表达YTHDF2-λN后不再激活免疫效应基因。
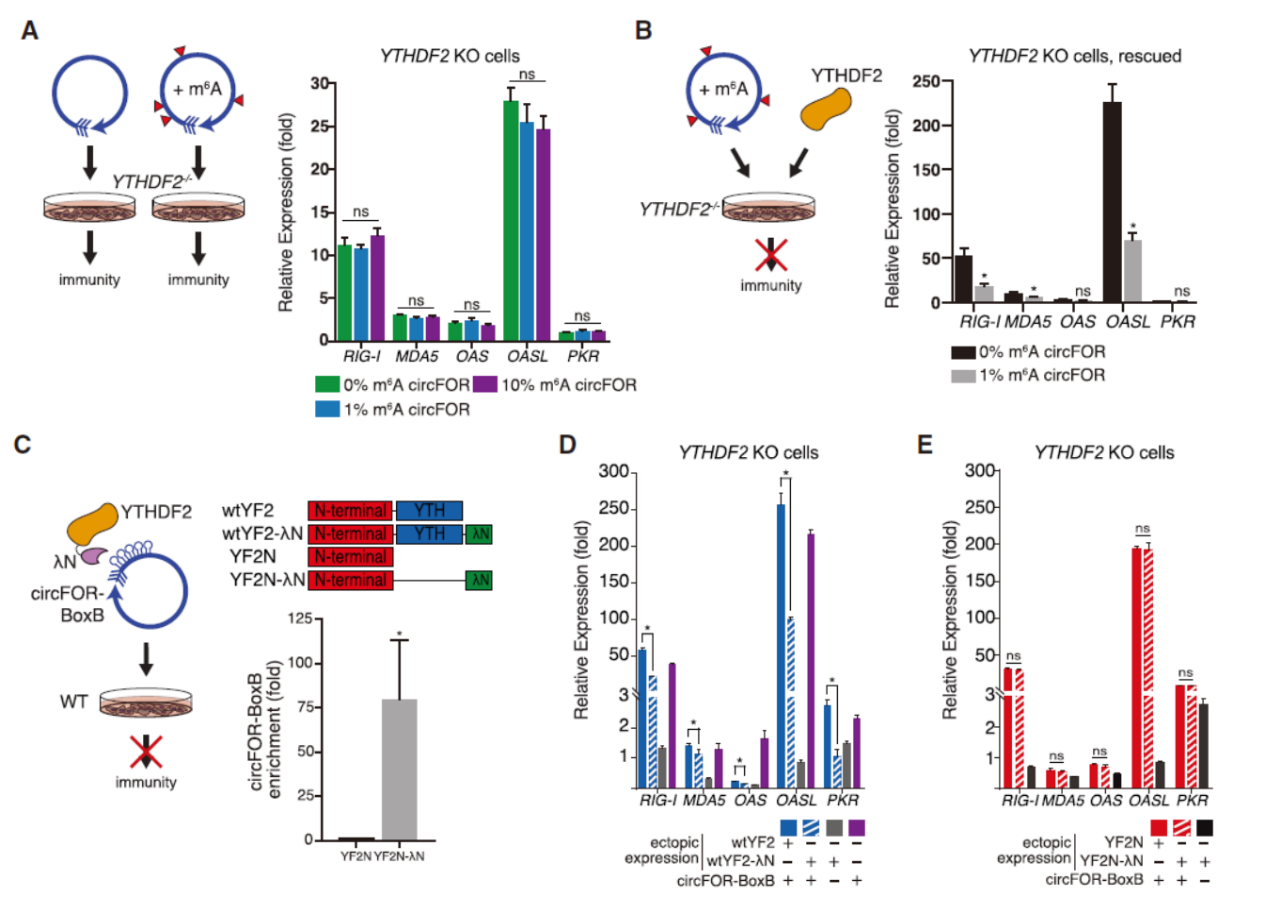
图4 m6A修饰的circRNA通过结合YTHDF2避免激活免疫效应的通路 ([1])
METTL3是常见的RNA m6A的修饰酶,但METTL3敲除或干扰会导致细胞死亡。但作者发现如果在METTL3敲除的同时能抑制RIG-I,细胞就不会发生死亡。体外实验表明外源circRNA并不能激活RIG-I的纤维化聚合和活化,但5’-磷酸基的双链RNA可以。这说明外源circRNA并不是通过直接激活RIG-I诱导下游基因的变化的。
RIG-I的活化还有另外一种机制,即通过K-63多聚泛素化结合RIG-I的CARD结构域,促进RIG-I的聚合状态。RIG-I激活后会诱导MAVS的聚合。分析表明细胞经过circFOREIGN处理后能显著促进MAVS的聚合纤维化,但1% m6A和100% m6A则减弱这一效应。circFOREIGN处理后也会诱导IRF3的二聚化,1% m6A和100% m6A则减弱这一效应。
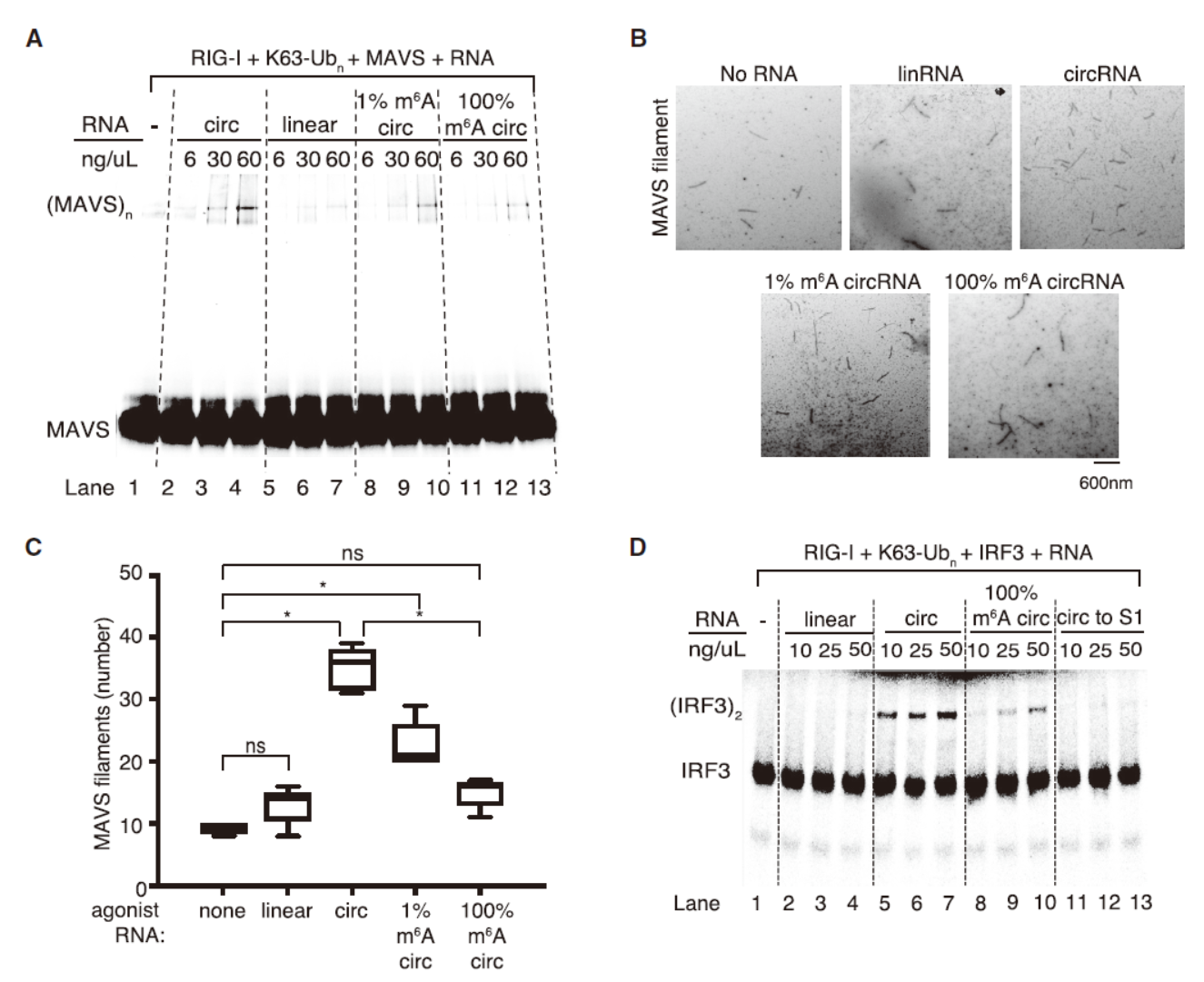
图5 RIG-I介导circFOREIGN诱导的免疫效应通路 ([1])
细胞内共定位分析结果表明外源的circFOREIGN和YTHDF2,RIG-I,K63-Ubn共定位,但当circFOREIGN中有10%的m6A修饰后,circFOREIGN单独与RIG-I共定位的比例会明显下降,而circFOREIGN,RIG-I和YTHDF2共定位的比例明显增多。说明YTHDF2可以在m6A的介导下与RIG-I/K63-Ubn/circRNA复合体相互作用。
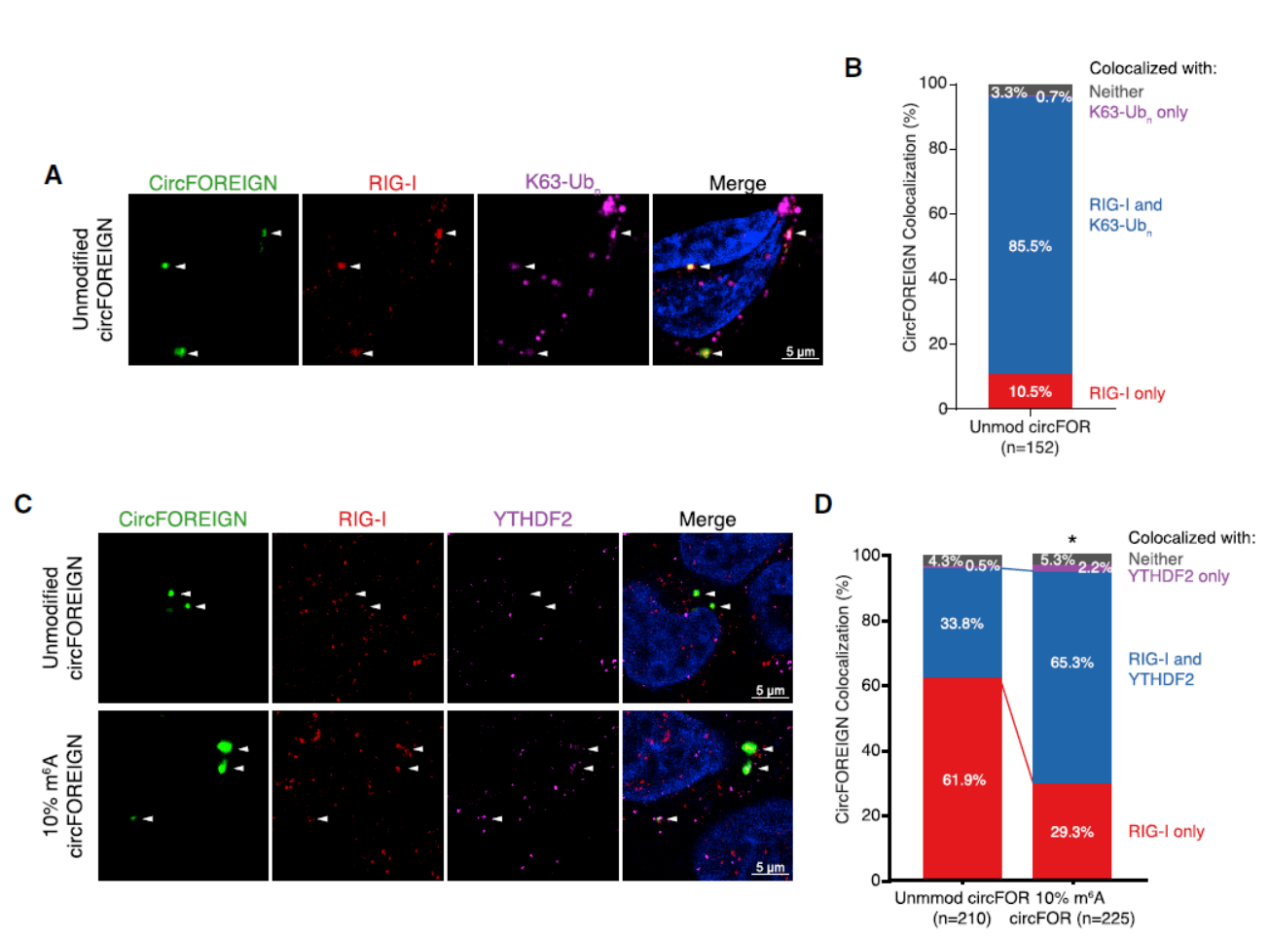
图6 共定位分析 ([1])
总之,本文的机制可以概括为如下示意图:外源circRNA(不携带m6A修饰)可以通过与K63-Ubn和RIG-I结合并促进RIG-I聚合和激活,进而促进下游MAVS的聚合进而诱导IRF3的二聚化激活,最终诱导自身免疫相关通路基因的表达。细胞内源产生的circRNA由于携带m6A修饰,募集并结合了YTHDF2,后者抑制了RIG-I/K63-Ubn/circRNA复合体的活化,最终不会诱发自身免疫效应通路激活。
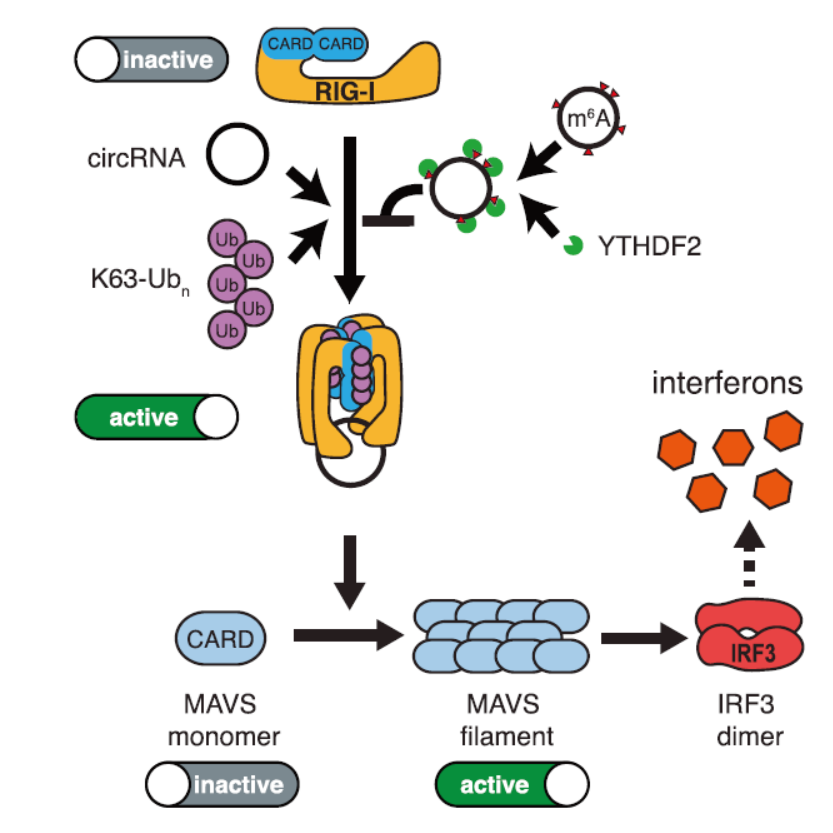
图7 外源circRNA诱导自身免疫效应激活的机制 ([1])
参考文献
1. Y. Grace Chen, R.C., Sadeem Ahmad, Rohit Verma, Sudhir Pai Kasturi, Laura Amaya, James P. Broughton, Jeewon Kim, Cristhian Cadena, Bali Pulendran, Sun Hur and Howard Y. Chang, N6-Methyladenosine Modification Controls Circular RNA Immunity. Molecular Cell, 2019.
2. Chen, Y.G., et al., Sensing Self and Foreign Circular RNAs by Intron Identity. Mol Cell, 2017. 67(2): p. 228-238 e5.
3. Wesselhoeft, R.A., et al., RNA Circularization Diminishes Immunogenicity and Can Extend Translation Duration In Vivo. Mol Cell, 2019. 74(3): p. 508-520 e4.
.png)