1月4日,RNA研究领域迎来2018年开门红,Molecular Cell杂志在线发表了陈玲玲教授和杨力教授为共同通讯作者的文章,介绍发现RNA的m6A修饰会负调控A-to-I修饰作用[1],对circRNA的研究有非常高的参考价值。

本文作者在探索m6A和A-to-I两种常见的RNA修饰方式的过程中意外发现m6A修饰较高的RNA往往对应于较少的A-to-I修饰,因此针对该发现展开了相关机制的探索研究。m6A修饰是近期在RNA研究领域较活跃的研究方向之一,但A-to-I修饰报道就相对少一些,那么A-to-I修饰究竟是怎么回事?作者如何探索两种修饰的相互关系的?得到了什么结论?对circRNA研究有什么启发?带着这一系列的问题,让我们一起来拜读一下这篇新作:
A-to-I修饰是怎么回事?
大量的研究报道发现RNA也有类似DNA和蛋白的化学修饰行为,目前已报道的有超过100种的RNA化学修饰方式,也有学者提出了表观转录组学(Epitranscriptome)的概念。包括RNA的各种甲基化修饰(如m1A,m6A,m5C等等),A-to-I修饰也是RNA的一种修饰方式,是在ADAR酶催化下将腺嘌呤核苷(A)脱氨基后转换为肌苷(I)的修饰过程。A-to-I修饰通常在双链RNA上进行,I碱基互补配对的碱基不再是T或U,而是C,因此这一修饰将明显改变原有核算序列的信息,可能在RNA翻译,高级结构以及RNA分子互作等方面有调控作用[2]。
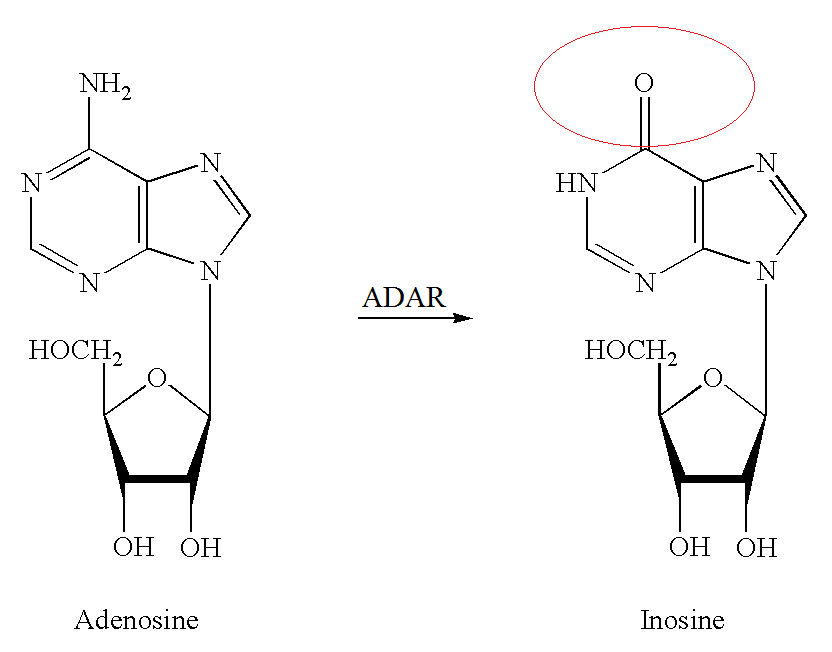
图1 A-to-I修饰作用 (来自网页截图)
A-to-I修饰是不可逆的,需要在双链RNA结构条件下才能发生,所以往往存在于诸如反向Alu元件导致的高级结构中。人类转录组中已发现数以百万计的A-to-I修饰位点,绝大部分位于非编码结构上,如mRNA的5’或3’-UTR区,一些携带Alu元件的早期或中间转录产物等等[1, 2]。A-to-I修饰的功能还不是非常清楚,但有报道显示一些人类疾病与ADAR酶的突变有关,或许与特定的A-to-I修饰有某种未知的关联。
本文探讨的两种RNA修饰方式都是在A碱基上发生的,但m6A修饰是单链RNA中进行的,且为可逆的修饰方式,因此长期以来学术界往往认为两种修饰方式不太可能有相互制约的机制。然而本文的研究中却发现m6A修饰较高的RNA往往对应于较少的A-to-I修饰。接下来就让我们一起回顾学习一下本文的主要内容:
如何探索两种修饰的相互关系?
m6A修饰的RNA可以通过抗m6A修饰的抗体进行RIP实验获得,A-to-I修饰的RNA位点有相关的研究报道,作者通过直接将获取的m6A修饰与不修饰的RNA分子利用计算比对的方法分析与已知的A-to-I修饰位点的关系而获得两者之间的相关性情况。作者首先分析了m6A修饰与不修饰的RNA中A-to-I修饰的情况,令人惊讶的是,A-to-I修饰的往往更集中存在于m6A不修饰的RNA分子中。
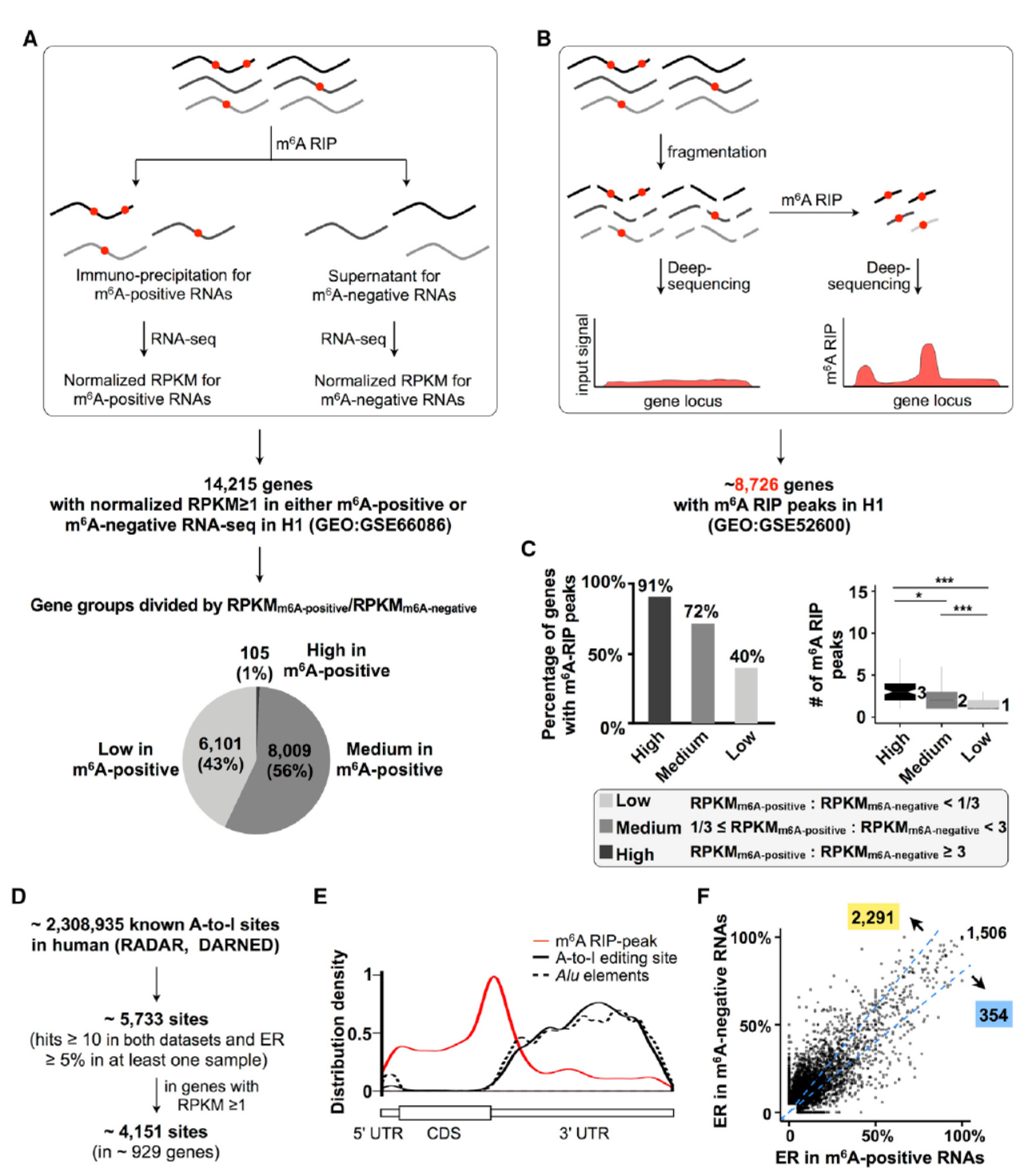
图1 m6A修饰较高的RNA往往对应于较少的A-to-I修饰(来自[1])
为进一步验证该现象,作者挑选了EIF2AK2基因的3’-UTR区进行分析。该基因的3’-UTR区有八个已报道的A-to-I修饰位点,验证实验中可以直接通过cDNA的一代测序,看相应位点的峰形比例确定被A-to-I修饰的比例。该研究中发现了其中的五个位点存在A-to-I修饰(H1细胞中)。与此同时,在EIF2AK2基因的转录产物更倾向于存在于m6A不修饰组。在H9细胞中进一步基于m6A RIP和反转录后cDNA的一代测序,表明其中的七个位点存在明显的A-to-I修饰,且更集中在m6A不修饰的组中。
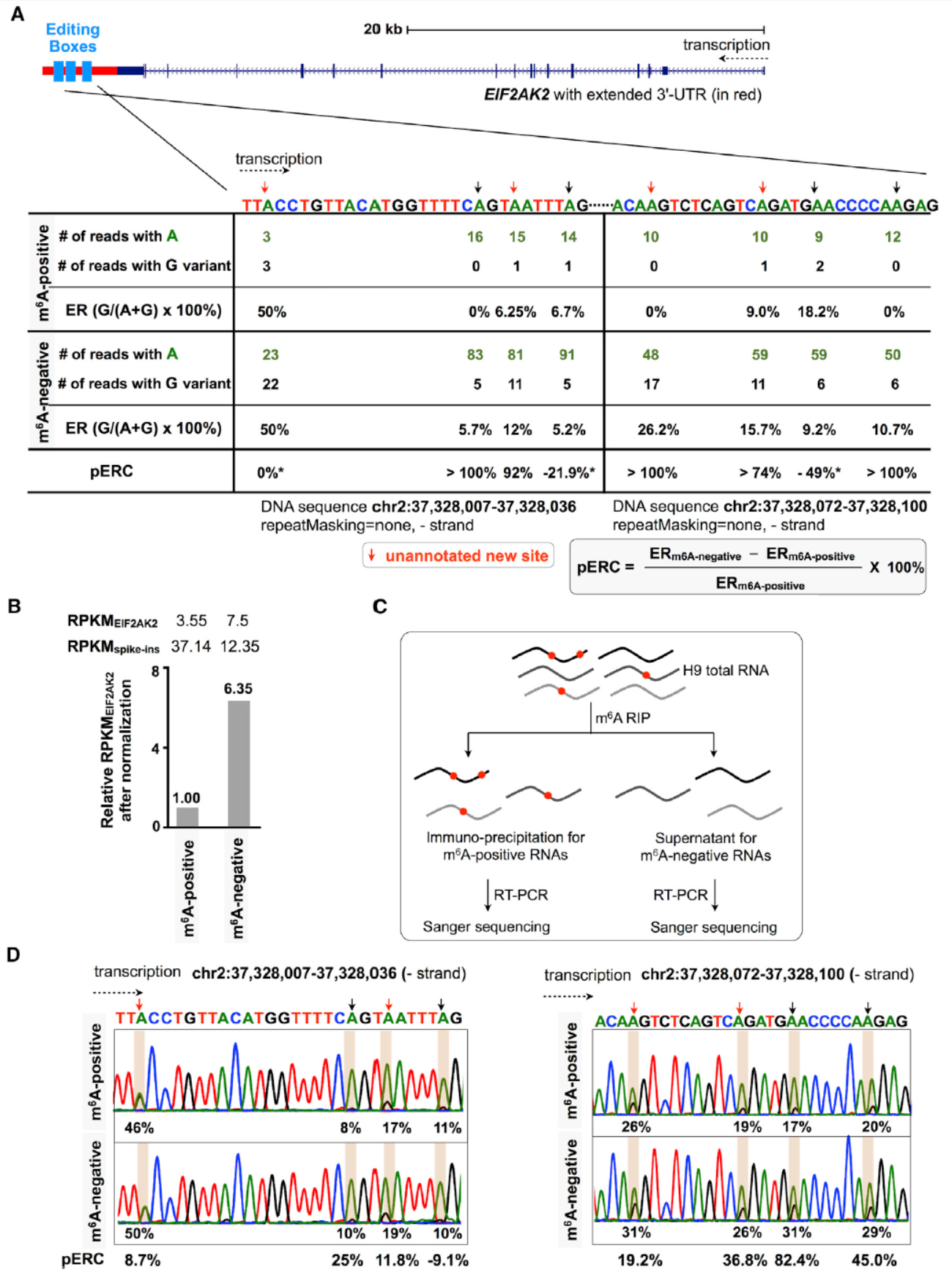
图2 EIF2AK2基因3’-UTR区验证(来自[1])
以上的数据表明两种修饰方式之间存在关联,但还不能证明两种修饰方式之间存在直接的相关性,也可能是一些未知原因导致的伴随现象。为进一步分析两种修饰之间的关系,有效的方法是针对一种修饰方式进行抑制,看是否会对另一种产生影响。m6A修饰的修饰酶(METTL3 和METTL14)和去修饰酶(FTO 和ALKBH5)是都是已知的,针对这些修饰酶进行干扰是最简单有效的选择。因此作者首先针对METTL3 和METTL14分别进行了Knock-Down分析,从相关研究背景分析来看,两种基因的KD并不影响ADAR的表达,说明所观察的变化不是由于影响了ADAR酶的表达量导致的。分析结果表明METTL3 和METTL14 干扰之后会不同程度的影响A-to-I修饰的情况,总体表现为上调该修饰方式,但两种基因的KD后所影响的基因也会有所差别,原因不明。
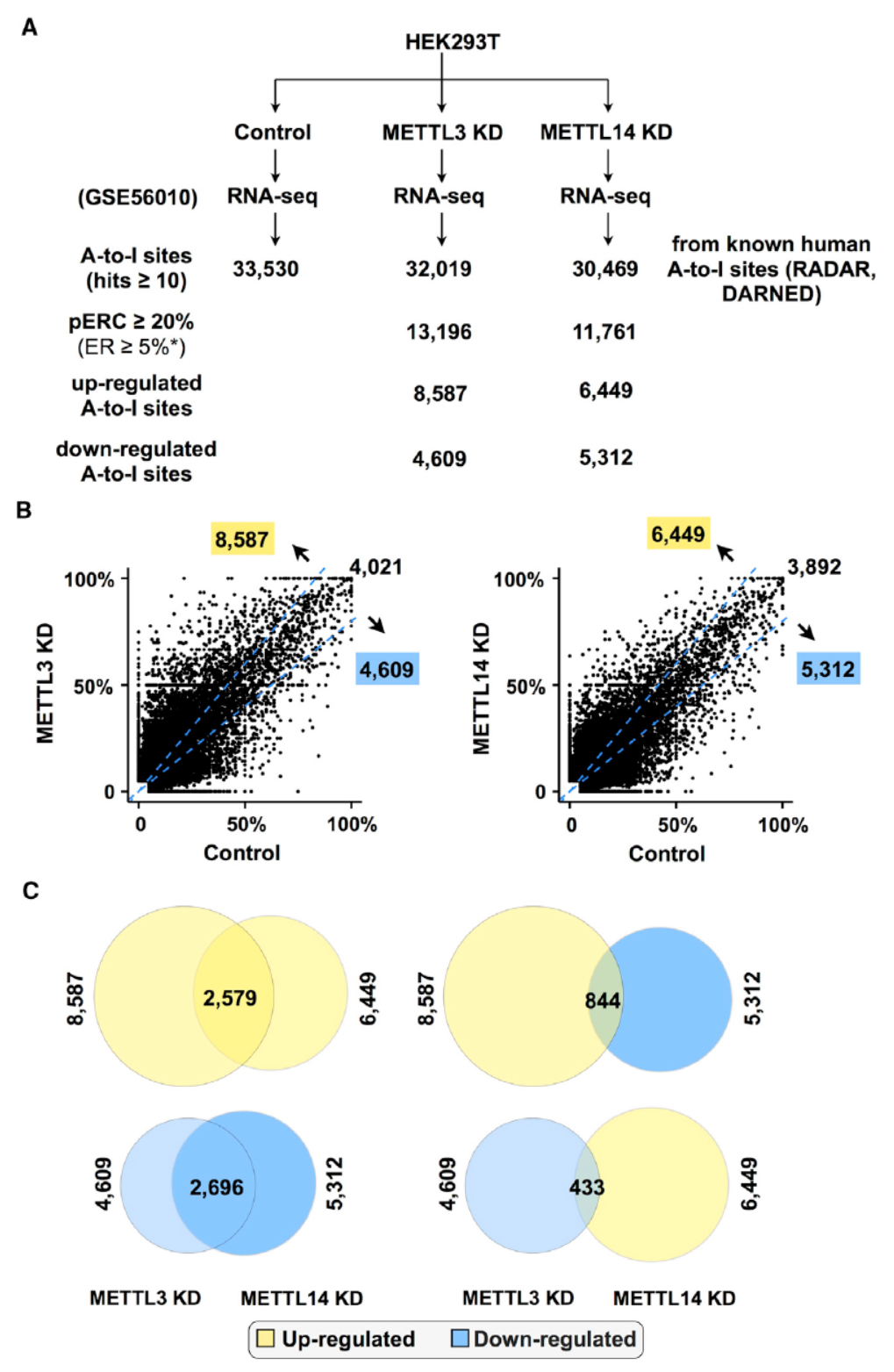
图3 METTL3 和METTL14干扰后增加A-to-I修饰的比例 (来自[1])
到此为止我们可以得出结论:减少m6A修饰会促进A-to-I修饰。造成这种变化的机制是什么呢?为回答该问题,作者挑选了ajuba, snrpd3, gins4, and timm50四个基因进行验证实验,这四个基因都具有较高的m6A修饰和A-to-I修饰,有助于解释相关机制。通过基于Flag标签融合的ADAR1进行RIP后QPCR的实验体系来分析目标RNA分子被A-to-I修饰的效率。结果表明在METTL3 和METTL14双干扰后可促进相关RNA分子与ADAR1的结合。最后作者还利用报告载体进行了模拟验证,证实了相关结论。
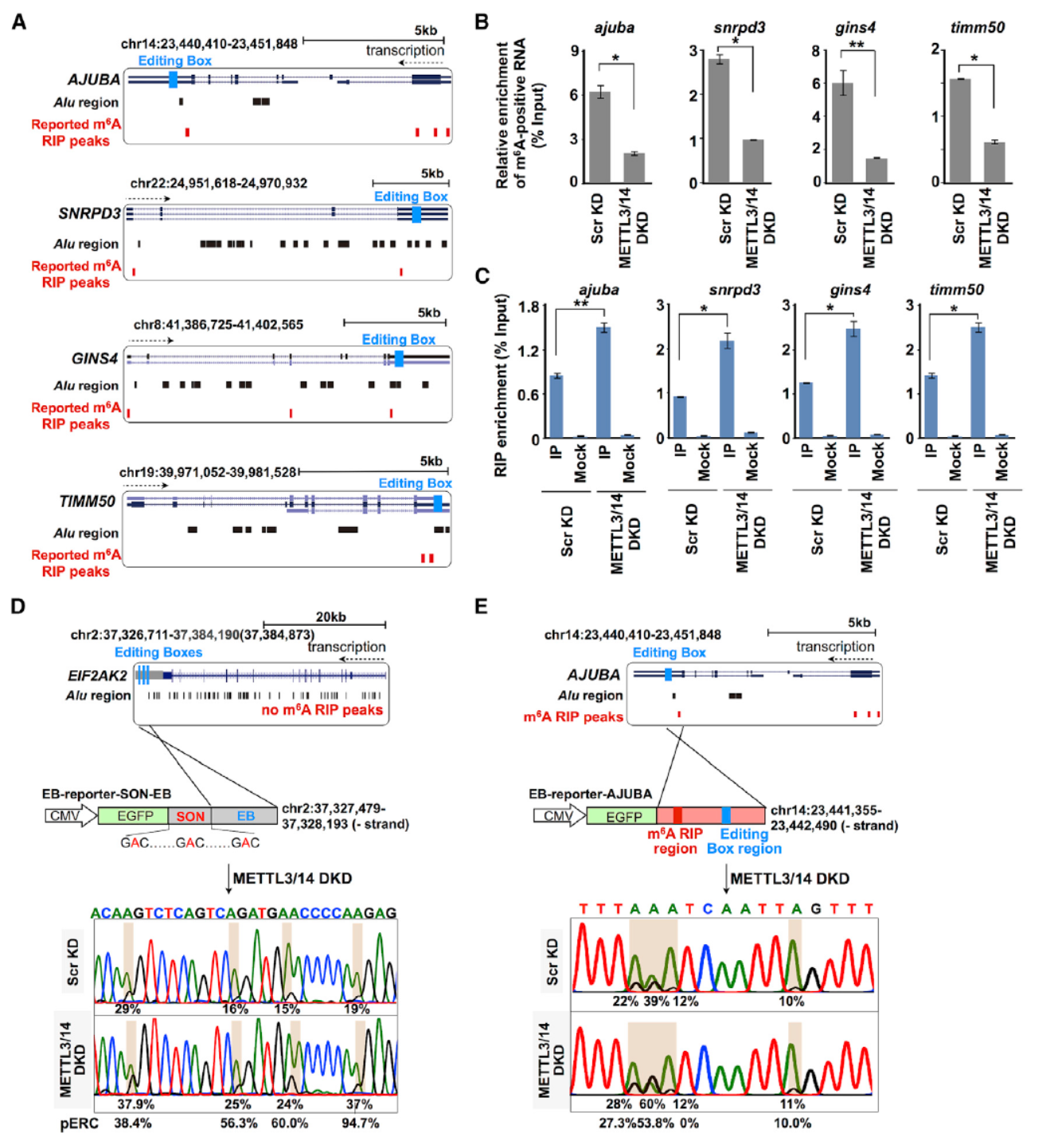
图4 METTL3 和METTL14双干扰后促进RNA分子与ADAR1结合 (来自[1])
本文得到了什么结论?
本文的实验证明了m6A修饰与A-to-I修饰存在负相关的关系,m6A修饰越高的RNA越不容易进行A-to-I修饰。相反,针对m6A修饰酶进行抑制后能促进A-to-I修饰,可能的机制是促进相关RNA分子与ADAR1酶的结合。
对circRNA的研究有什么启发?
早在2015年,Nikolaus Rajewsky教授就曾报道ADAR可抑制circRNA的生成[3]。主要的机制可能是ADAR介导的A-to-I修饰,降低反向互补Alu元件之间的互补配对能力,进而抑制circRNA的生成。
从已报道的资料来看,人类基因组中ADAR介导的A-to-I修饰主要集中在以Alu元件为代表的非编码区,而富含Alu元件的基因更多的是神经系统相关的基因[2]。有学者认为A-to-I修饰是进化中保留下来的调控Alu元件的一种适应性机制,增加RNA转录本的多样性,也或者让携带Alu元件的RNA保留在核内,减少双链RNA介导的天然免疫作用的微妙机制[2]。A-to-I修饰会抑制circRNA的生成,m6A修饰也已经报道存在于circRNA和所对应的mRNA中,有没有可能本文所发现的m6A修饰影响A-to-I修饰的过程也参与了circRNA的形成和功能等方面的调控作用?这个问题值得探索。
参考文献:
1. Xiang, J.F., et al., N(6)-Methyladenosines Modulate A-to-I RNA Editing. Mol Cell, 2018. 69(1): p. 126-135 e6.
2. Yablonovitch, A.L., et al., The evolution and adaptation of A-to-I RNA editing. PLoS Genet, 2017. 13(11): p. e1007064.
3. Ivanov, A., et al., Analysis of intron sequences reveals hallmarks of circular RNA biogenesis in animals. Cell Rep, 2015. 10(2): p. 170-7.
.png)