新年甫至,万象更新,藉此新年佳节之际山人预祝各位身体健康,工作顺利。刚刚过去的2018年,circRNA取得了不凡的进步,国家自然科学基金获批项目总数增长45%,发表论文数目增长143 %,学科覆盖更加广泛,传统的circRNA活跃领域依然持续发力。下面我们针对circRNA的基金,文章及所涉及的学科领域进行详细汇总分析:
1. 2018年circRNA基金与论文发表情况概述:
1.1 2018年国家自然科学基金circRNA相关基金项目情况汇总
2018年circRNA研究领域在国家自然科学基金中又是一个丰收年,共有258项与circRNA相关的项目获批,其中优秀青年基金项目1项,国际(地区)合作与交流项目1项,面上项目133项,地区基金项目24项,青年科学基金项目99项。涉及的学科方向更加广泛,也呈现的一些特征,概括而言包括:
(1) 医学学科依然是circRNA研究的主要阵地,肿瘤学和循环系统方向是目前circRNA研究最好活跃的学科方向,其他医学学科方向正在慢慢兴起。
(2)circRNA竞争性结合miRNA的机制依然是研究最多的机制模型,但一些新的方向正在悄然兴起,包括circRNA翻译蛋白,与蛋白相互作用等。
(3)circRNA的分子机制总体还是太单一,仍需要开发更有效的分析研究工具。
近三年国家自然科学基金获批数统计如下:
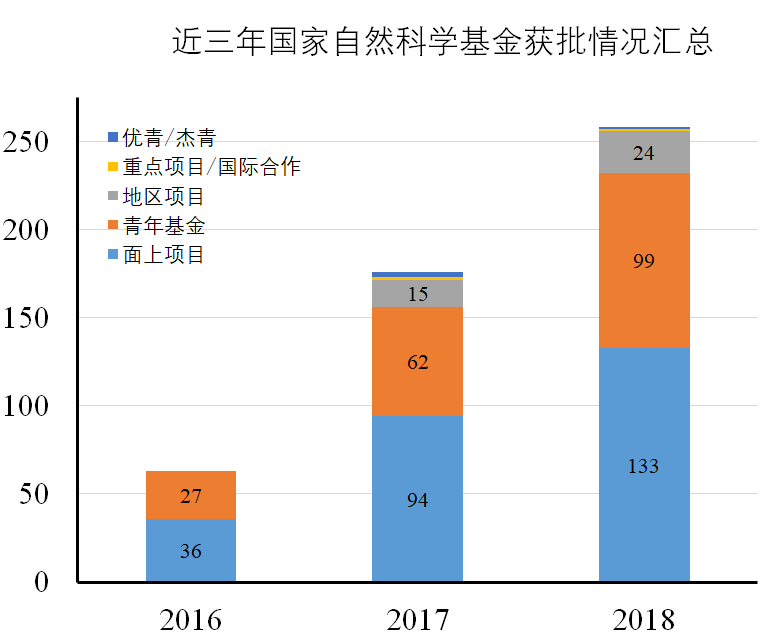
图1 近三年国家自然科学基金circRNA相关项目汇总
1.2 2018年circRNA相关论文发表情况汇总
2018年circRNA研究论文也表现不俗,相对于2017年发表论文总数目实现了143%的增幅,总数量翻了一倍多,覆盖的学科方向更加广泛,医学依然是主要的领域,以肿瘤学为主。2018年circRNA研究论文总体呈现了一些新的特点和趋势,总结而言包括:
(1) 肿瘤学是circRNA发表论文的绝对主力,占了2018年全部circRNA相关论文发表总数的%,涉及的肿瘤类型也更加广泛,包括 肿瘤也在2018年发表了研究论文。
(2)发表论文的主题从高通量筛选过渡至特定分子的功能和机制研究。2018年报道特定circRNA分子功能的文献共有158篇,远高于2017年及之前,说明circRNA研究已经进入特定分子功能研究的阶段。
(3)特定circRNA分子与其来源基因的相互作用关系报道增多。
(4)circRNA基础生物学机制相关研究报道有所下降,包括circRNA的生成机制,新功能模式(包括相互作用分子分析,编码多肽的研究等),RNA修饰,二级结构分析等等,这些基础问题的重要性显而易见,但相关研究报道不太多,可能是由于相关技术分析难度较大,不易快速形成论文成果。
近三年circRNA论文发表情况汇总如下:
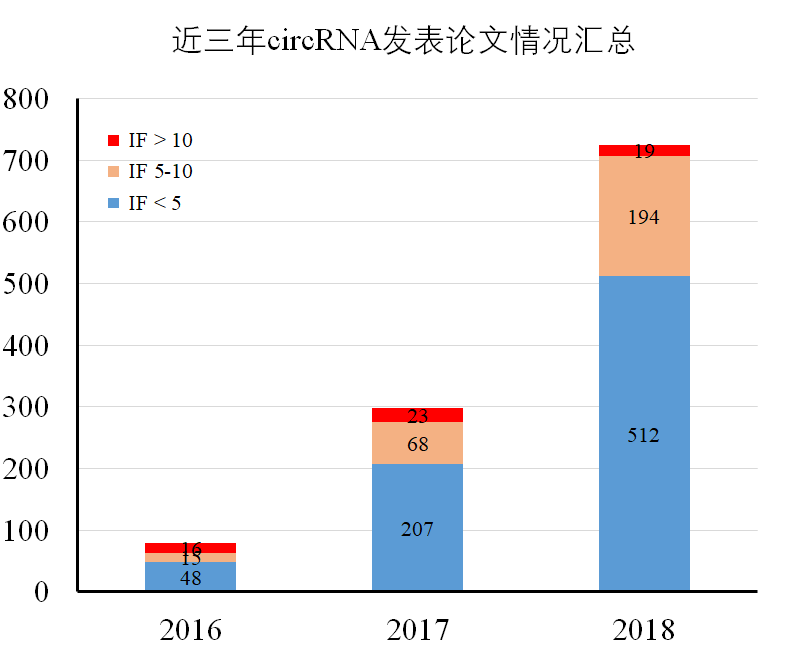
图2近三年circRNA论文发表情况汇总
按学科划分,主要发表circRNA研究成果的学科方向和疾病类型汇总论文数目列表如下:
| 学科/疾病类型 | 发表论文数 |
| 基础生命科学 | 32 |
| 乳腺癌 | 26 |
| 肺癌 | 50 |
| 肝胆肿瘤 | 41 |
| 胶质瘤 | 26 |
| 结肠直肠癌 | 22 |
| 胃癌 | 19 |
| 胰腺癌 | 15 |
| 食管癌/口腔癌/喉癌 | 17 |
| 骨肉瘤 | 19 |
| 膀胱癌 | 20 |
| 其他类型肿瘤 | 69 |
| 心血管疾病 | 24 |
| 其他疾病 | 104 |
| 研究方法 | 52 |
| 动物模型与动物学相关研究 | 72 |
| 植物/真菌 | 25 |
| 综述 | 92 |
图3 circRNA相关论文学科分布情况
2. circRNA基本生命科学问题研究进展
2018年circRNA基础生命科学研究方面取得的重大进展不算太多,主要包括circRNA出核机制的报道,内含子来源的套索circRNA在胞质中大量存在,反式拼接产物与circRNA的关系,病毒circDNA基因组表达circRNA产物,环形RNA(Cia-cGAS)参与造血干细胞静息状态调控等等。下面就让我们一起回顾一下吧:
CircRNA出核机制
5月17日,Genes & Development杂志在线发表了宾夕法尼亚大学佩雷尔曼医学院Jeremy E. Wilusz博士为通讯作者的文章,介绍发现了一种调控circRNA转录后出核的机制[1]。

本文作者首先在果蝇中基于shRNA筛选,发现干扰Hel25E后明显导致核内circRNA的富集,进一步验证后表面果蝇中Hel25E是介导circRNA转录后出核的重要调控因子。作者进一步在人的细胞中分析Hel25E的同源分子的作用情况,结果表面Hel25E的同源蛋白UAP56 (DDX39B) 和URH49 (DDX39A)均可介导circRNA的出核,更有趣的是,UAP56主要负责大分子量的circRNA的出核,而URH49主要负责小分子circRNA的出核[1]。这一重大发现初步揭示了circRNA转录后出核的机制,为进一步探索circRNA亚细胞定位的机制提供了重要参考依据,是circRNA机制研究的重大进展。针对这一重大发现,在RNA Biology杂志,Genes & Development杂志和Non-coding RNA Investigation杂志专门做了综述和专题报道[2-4]。
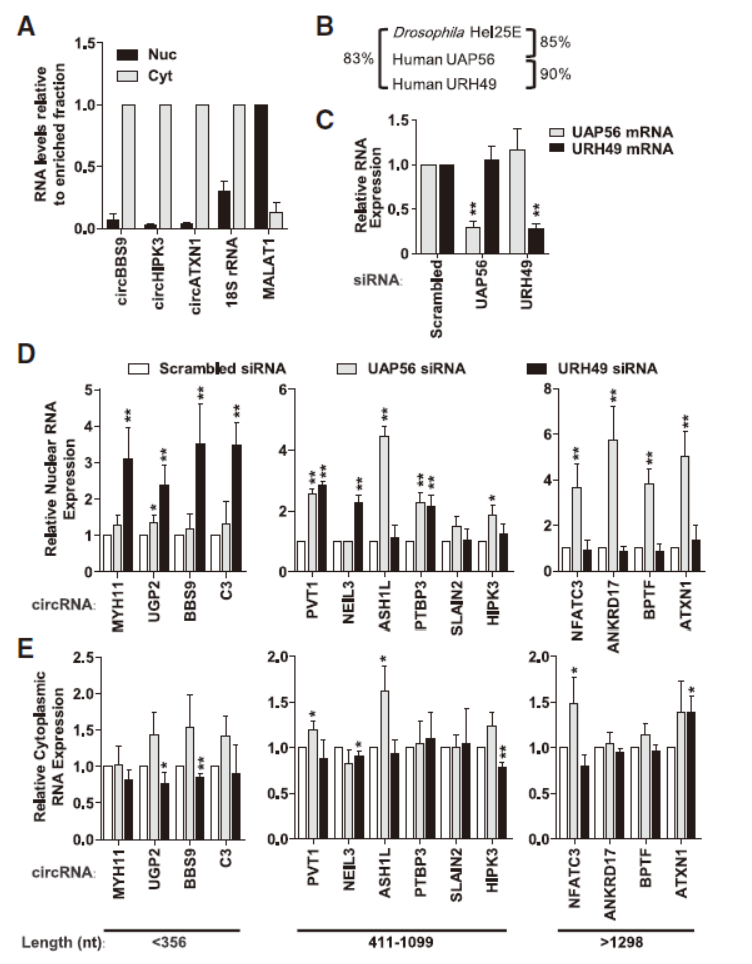
图4 UAP56和URH49分别调控大分子量和小分子circRNA出核 (来自[1])
转录后分子间反式拼接形成的tsRNA与CircRNA的关系
1月27日的Nucleic Acids Research杂志在线发表了一篇研究论文,报道非共线性(Non-Co-Liner, NCL)转录产物不仅包含传统的circRNA,还可能是分子间反式拼接的产物。该文章的通讯作者是台湾中央研究院基因组研究中心的Trees-Juen Chuang[5]。

将tsRNA的表达与circRNA的表达进行比较和分析具有非凡的意义,对circRNA的研究有重要的启发价值。区分tsRNA和circRNA其实是很简单的,tsRNA是依然是线性的RNA分子,带有Poly(A)尾,可以通过oligo-dT进行富集和反转录验证,而circRNA理论上耐受RNase R的消化,可以通过RNase R消化加以区分。从本文的结果来看,tsRNA的丰度普遍不高,且往往与circRNA伴生,在研究特定circRNA的时候需要增加分析是否存在tsRNA的步骤,如果证明的确有tsRNA,则需要进一步分析tsRNA和circRNA的表达丰度,结合RT-PCR后Sanger测序等技术的手段弄清楚tsRNA和circRNA的序列,在此基础上设计针对不同分子形式的siRNA,这对于解释相关的机制非常重要。
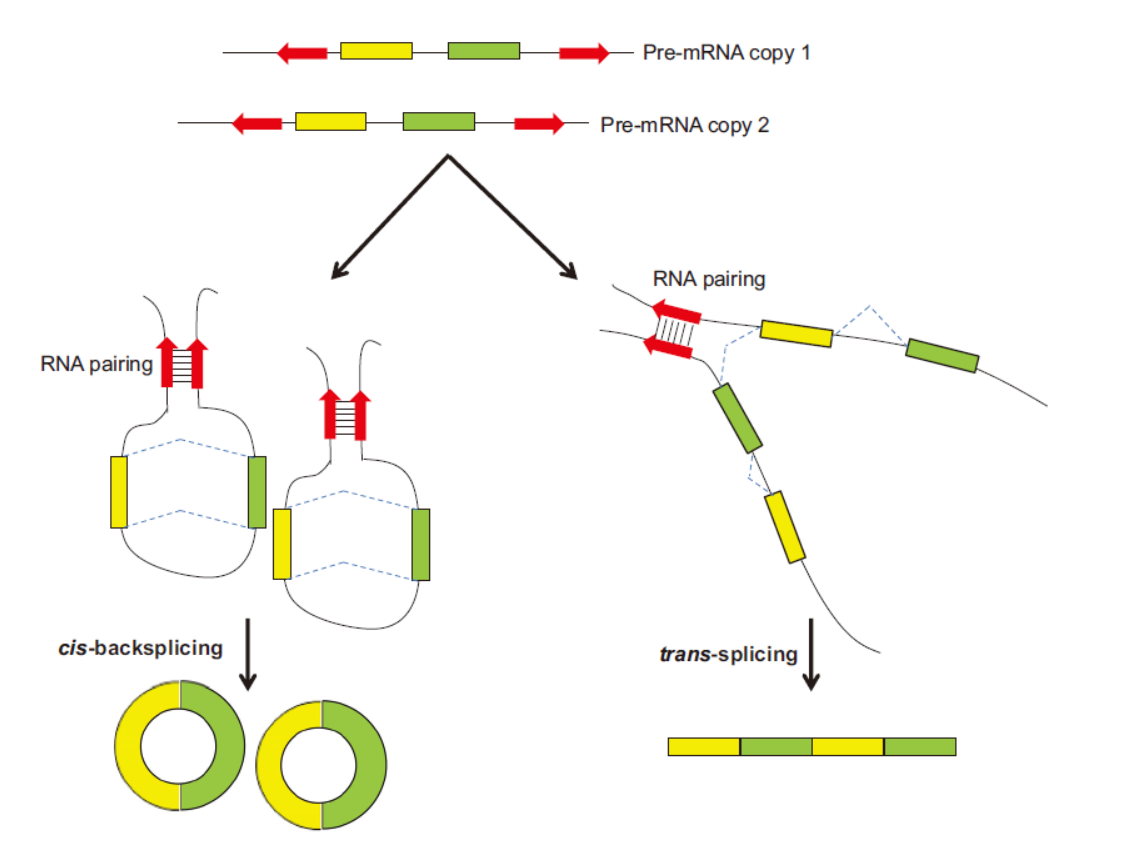
图5 反式拼接与反向拼接 (来自[5])
脊椎动物细胞质中存在内含子套索circRNA
8月21日,PNAS杂志在线发表了卡内基理工学院Joseph G. Gall教授为通讯作者的文章介绍发现脊椎动物细胞质中广泛存在内含子来源的套索circRNA[6]。

之前大家普遍认为内含子序列在RNA转录后剪接作用后很快会被清除,但本文作者发现在脊椎动物的细胞质中存在大量内含子来源的套索形成的circRNA(5’→2’共价交联的分子),来源于数百种不同的基因。在类,老鼠,鸡,青蛙和斑马鱼的细胞里发现了它们[6]。这些分子在胞质中的作用还未知。
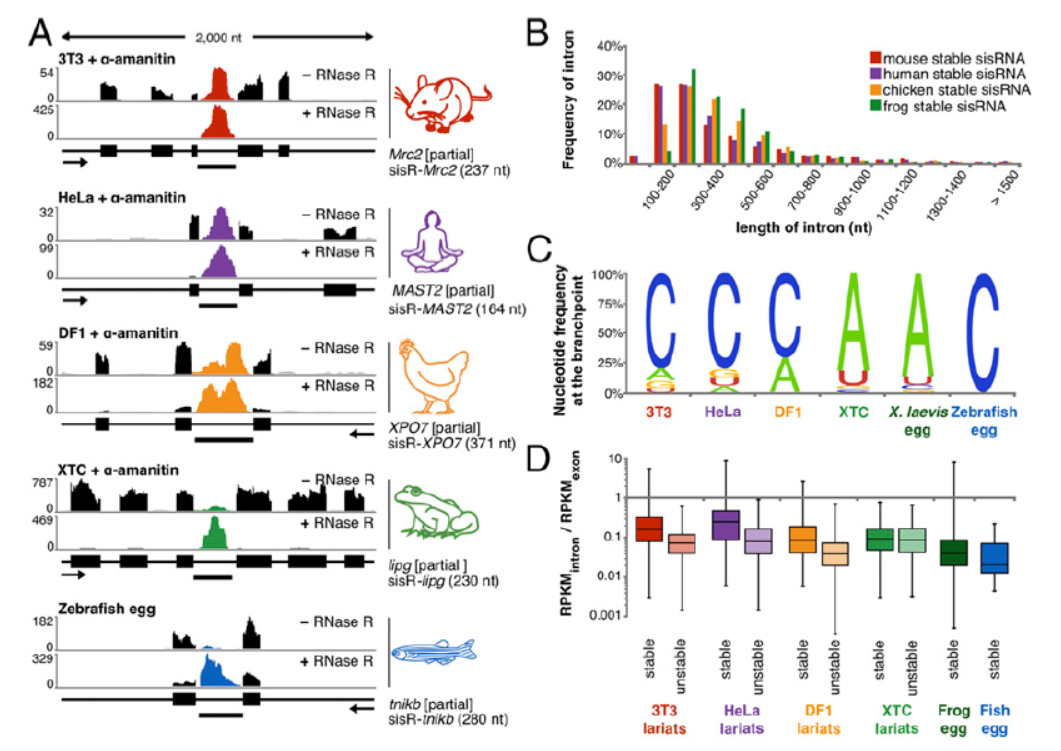
图6 脊椎动物细胞质中存在大量内含子来源的套索circRNA (来自[6])
病毒环形DNA基因组表达环形RNA产物
8月27日,PNAS杂志在线发表了一项有趣的研究:发现环状DNA病毒基因组能够表达环状RNA的产物!文章的通讯作者是匹兹堡大学的Patrick S. Moore和Yuan Chang[7]。

本文报道的故事概括而言,就是报道发现了两种环状DNA基因组的γ-疱疹病毒:EB病毒(EBV)和卡波西肉瘤病毒(KSHV)可以转录产生病毒基因来源的circRNA分子,EBV病毒能够在BART基因区产生仅有外显子组成的circRNA或同时携带外显子和内含子的circRNA分子,前者在胞质和核中均有定位,后者主要定位于核内。KSHV病毒在IRF4和PAN基因区均发现有对应的circRNA生成,它们在胞质和核内均有分布,其中PAN基因来源的circRNA为簇,且正负两条链都有相应的产物。作者还分析了这些circRNA翻译的潜能,从实验数据来看被核糖体捕获的circRNA偏少,这些circRNA更倾向于分布在游离的RNA,但也不能排除这些circRNA可翻译的可能性[7]。本文为我们呈现了一个非常有趣的现象:环状DNA基因组的病毒在宿主细胞中能够表达出环状RNA的产物,不得不感叹自然进化的玄妙!
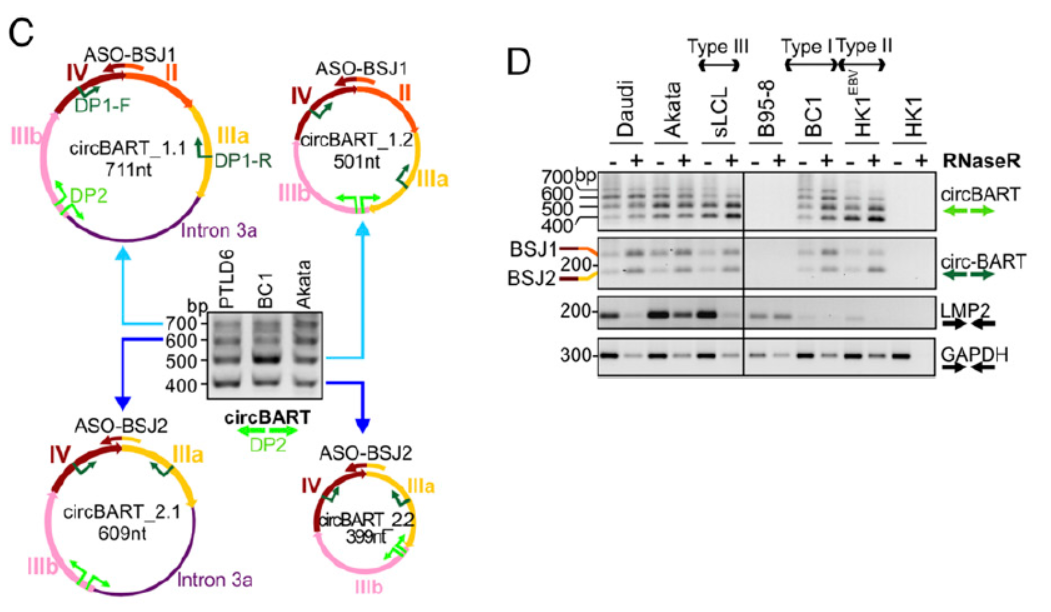
图7 circBART测序鉴定(来自[7])
大脑中一种RNA互作网络:
7月12日,Cell 杂志发表了MIT的David P. Bartel为通讯作者的文章,介绍发现了一个在人类大脑中的RNA间相互作用的调控网络[8]。

该网络由一种lncRNA (Cyrano),一种circRNA (CDR1as)和两种miRNA分子(miR-671和miR-7)之间相互调控的微妙网络体系。Cyrano可以促进miR-7的降解,这有利于维持CDR1as的丰度,之前报道也证明miR-671会通过与CDR1as互补促进后者的降解。因此四种分子会出现此消彼长的微妙调控机制[8]。
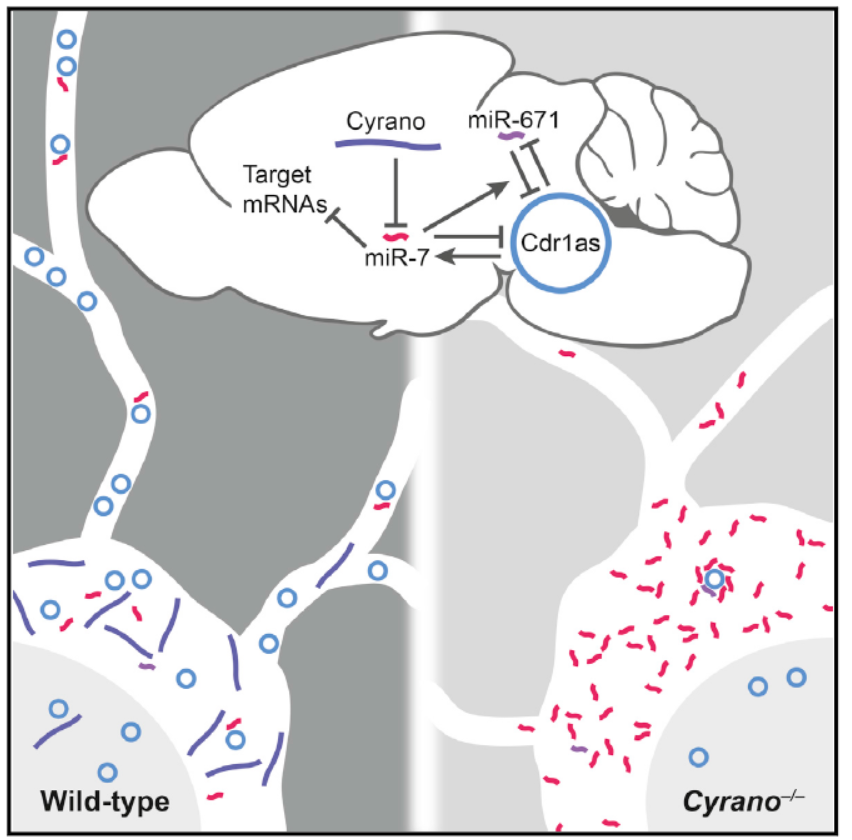
图8 四种RNA分子形成的精密的调控网络 (来自[8])
环形RNA(Cia-cGAS)参与造血干细胞静息状态调控
4月3日,知名免疫学杂志Immunity在线发表了中科院生物物理所范祖森教授与王硕研究员为共同通讯作者的文章,介绍发现环形RNA Cia-cGAS(作者自己命名)定位于细胞核中,可结合DNA敏感的cGAMP合酶cGAS并抑制其活性,调控长效造血干细胞(LT-HSC)静息状态[9]。

本文作者首先基于高通量测序比较了小鼠中LT-HSC,ST-HSC和MPPs中全转录组变化情况,这其中共发现了156种存在明显表达差异的circRNA分子,其中49种在LT-HSC中表现为上调。进一步的表达验证中发现有9种circRNA分子在LT-HSC中存在明显的上调。然后通过shRNA实验分析功能,发现其中只有来自D430042O09Rik的circRNA Cia-cGAS干扰后明显改变造血干细胞的亚群分布,因此锁定研究目标为Cia-cGAS分子。作者进一步验证了只有干扰Cia-cGAS才能有明显的效应,而单独干扰D430042O09Rik并无明显表型。然后基于迷你基因载验证,证明Cia-cGAS序列下游的反向互补序列是促进其生成的关键,于是作者通过Cas-9基因敲除策略成功构建了Cia-cGAS基因敲除小鼠。在Cia-cGAS基因敲除小鼠中作者发现LT-HSC明显减少,I型干扰素表达升高。通过RNA Pull-down实验,作者鉴定到Cia-cGAS可以与cGAS结合,又通过RIP,RNA Pull-down,FISH共定位以及EMSA等实验验证了这一相互作用,进一步,作者还通过预测分析结合突变实验分析了Cia-cGAS与cGAS相互作用的位点信息。酶学功能研究证明,Cia-cGAS与cGAS相互作用能够抑制cGAS的活性[9]。
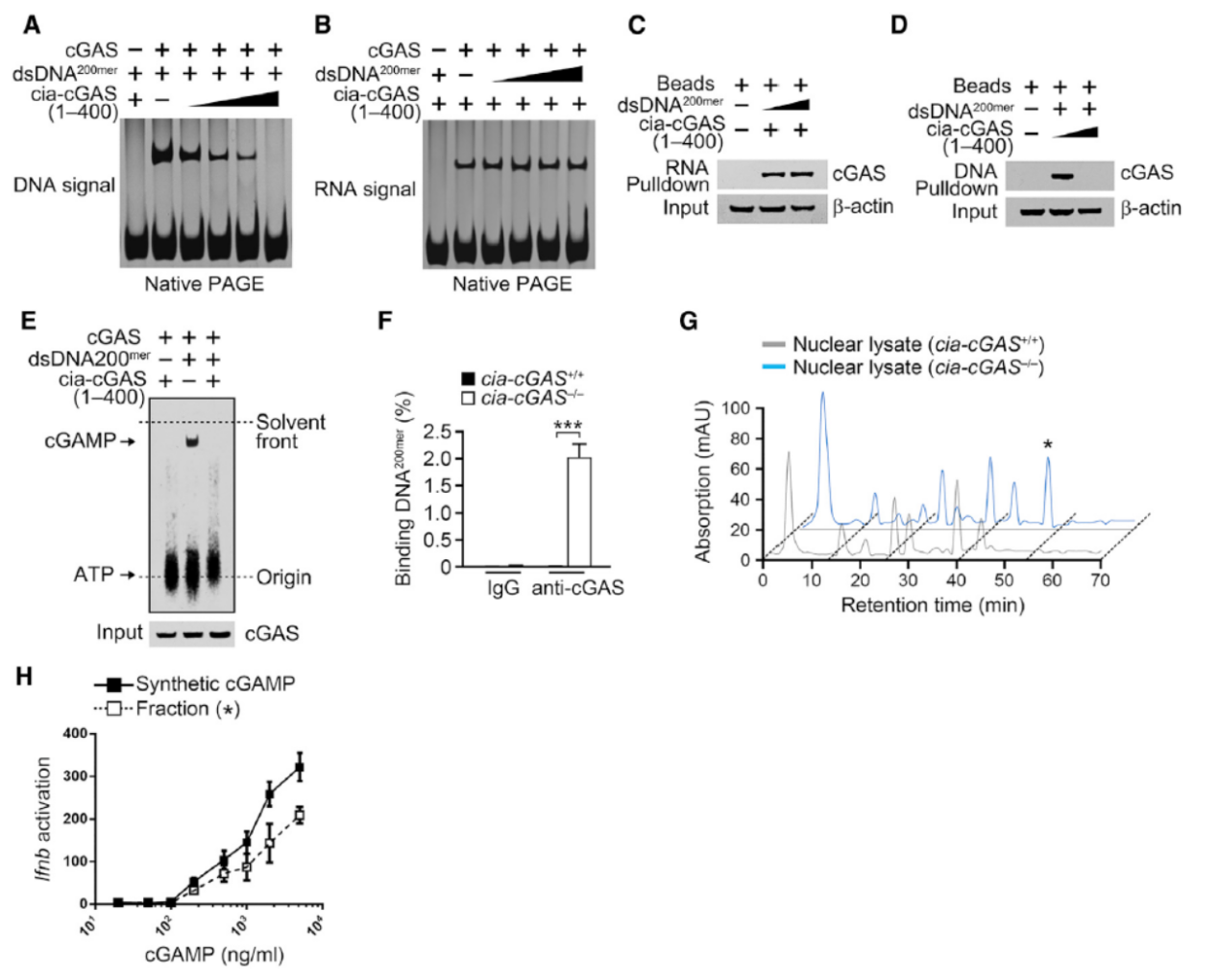
图9 Cia-cGAS结合cGAS抑制cGAS的功能 (来自[9])
多篇文章介绍组织特异性circRNA表达研究:
2018年有多篇文章报道了组织特异性的circRNA表达特征研究:7月30日Nucleic Acids Research杂志报道人类血液细胞中circRNA广泛表达,且存在细胞特异性[10]。4月24日,Genomics杂志报道人胎儿大脑发育过程中环状RNA表达模式的变化[11]。RNA杂志报道心肌中circRNA主要来源于保守性外显子,而非可变剪切[12]。Non-coding RNA杂志报道胰岛β-细胞中存在细胞特异性的circRNA表达特征[13]。Scientific Reports报道大规模探索人体组织中circRNA的表达情况[14]。
3. circRNA与疾病相关性研究进展
circRNA表达特征与人类疾病的相关性是circRNA研究报道最多的领域,也是国家自然科学基金获批最多的方向。以肿瘤为主,还包括心血管疾病,神经退行性疾病等等。由于该方向发表的论文数量非常庞大,思路又极为相似,因此总结的过程我们只挑选其中最有代表性的成果进行展示。
3.1 circRNA与肿瘤
2018年肿瘤学相关circRNA的报道非常多,涉及的肿瘤类型较以往也有很大的增加。主要的肿瘤类型包括乳腺癌,胶质瘤,肺癌,肝癌,胃癌,结肠直肠癌,胃癌,胰腺癌等等。具体每种肿瘤类型涉及的文章数目已在前面汇总,下面主要挑选其中最有代表性的几项研究工作:
LINC-PINT来源CircRNA编码多肽在胶质瘤中抑制癌基因表达
10月26日,Nature Communications杂志在线发表了中山大学附属第一医院张弩为通讯作者的文章,报道来自LINC-PINT的一种circRNA能够编码一种87aa的多肽,具有抑制胶质瘤发生发展的作用[15]。

本研究前期通过高通量转录组和翻译组测序分析发现长非编码RNA LINC-PINT的2号外显子可单独形成Circ-PINT的环状RNA,Circ-PINT包含一个完整的开放阅读框,可能编码多肽,进一步通过制备针对该多肽的特异性抗体并结合CRISPR/cas9基因敲除细胞株等实验,证实Circ-PINT可通过核糖体进入位点序列IRES翻译出87个氨基酸组成的全新多肽PINT87aa通过结合聚合酶相关因子复合物基因PAF1,抑制多种癌基因的转录延伸,进而抑制恶性胶质瘤的发生和进展,细胞功能实验表明PINT87aa通过结合聚合酶相关因子复合物基因PAF1,抑制多种癌基因的转录延伸,进而抑制恶性胶质瘤的发生和进展,体内动物实验,在小鼠脑部原位以及皮下成瘤实验中过表达PINT87aa蛋白的肿瘤细胞,成瘤能力大大减弱,动物生存期延长,而基因敲除低成瘤细胞中circ-PINT的编码区的部分序列后,动物的成瘤能力得到增强,证实环状RNA circ-PINT翻译的多肽具有抑制肿瘤的作用。该研究结果提示环状RNA编码的多肽产物可能在恶性肿瘤诊断、预后及靶向治疗方面具有重要的研究意义[15]。
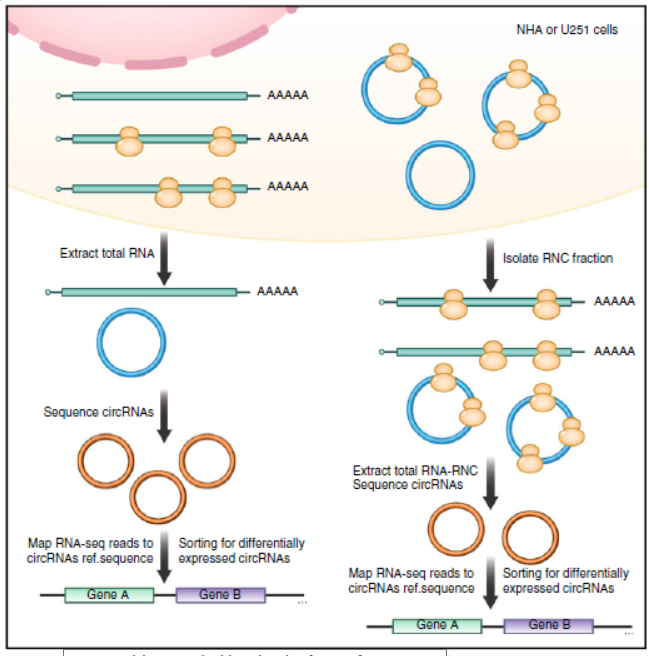
图10 LINC-PINT的一种circRNA能够编码多肽 (来自[15])
circRNA调控细胞自噬
7月4日,Oncogene杂志在线发表了加拿大多伦多大学杨柏华教授为通讯作者的文章,介绍发现环形RNA circ-Dnmt1 通过调控p53和AUF1入核,促进细胞自噬作用[16]。

Circ-Dnmt1是DNMT1基因第6和7外显子反向拼接形成的,作者是通过芯片分析发现乳腺癌细胞中普遍存在circ-Dnmt1高表达的现象,因此针对该分子的作用机制展开了研究。过表达circ-Dnmt1能促进细胞增殖,并且能增加对应的Dnmt1的成熟的mRNA水平,但对该基因的转录出产物pre-mRNA没有影响。过表达circ-Dnmt1能促进细胞自噬,免疫荧光实验表明p53和AUF1在circ-Dnmt1过表达后核定位增加了,RIP实验证明了circ-Dnmt1可以与p53和AUF1相互作用。核定位的p53促进自噬相关基因的表达,而核定位的AUF1不能继续调控Dnmt1的mRNA降解作用,导致该mRNA富集并促进DNMT1蛋白的表达。小鼠皮下肿瘤模型实验表明过表达circ-Dnmt1显著增加肿瘤的体积[16]。
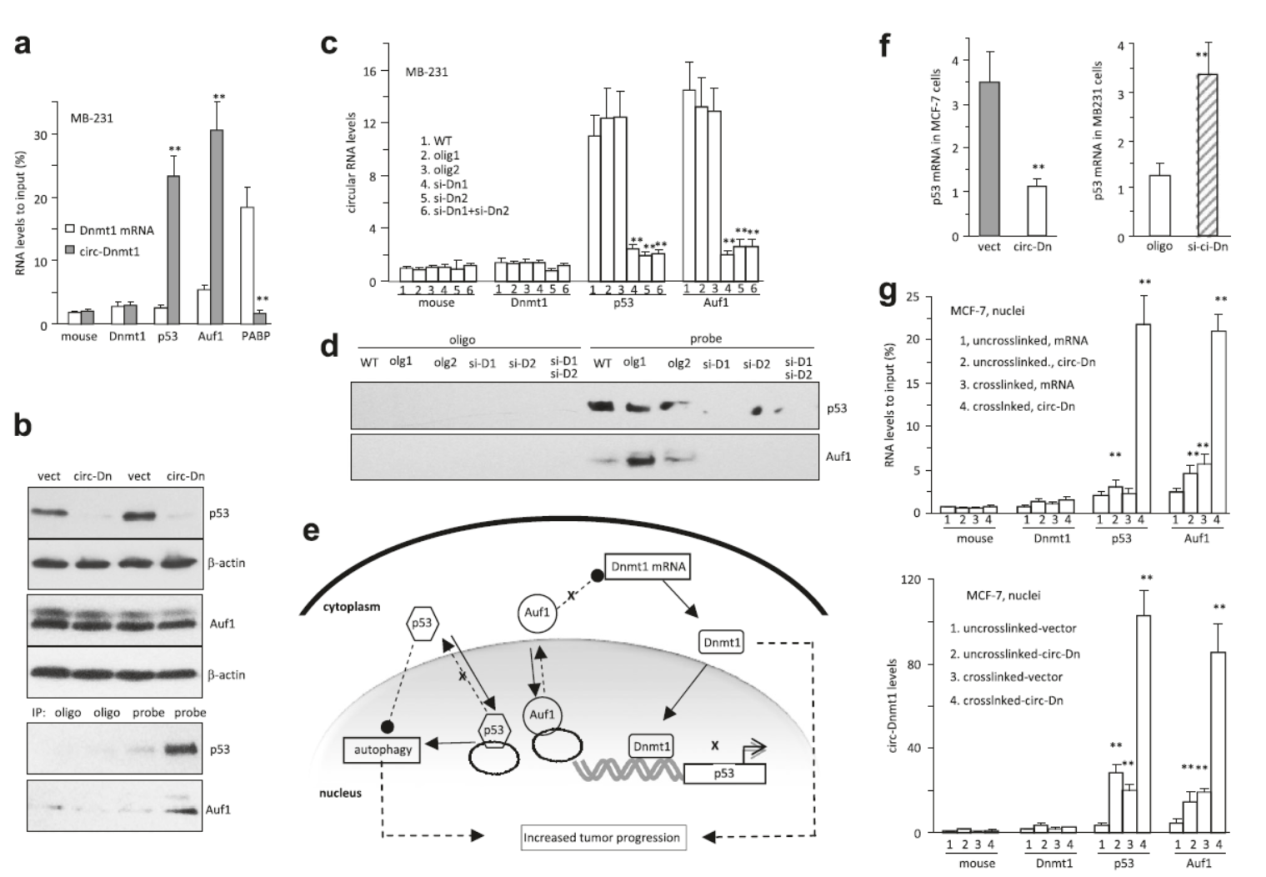
图11 circ-Dnmt1可与p53和AUF1相互作用 (来自[16])
乳腺癌中circ-Ccnb1抵消p53突变的效应
5月23日,Nature子刊Cell Death & Differentiation杂志在线发表了加拿大多伦多大学杨柏华教授为通讯作者的文章,介绍发现乳腺癌中circ-Ccnb1能够抵消p53突变的效应,发挥抑制肿瘤的作用[17]。

circ-Ccnb1由CCNB1基因的第四和第五外显子反向拼接形成,作者发现circ-Ccnb1在乳腺癌中特异性的降低。基于RNA Pull-down筛选相互作用蛋白,最终发现了circ-Ccnb1可以通过H2AX与p53或Bclaf1相互作用相互作用,并且突变型的p53中,circ-Ccnb1可通过H2AX与Bclaf1相互作用,发挥抑癌相关的基因转录功能。体内模型中也证明稳定过表达或直接注射circ-Ccnb1过表达质粒均可显著抑制肿瘤生长,未来或许可以开发出基于circ-Ccnb1的肿瘤治疗策略[17]。
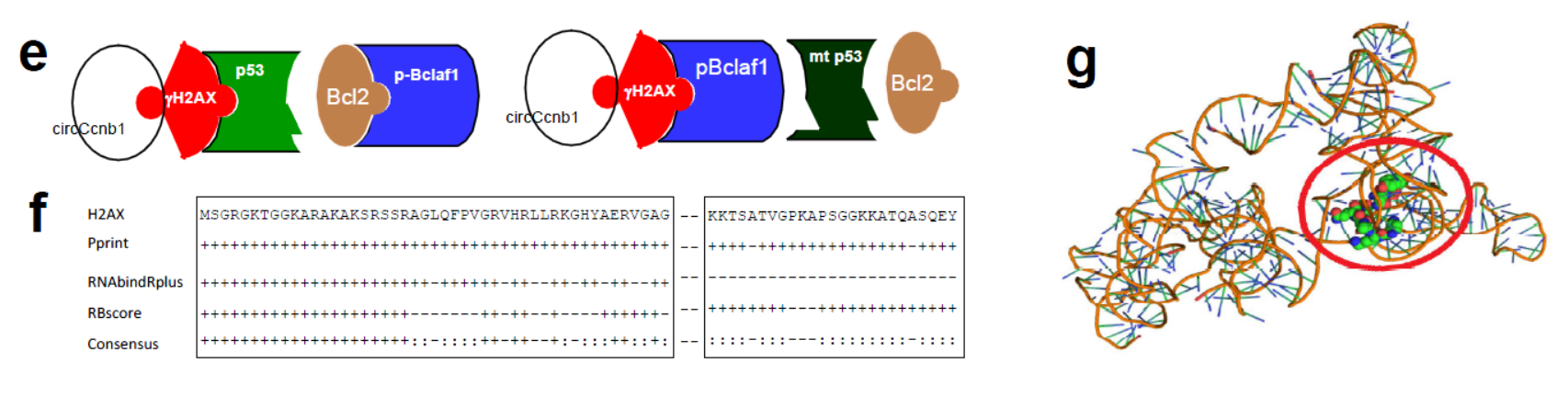
图12 circ-Ccnb1互作蛋白机制 (来自[17])
circRNA参与启动子表观遗传调控
12月11日,Genome Biology杂志在线发表了吉林大学附属第一医院胡继繁和崔久嵬为共同通讯作者的文章,介绍发现来自FLI1基因的circRNA能参与调控基因启动子的甲基化修饰[18]。

与常规的circRNA研究论文不同,本文作者一开始是希望探索FLI1基因在乳腺癌中表达增高的机制,从FLI1基因的启动子结合分子入手。作者采用了一种基于dCas9(没有内切酶活性的Cas9突变体,依然具有基于gRNA的精确基因组定位功能)的免疫共沉淀分离技术(CasIP),在所钓取的分子中意外发现了来自FLI1基因的由外显子2-4形成的circRNA(作者将其命名为FECR1),作者发现过表达FECR1能促进细胞侵袭。进一步,作者通过RAT分析(基于反转录的分子捕获分析),作者发现了在乳腺癌中受FECR1调控的下游基因,这些基因主要与细胞增殖调控有关。FECR1在FLI1基因的结合位点主要是启动子区的CpG岛,FECR1促进该区域的去甲基化。有趣的是,DNMT1基因也是FECR1的下游基因,但FECR1主要是抑制DNMT1的表达,与此同时,作者还发现TET1也能结合FECR1。这些发现表明FECR1参与了基因的表观遗传调控[18]。
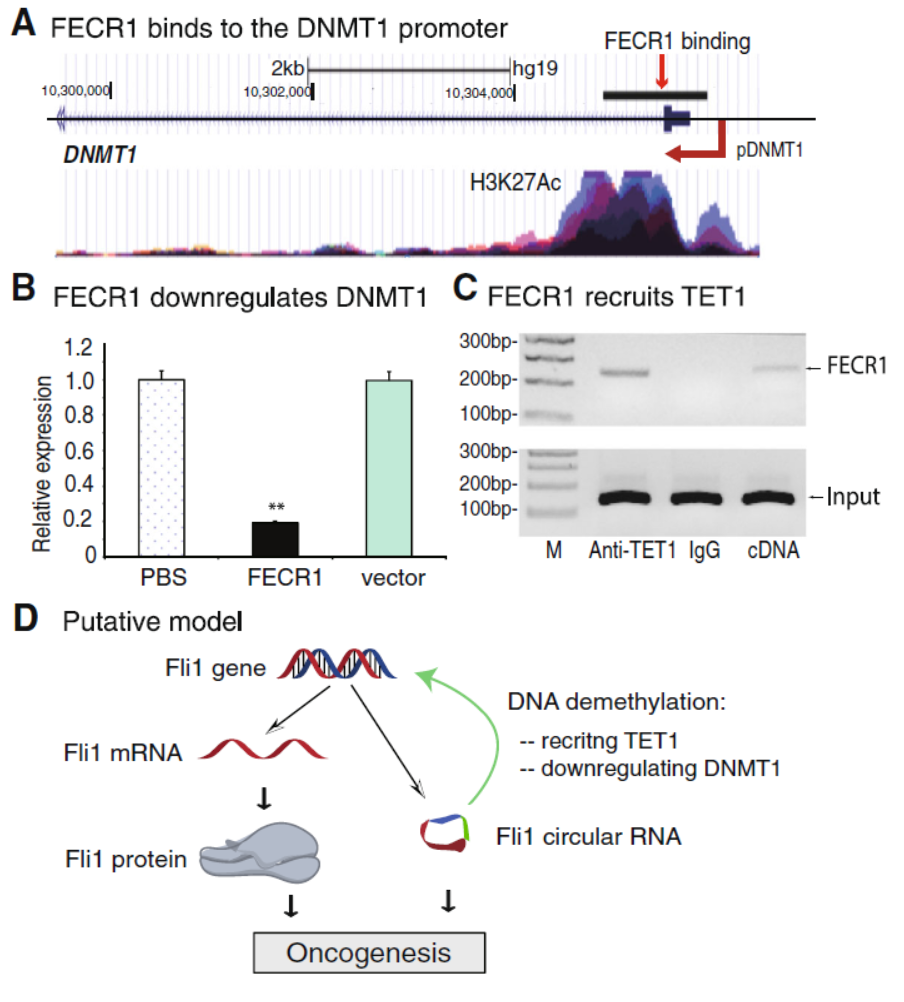
图13 FECR1结合DNMT1启动子,抑制其表达 (来自[18])
融合基因来源CircRNA具有促癌作用
4月8日,Cell Research杂志在线发表了四川大学华西医院Yong Peng为通讯作者的Letter文章,介绍发现来自融合基因EML4-ALK的环形RNA F-circEA有促进细胞增殖迁移的功能,并且在融合基因EML4-ALK为阳性的NSCLC患者血清中能检测到F-circEA,表明F-circEA有可能作为EML4-ALK阳性非小细胞肺癌的诊断标志物[19]。与本文类似的,该团队还发现了来自EML4-ALK融合基因的另一种circRNA分子,F-circEA-2a也具有促癌作用,相关工作发表于Molecular Cancer杂志[20]。

融合基因来源的circRNA是高度疾病特异性的分子产物,是最理想的诊断标志物,因此具有非常高的应用价值。本文正是基于这一发现的启发,探索非小细胞肺癌中常见的融合基因EML4-ALK是否会产生circRNA分子。通过在EML4-ALK阳性的细胞株H2228中进行PCR分析,明确了有circRNA的存在,继而分析干扰或过表达F-circEA后对细胞增殖,迁移,克隆形成等功能的影响。由于融合基因作为诊断标志物的独特优势,作者进一步分析了临床上EML4-ALK阳性的患者血液中是否具有可检测的F-circEA,结果表明F-circEA可特异性的在患者血浆中检测到,但对应的EML4-ALK mRNA仅存在于细胞质中,不会游离出来。
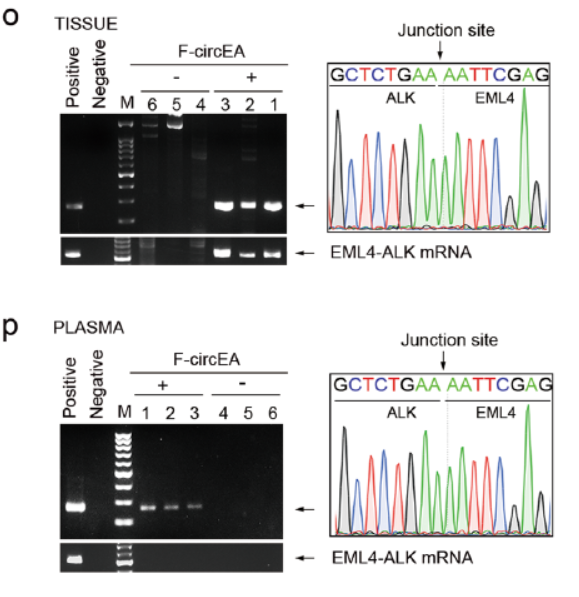
图14 F-circEA可存在血浆中 (来自[19])
3.2 circRNA与心血管疾病
循环系统是除了肿瘤之外circRNA研究最多的方向,2018年心血管相关circRNA的研究报道没有出现爆发式增长,文章数目略有增加,但高分的研究论文偏少。
Circulation Research:
1月12日,Circulation Research杂志在线发表了意大利Humanitas研究医院Gianluigi Condorelli和Leonardo Elia为共同通讯作者的文章,报道Circ_Lrp6通过竞争性结合miR-145在血管平滑肌细胞中发挥功能[21]。

作者基于RNA-seq和生物信息学鉴定发现了血管平滑肌细胞特异性的circRNA分子,其中来源于于脂蛋白受体6(Lrp6)的circRNA分子circ_Lrp6包含了多个miR-145的结合位点,在小鼠和人之间是高度保守。Lrp6在血管中高表达并与血管病变有关。通过RIP,STED超分辨显微镜和竞争性荧光素酶报告基因检测确定了circ_Lrp6与miR-145的相互作用。基于功能损失-恢复的实验设计,作者进一步发现circ_Lrp6阻碍了miR-145介导的VSMC迁移,增殖和分化的调节。 miR-145和circ_Lrp6在鼠和人血管疾病中的差异表达表明,与miR145结合的circ_Lrp6与未结合的比率可能在血管发病机制中起作用。 circ_Lrp6 shRNA的病毒传递阻止了小鼠颈动脉内膜增生[21]。
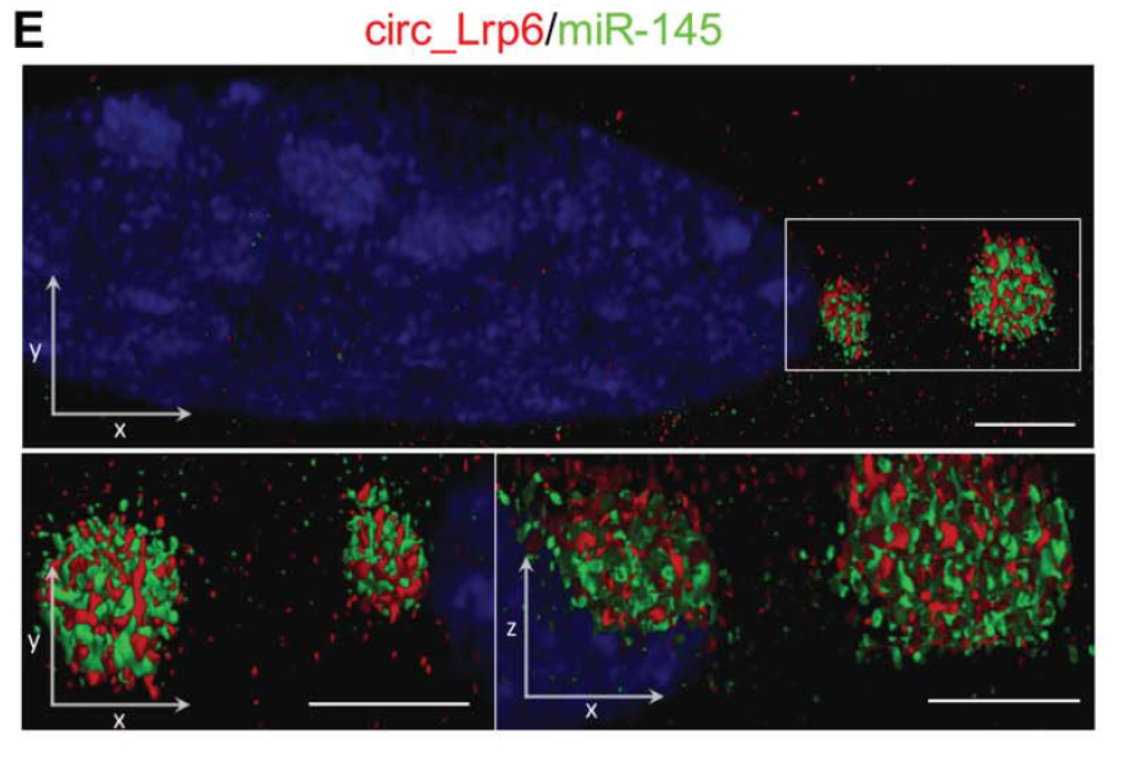
图15 circ_Lrp6与miR-145共定位 (来自[21])
3.3 circRNA与其他人类疾病
circHECTD1参与矽肺的病理机制
1月1日,知名杂志Theranostics(影响因子8.854)在线发表了东南大学医学院巢杰教授为通讯作者的文章,介绍发现circRNA参与二氧化硅诱导的矽肺病理机制[22]。

作者通过构建二氧化硅诱导的矽肺小鼠模型筛选相关的circRNA分子,发现circHECTD1在矽肺模型中出现显著的显著下调,该circRNA分子所对应的基因HECTD1已报道参与与矽肺的发生过程,因此本文重点探索该circRNA分子的作用情况。分别分析了体外二氧化硅处理的细胞模型中circHECTD1的表达情况,circHECTD1与巨噬细胞活化通路的关系,相关分子机制的探索以及病人标本中的检测和验证[22]。
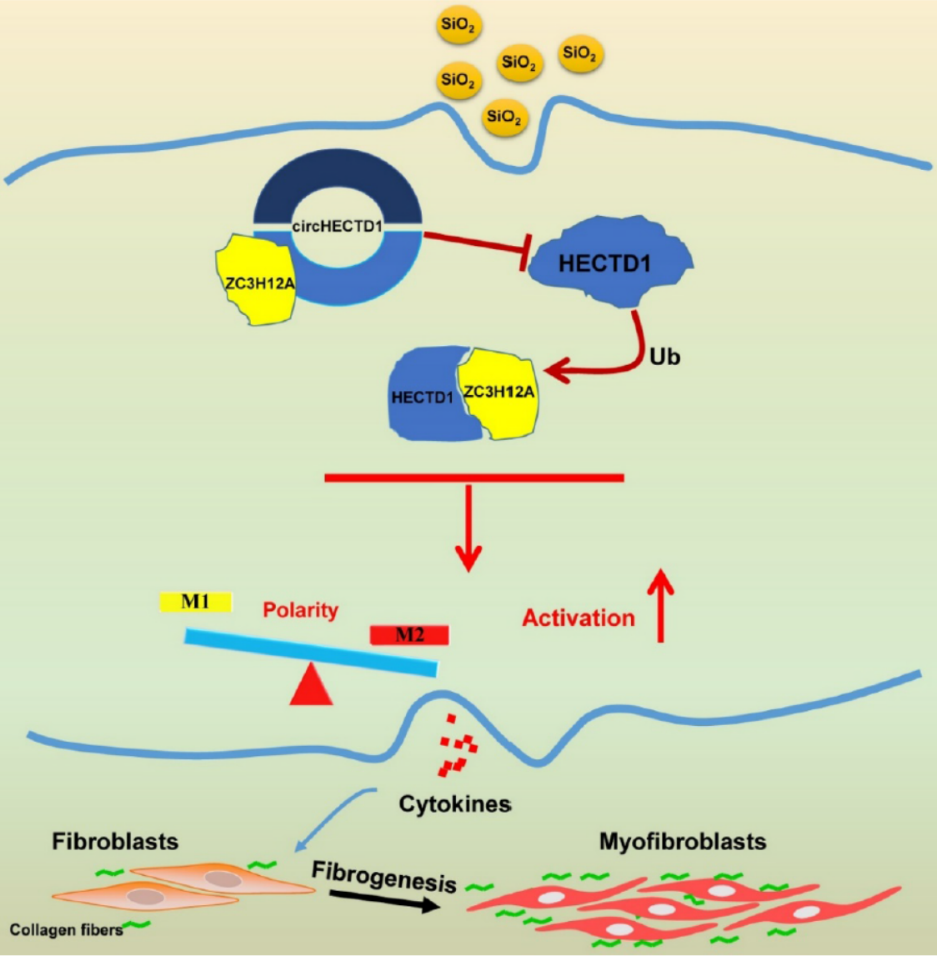
图16 circHECTD1作用模式图 (来自[22])
4. circRNA研究工具与方法进展
4.1 circRNA研究的信息学工具与数据库
《Nucleic Acids Research》发布2018年度数据库专刊
本期共收集了181篇文章,其中84篇为之前曾在数据库专刊中报道过的数据库的更新版,82篇为新收录的,还有15篇为最新上线和公布的数据库。核酸方面的数据库包括用于可视化基因组3D结构和RNA结构的数据的3DIV数据库,RNA家族的分级分类的RNArchitecture数据库。蛋白质数据库包括经典的SMART,ELM和MEROPS,也包括GPCRdb和STCRDab等新面孔。在代谢领域,HMDB和Reactome报道增加了新的功能,PULDB数据库则是首次收录。基因组Resource数据库包括Ensembl,UCSC基因组浏览器和ENCODE。还有其他的药学,蛋白质组学等等不同领域的数据库。
今年的数据库专刊首次收录了两个circRNA相关的数据库:CSCD和exoRBase。CSCD是介绍肿瘤特异性的circRNA表达的数据库。exoRBase是专门收录外泌体中各种RNA分子的数据库,其中包括了circRNA。
CircRNA的计算生物学研究方法汇总分析
1月12日,Cell子刊 Trends in Genetics在线发表了中国科学院北京生命科学研究院的赵方庆教授的综述文章,汇总分析了目前常用的circRNA分析工具[23]。

文中比较了目前常用的测序数据分析方法,测序方案及下游数据分析的工具。

图17 目前11种circRNA鉴定算法精确性比较 (来自[23])
4.2 circRNA研究的分子细胞生物学技术进展
干扰RNA(siRNA)设计成环形可有助于降低脱靶效应
1月21日,Molecular Therapy Nucleic Acids杂志在线发表了北京大学药学院汤新景教授为通讯作者的文章,报道发现将干扰RNA的一条设计为闭合环状的形态将有助于提高特异性和延长作用能力,降低脱靶效应,预示着未来circRNA或许可以直接成为有效的核酸药物[24]。

脱靶效应一直是干扰RNA有效发挥作用的最大问题之一,本文独辟蹊径,尝试直接将siRNA的一条链设计成环状的形式,另一条链仍为线性(circ-siRNA),预实验结果表明这种形式的siRNA不仅可以有效降低靶mRNA,还能实现链特异性的干扰效果。体内实验也表明circ-siRNA的作用时间更持久。
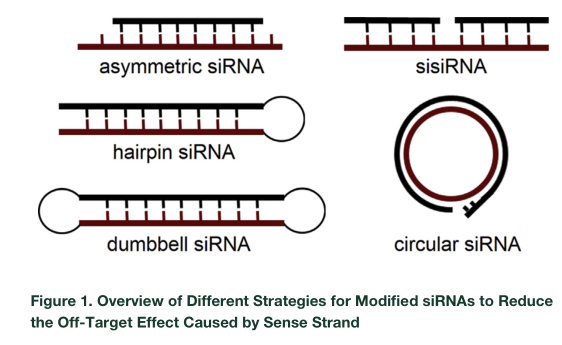
图18 干扰RNA设计成环形可有助于降低脱靶效应(来自[24])
《Methods in Molecular Biology》发表circRNA技术方法专刊
著名的方法学杂志《Methods in Molecular Biology》在2018年专门对circRNA的研究方法做了专刊,包含了17篇方法学的文章,涵盖了circRNA分离,验证,分析与功能研究等各个方面。

基于腺相关病毒载体实现体内circRNA表达和翻译蛋白
8月17日,Cell子刊Molecular Therapy: Nucleic Acid (影响因子5.66)在线发表了美国北卡罗来纳大学教堂山分校Aravind Asokan博士为通讯作者的文章, 介绍他们开发了一种基于腺相关病毒载体(rAAV)的体内表达circRNA并实现翻译蛋白的载体工具[25]。

本文的构思比较简单,也证明了基于AAV的体内过表达circRNA并实现翻译蛋白是完全可行的,这一体系对于circRNA研究提供了重要的工具,未来极有可能在circRNA的研究中获得广泛应用。
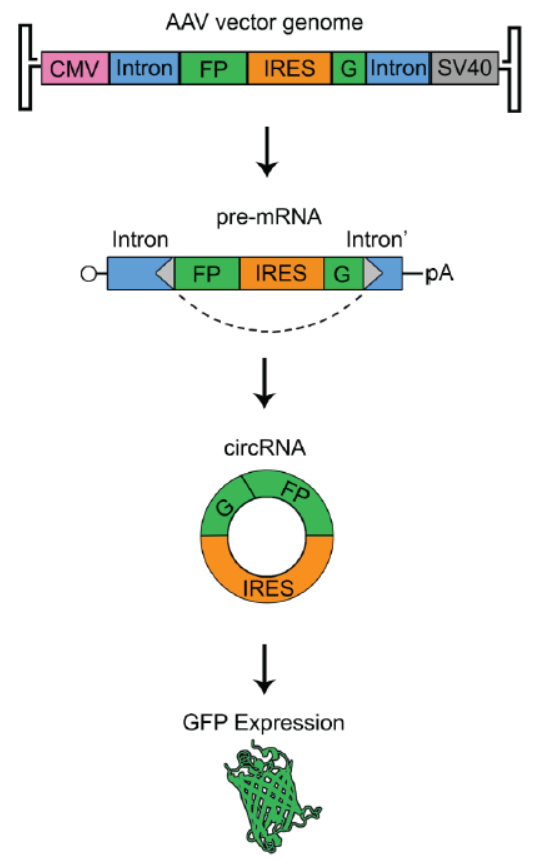
图19 AAV载体框架示意图 (来自[25])
基于NanoString nCounter进行circRNA绝对定量
12月,Nature子刊Laboratory Investigation在线发布了一项circRNA的定量分析技术:基于NanoString nCounter 荧光条形码标记检测技术实现circRNA绝对定量分析的[26]。
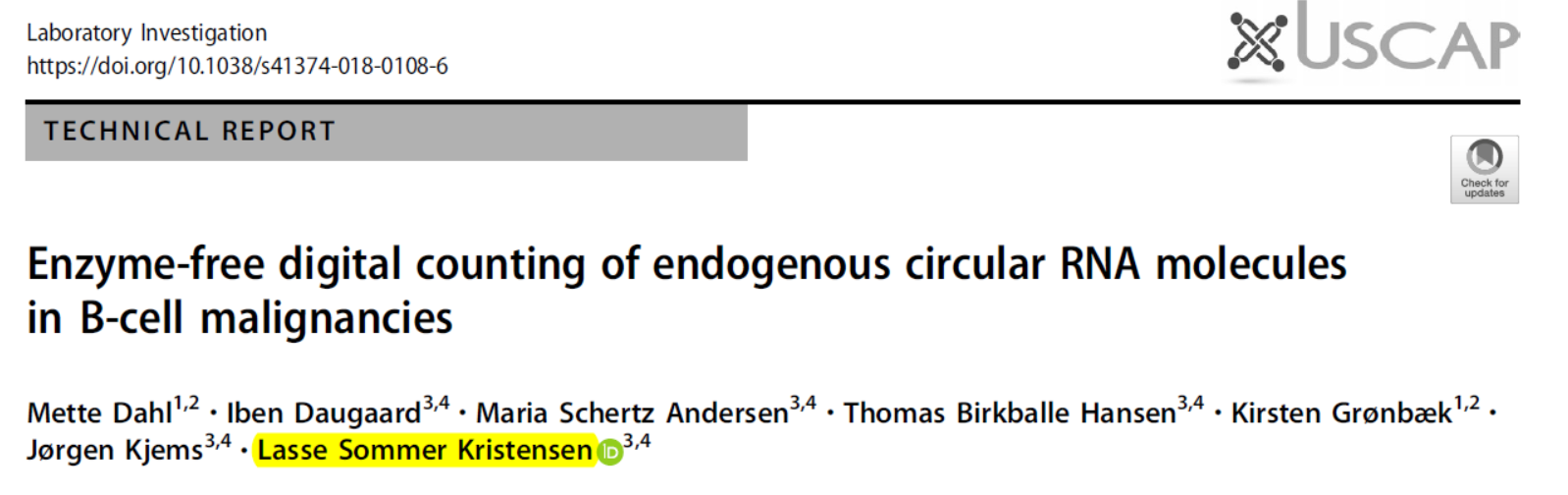
NanoString nCounter 荧光条形码标记检测技术的原理概括起来就是:针对靶分子设计两个探针:捕获探针和报告探针,捕获探针带生物素标记,报告探针带四色荧光基团,可通过不同的排列组合方式实现标记。检测过程中将总RNA与两种探针杂交,纯化,固定后扫描后得到表达量的结果。从测试的结果来看,该技术的定量效果和检测灵敏度要好于传统的芯片法,与Real-Time PCR相似。
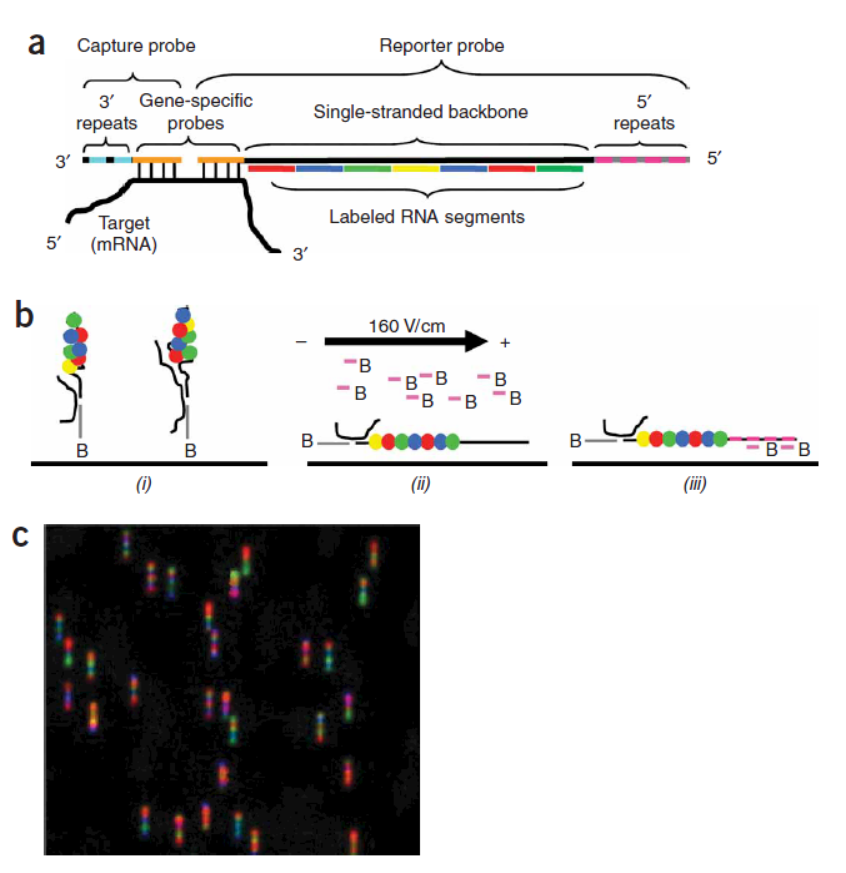
图20 NanoString nCounter技术原理 (来自[27])
体内通过circRNA稳定表达蛋白的载体系统
7月6日,Nature Communications杂志在线发表了麻省医工学院Daniel G. Anderson为通讯作者的文章,介绍开发了一种借助形成circRNA提高体内蛋白表达水平的新方法[28]。

mRNA一般半衰期较短,这限制了其在体内过表达蛋白的效率。本文作者设计了一种基于circRNA的蛋白过表达体系,通过自剪切的内含子序列实现circRNA的自动高效率生成,然后体外自动产生高质量的circRNA分子,输入体内后实现蛋白过表达[28]。
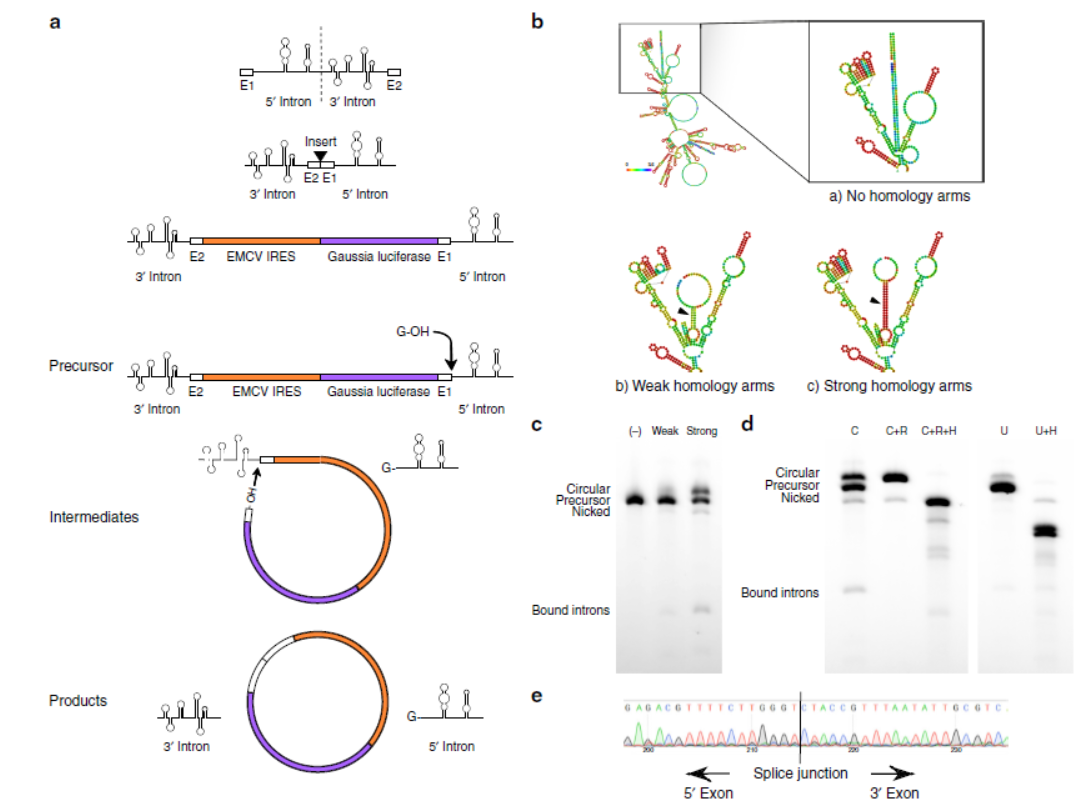
图21 基于circRNA的体内蛋白过表达体系 (来自[28])
5. 非医学相关circRNA研究进展
Nrf2敲除小鼠黑质和纹状体中差异表达的circRNA
10月23日,Cellular Physiology and Biochemistry杂志发表了河北医科大学王磊和孙绍光为通讯作者的文章,介绍在Nrf2基因敲除小鼠中探索黑质和纹状体中circRNA表达变化情况[29]。

小鼠胚胎植入前后子宫内膜CircRNA表达分析
10月28日,Journal of cellular physiology发表了重庆医科大学Yingxiong Wang和Rufei Gao为通讯作者的文章,介绍分析了早期妊娠小鼠的胚胎植入前后子宫内膜circRNA的表达变化情况[30]。

这些动物模型的研究相对简单,类似于14年前后在人类疾病中筛选差异circRNA的工作。除了这两篇文章外,2018年在动物模型,动物学和植物学等非人类疾病相关的基础学科方向也有大量文献报道,具体数目见前面的统计表格。因篇幅有限,不在此处列举所有相关文献的信息。
6. circRNA重要综述
Molecular Cell:重要circRNA综述
8月2日,Molecular Cell杂志在线发表了陈玲玲教授和杨力教授为通讯作者的重要circRNA综述,系统汇总了circRNA生成机制,功能模型等方面的研究进展,也剖析了目前circRNA研究所面临的问题[31]。

有关circRNA的专著
Springer出版集团的Advances in Experimental Medicine and Biology第1087期做了circRNA的专题,详细介绍了circRNA生成,功能机制,与疾病的关系等不同方面的汇总整理。

Cell:lncRNA功能分类与研究技术综述
1月25日,Cell杂志发表了德州大学西南医学中心Joshua T. Mendell教授为通讯作者的综述文章,系统阐述了目前关于lncRNA功能的分类及研究方法。

Molecular Cell:陈玲玲教和杨力教授授发表circRNA重要综述
8月2日,Molecular Cell杂志发表了陈玲玲教授和杨力教授为通讯作者的综述文章,系统汇总了circRNA的生成机制和功能机制的研究进展,并分析了目前circRNA研究依然面临的问题。

Frontiers in Immunology:circRNA在肿瘤免疫中的潜在价值
1月22日,中南大学湘雅医院武明花教授在Frontiers in Immunology杂志发表综述文章,分析了circRNA在肿瘤免疫中潜在的功能和价值。肿瘤免疫治疗是当前研究热门,以有许多研究表明lncRNA、miRNA在抗肿瘤免疫反应中起到重要作用,但circRNA在抗肿瘤免疫反应中的研究还不多,该综述回顾了lncRNA、miRNA和circRNA等非编码RNA分子在抗肿瘤免疫反应中的研究进展,并提示circRNA在抗肿瘤免疫治疗中将起到重要作用,肿瘤免疫治疗领域将是circRNA研究的下一个重要方向。

7. circRNA研究总体趋势与未解决的问题汇总分析
2018年circRNA在国家自然科学基金和发表文章方面都取得了不俗的成绩,但依然有很多问题尚未解决,概括而言,circRNA研究仍面临的问题包括:
(1)circRNA的二级结构与功能的关系是怎样的?
(2)除了m6A,其他修饰类型是否也可存在于circRNA中?这些修饰的生理病理机制是怎样的?
(3)部分circRNA在多物种间存在保守性,这种保守性的原因是什么?
(4) circRNA相互作用分子的鉴定,什么条件影响了circRNA与其他分子的相互作用?存在动态的相互作用方式吗?
(5)circRNA降解的分子机制是什么?
(6)circRNA进入外泌体可能存在选择性,机制和生理病理意义是什么?
(7)circRNA亚细胞定位的机制是怎样的?
(8)组织/疾病特异性circRNA表达特征是如何形成的?会有多少种机制调控circRNA的形成?
(9) circRNA的敲除模型依然遥不可及,circRNA的组织/细胞条件性表达动物模型是否可行?
(10)人群基因组中经常出现SNP多态性或高度相关的基因区,这些位点或区域与circRNA的关系是怎样的?是否通过circRNA相关的机制发挥作用?
参考文献:
1. Huang, C., et al., A length-dependent evolutionarily conserved pathway controls nuclear export of circular RNAs. Genes Dev, 2018. 32(9-10): p. 639-644.
2. Li, Z., M.G. Kearse, and C. Huang, The nuclear export of circular RNAs is primarily defined by their length. RNA Biol, 2018.
3. Wan, Y. and A.K. Hopper, Size matters: conserved proteins function in length-dependent nuclear export of circular RNAs. Genes Dev, 2018. 32(9-10): p. 600-601.
4. Azmi, A.S., Nuclear export mechanisms of circular RNAs: size does matter. Noncoding RNA Investig, 2018. 2.
5. Chuang, T.J., et al., Integrative transcriptome sequencing reveals extensive alternative trans-splicing and cis-backsplicing in human cells. Nucleic Acids Res, 2018. 46(7): p. 3671-3691.
6. Talhouarne, G.J.S. and J.G. Gall, Lariat intronic RNAs in the cytoplasm of vertebrate cells. Proc Natl Acad Sci U S A, 2018. 115(34): p. E7970-E7977.
7. Toptan, T., et al., Circular DNA tumor viruses make circular RNAs. Proc Natl Acad Sci U S A, 2018. 115(37): p. E8737-E8745.
8. Kleaveland, B., et al., A Network of Noncoding Regulatory RNAs Acts in the Mammalian Brain. Cell, 2018. 174(2): p. 350-362 e17.
9. Xia, P., et al., A Circular RNA Protects Dormant Hematopoietic Stem Cells from DNA Sensor cGAS-Mediated Exhaustion. Immunity, 2018. 48(4): p. 688-701 e7.
10. Nicolet, B.P., et al., Circular RNA expression in human hematopoietic cells is widespread and cell-type specific. Nucleic Acids Res, 2018. 46(16): p. 8168-8180.
11. Chen, B.J., S. Huang, and M. Janitz, Changes in circular RNA expression patterns during human foetal brain development. Genomics, 2018.
12. Aufiero, S., et al., Cardiac circRNAs arise mainly from constitutive exons rather than alternatively spliced exons. RNA, 2018. 24(6): p. 815-827.
13. Kaur, S., A.H. Mirza, and F. Pociot, Cell Type-Selective Expression of Circular RNAs in Human Pancreatic Islets. Noncoding RNA, 2018. 4(4).
14. Zaghlool, A., et al., Expression profiling and in situ screening of circular RNAs in human tissues. Sci Rep, 2018. 8(1): p. 16953.
15. Zhang, M., et al., A peptide encoded by circular form of LINC-PINT suppresses oncogenic transcriptional elongation in glioblastoma. Nat Commun, 2018. 9(1): p. 4475.
16. Du, W.W., et al., A circular RNA circ-DNMT1 enhances breast cancer progression by activating autophagy. Oncogene, 2018. 37(44): p. 5829-5842.
17. Fang, L., et al., Enhanced breast cancer progression by mutant p53 is inhibited by the circular RNA circ-Ccnb1. Cell Death Differ, 2018. 25(12): p. 2195-2208.
18. Chen, N., et al., A novel FLI1 exonic circular RNA promotes metastasis in breast cancer by coordinately regulating TET1 and DNMT1. Genome Biol, 2018. 19(1): p. 218.
19. Tan, S., et al., Circular RNA F-circEA produced from EML4-ALK fusion gene as a novel liquid biopsy biomarker for non-small cell lung cancer. Cell Res, 2018. 28(6): p. 693-695.
20. Tan, S., et al., Circular RNA F-circEA-2a derived from EML4-ALK fusion gene promotes cell migration and invasion in non-small cell lung cancer. Mol Cancer, 2018. 17(1): p. 138.
21. Hall, I.F., et al., Circ_Lrp6, a Circular RNA Enriched in Vascular Smooth Muscle Cells, Acts as a Sponge Regulating miRNA-145 Function. Circ Res, 2018.
22. Zhou, Z., et al., circRNA Mediates Silica-Induced Macrophage Activation Via HECTD1/ZC3H12A-Dependent Ubiquitination. Theranostics, 2018. 8(2): p. 575-592.
23. Gao, Y. and F. Zhao, Computational Strategies for Exploring Circular RNAs. Trends Genet, 2018. 34(5): p. 389-400.
24. Zhang, L., et al., Circular siRNAs for Reducing Off-Target Effects and Enhancing Long-Term Gene Silencing in Cells and Mice. Mol Ther Nucleic Acids, 2018. 10: p. 237-244.
25. Meganck, R.M., et al., Tissue-Dependent Expression and Translation of Circular RNAs with Recombinant AAV Vectors In Vivo. Mol Ther Nucleic Acids, 2018. 13: p. 89-98.
26. Dahl, M., et al., Enzyme-free digital counting of endogenous circular RNA molecules in B-cell malignancies. Lab Invest, 2018. 98(12): p. 1657-1669.
27. Geiss, G.K., et al., Direct multiplexed measurement of gene expression with color-coded probe pairs. Nat Biotechnol, 2008. 26(3): p. 317-25.
28. Wesselhoeft, R.A., P.S. Kowalski, and D.G. Anderson, Engineering circular RNA for potent and stable translation in eukaryotic cells. Nat Commun, 2018. 9(1): p. 2629.
29. Yang, J.H., et al., The Differentially Expressed Circular RNAs in the Substantia Nigra and Corpus Striatum of Nrf2-Knockout Mice. Cell Physiol Biochem, 2018. 50(3): p. 936-951.
30. Zhang, S., et al., Altered expression patterns of circular RNAs between implantation sites and interimplantation sites in early pregnant mice. J Cell Physiol, 2018.
31. Li, X., L. Yang, and L.L. Chen, The Biogenesis, Functions, and Challenges of Circular RNAs. Mol Cell, 2018. 71(3): p. 428-442.
.png)