2024年2月,Molecular Cancer(IF=37.3)刊登了一篇有关circRNA调控三阴性乳腺癌的文章——ZNF460-mediated circRPPH1 promotes TNBC progression through ITGA5-induced FAK/PI3K/AKT activation in a ceRNA manner,该文章发现环状RNA分子circRPPH1可能作为miR-326分子海绵,调控整合素α5亚基(ITGA5)的表达,激活局部粘着斑激酶(FAK)/PI3K/AKT通路,从而促进三阴性乳腺癌的发展,为三阴性乳腺癌的治疗和诊断提供了新的靶点。文章由南京医科大第一附属医院普外科肇毅主任医师团队发表。

研究思路
结果
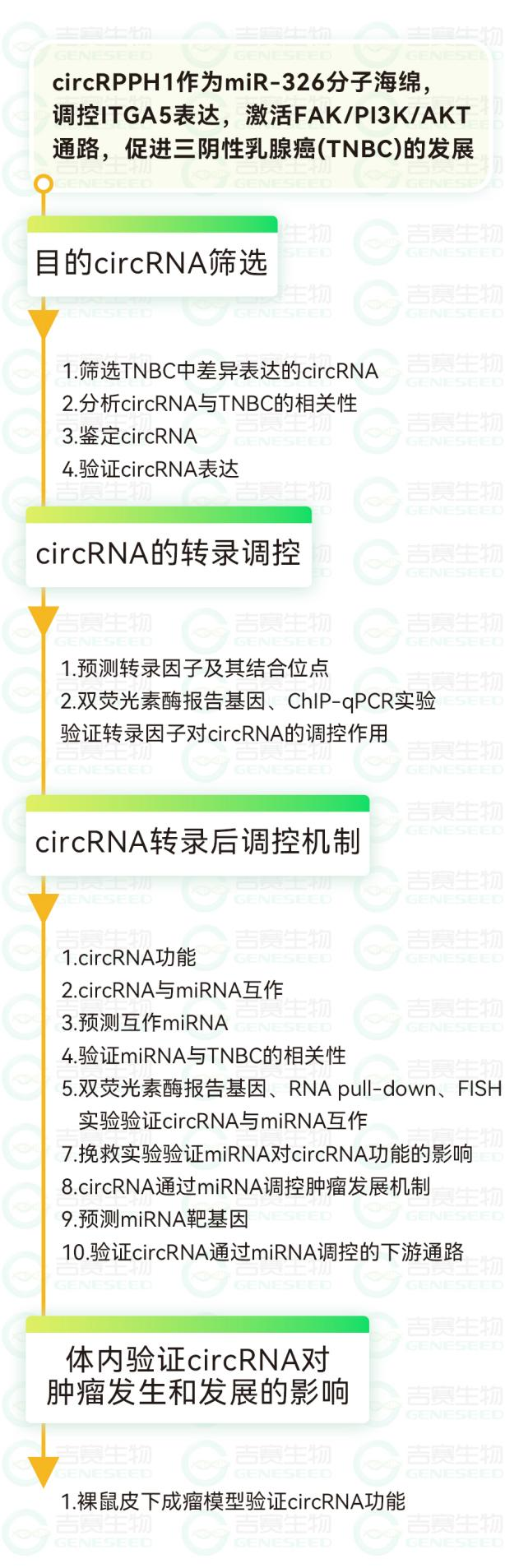
circRPPH1的鉴定及临床特征
作者从GSE101123数据集中的TNBC组织和正常乳腺组织的RNA测序数据,筛选出与TNBC相关的hsa_circRNA_000166(circRPPH1),并通过Sanger测序,聚合和发散引物分别扩增证实了circRPPH1的环状结构;并通过RNase R分析验证circRPPH1是一种比线性RNA更稳定的环状RNA。细胞核质分离和FISH检测结果显示circRPPH1主要存在于细胞质中,且相对正常乳腺组织,在TNBC组织中表达上调。作者还通过ROC曲线、Kaplan-Meier生存曲线、Cox回归模型分析,发现高表达的circRPPH1是TNBC患者的总生存预测因子。这些结果表明,circRPPH1可以用于诊断和预后。(图 1)
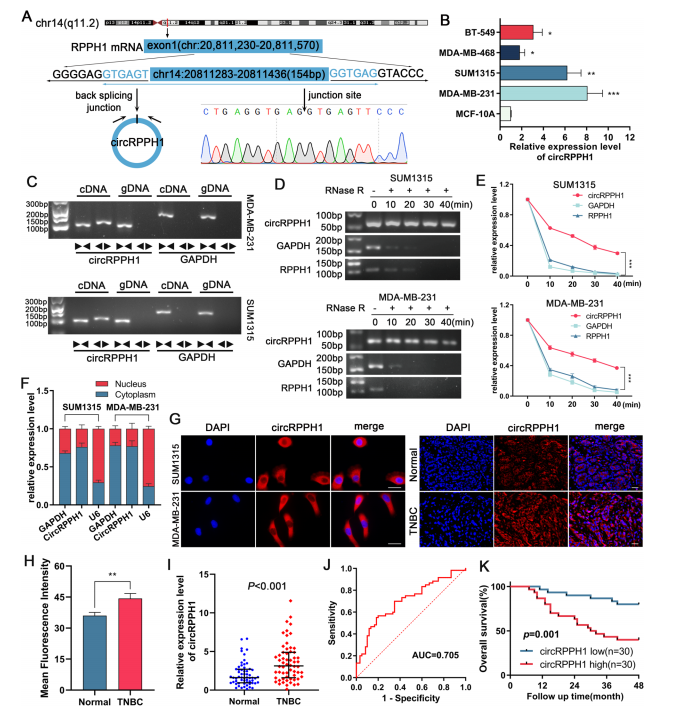
图1. circRPPH1在TNBC中的鉴定与表达
ZNF460增加了RPPH1和circRPPH1的表达
作者在JASPAR数据库中预测到转录因子ZNF460与RPPH1启动子的结合。敲低或过表达ZNF460使circRPPH1表达水平改变(图2C和D)。作者通过双荧光素酶报告基因实验和ChIP-qPCR验证了ZNF460对RPPH1有调控作用(图2)。这些结果表明,ZNF460可能与RPPH1启动子互作,从而调控RPPH1和circRPPH1的表达。
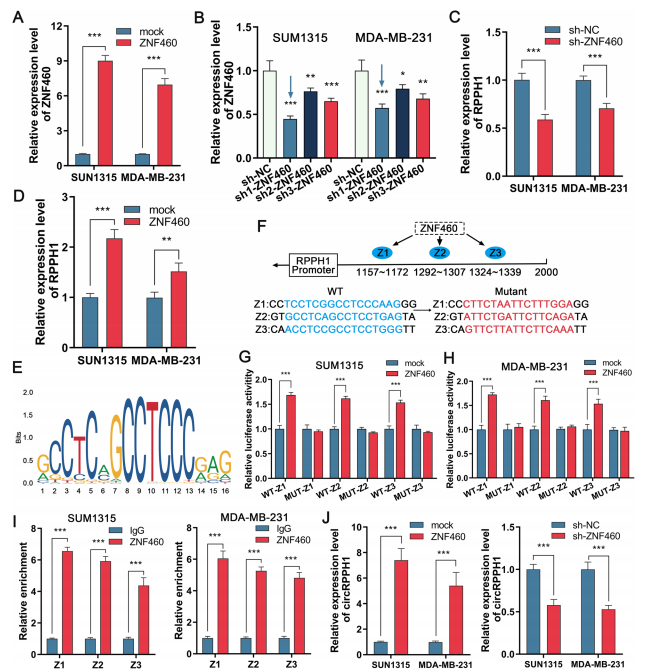
图2. ZNF460增加TNBC细胞中circRPPH1的表达。
CircRPPH1促进TNBC细胞生长、迁移和侵袭
作者通过克隆形成、EdU、CCK-8、Transwell和划痕实验实验验证了干扰circRPPH1能抑制TNBC细胞增殖、迁移和侵袭能力,而过表达circRPPH1能促进细胞增殖、迁移和侵袭能力。上述结果表明,circRPPH1在TNBC细胞中发挥了促癌作用。(图3)
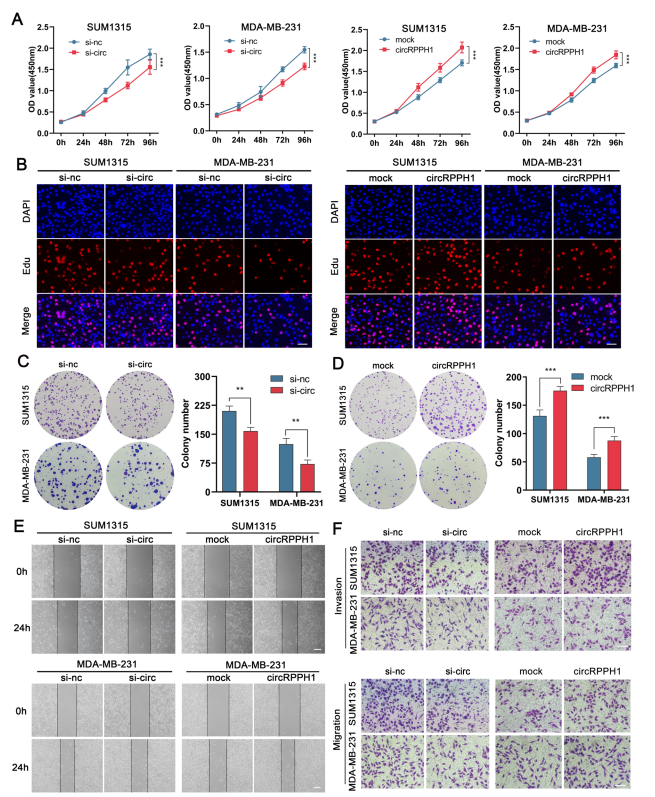
图3. circRPPH1促进TNBC细胞增殖、迁移和侵袭。
CircRPPH1促进TNBC细胞EMT,调节细胞周期,抑制细胞凋亡
作者通过敲低circRPPH1发现,TNBC细胞中E-cadherin表达增加,而N-cadherin和vimentin表达减少。Western blot实验结果与IF实验结果一致;通过流式细胞术检测发现,干扰circRPPH1后,处于G1期的TNBC细胞比例增加,处于S期的比例减少,周期相关蛋白减少,细胞的早期凋亡率提高。这表明沉默circRPPH1后细胞周期被阻断。作者敲低circRPPH1后发现,Bcl-2表达降低,而cleaved caspase-3和Bax表达上调。上述实验在过表达circRPPH1后呈现相反的结果。此外,免疫荧光实验显示,干扰circRPPH1后caspase-3的表达上调。综上所述,circRPPH1在TNBC细胞中具有促进EMT、加速细胞周期、抑制细胞凋亡的生物学功能。(图4)
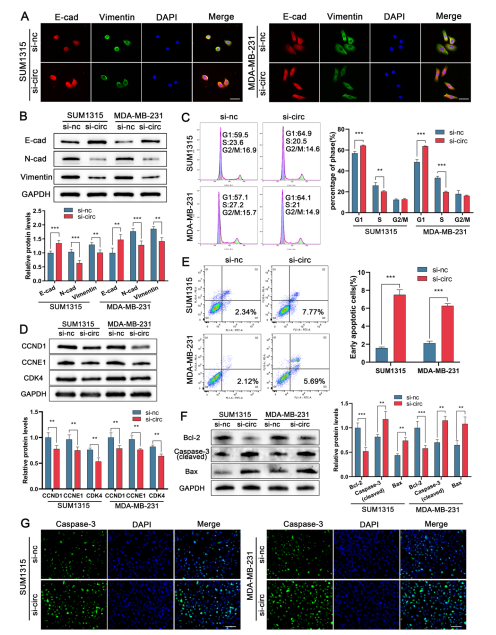
图4. 敲低circRPPH1抑制TNBC细胞EMT,调控细胞周期和凋亡。
CircRPPH1通过直接结合miR-326起到分子海绵的作用
作者通过ENCORI和CircInteractome数据库预测到hsa-miR-326与circRPPH1存在相互作用,且在TNBC中表达下调,低表达者预后较好。在TNBC细胞和组织中检测到miR-326的下调,与数据库结果一致。根据Kaplan-Meier生存分析和Pearson相关分析, miR-326表达较高的患者总生存时间更长,且circRPPH1的表达水平与hsa-miR-326呈负相关。作者干扰或过表达circRPPH1后发现,过表达circRPPH1会下调miR-326的表达,而干扰circRPPH1则会有相反的效果。通过双荧光素酶报告基因和RNA pull-down实验,验证了circRPPH1与miR-326的互作。综上所述,circRPPH1可能直接与miR-326结合,起到分子海绵的作用。(图5)
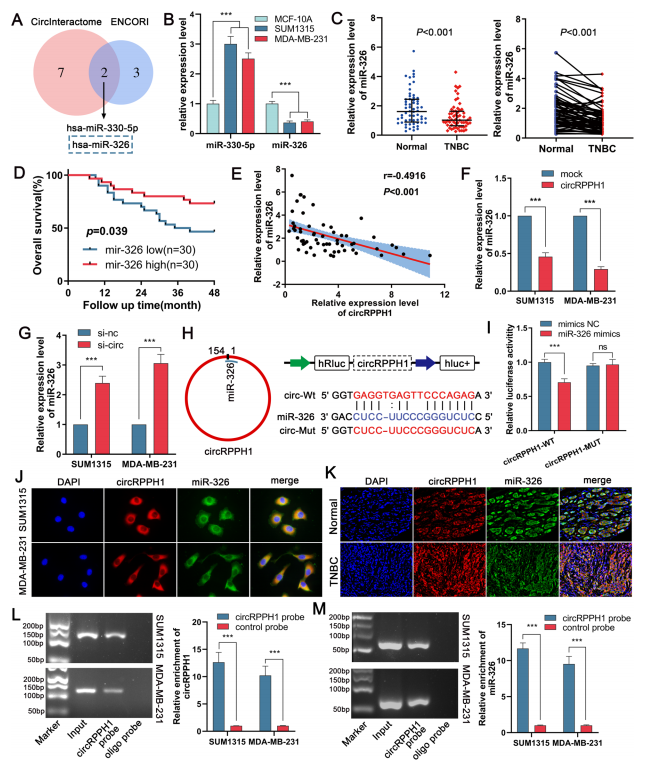
图5. circRPPH1结合miR-326并作为其分子海绵。
MiR-326能部分逆转circRPPH1的促肿瘤作用
作者使用miR-326 mimics或抑制剂结合si-circ或过表达circRPPH1进行了挽救实验。克隆形成、EdU、CCK-8、Transwell和划痕实验结果表明,miR-326 mimics阻断了circRPPH1过表达对TNBC细胞生长、侵袭和迁移的影响,而miR-326抑制剂恢复了circRPPH1的功能。上述研究表明,miR-326可以抵消circRPPH1的促癌活性。(图6)
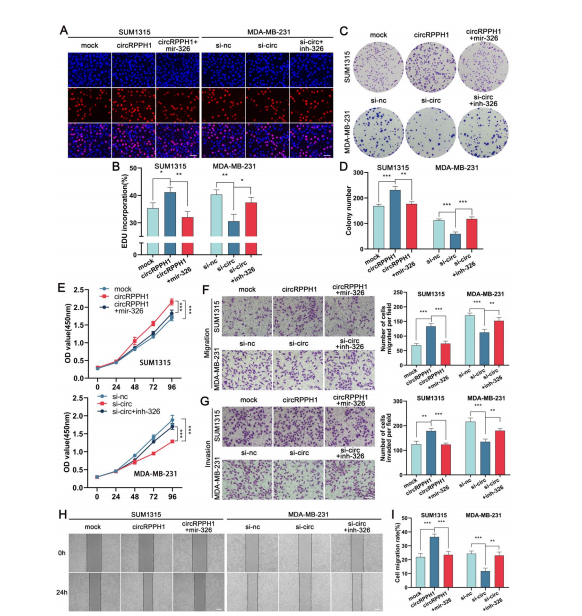
图6. miR-326部分逆转circRPPH1对TNBC细胞增殖、侵袭和迁移的促进作用。
CircRPPH1通过miR-326/ITGA5轴激活FAK/PI3K/AKT通路
作者利用数据库预测到ITGA5可能是miR-326的下游基因。Western blot和qRT-PCR表明,SUM1315细胞和MDA-MB-231细胞转染miR-326 mimics后,ITGA5的表达下调;而转染miR-326抑制剂后结果相反。双荧光素酶报告基因实验结果显示,转染miR-326 mimics对ITGA5表达有调控作用。随后证实ITGA5在TNBC组织中上调,circRPPH1与ITGA5表达呈正相关,而miR-326与ITGA5表达水平呈负相关。通过检测发现ITGA5的表达受circRPPH1的干扰或过表达影响。KEGG通路分析显示,ITGA5是PI3K/AKT通路的相关基因。在TNBC细胞系中,过表达circRPPH1显著上调了ITGA5、p-FAK、p-PI3K和p-AKT的表达,而敲低circRPPH1则具有相反的效果;miR-326模拟物或抑制剂可能会抵消这些作用。这些结果表明,circRPPH1激活miR-326/ITGA5轴介导的FAK/ PI3K/AKT通路可促进TNBC细胞的侵袭性。(图7)
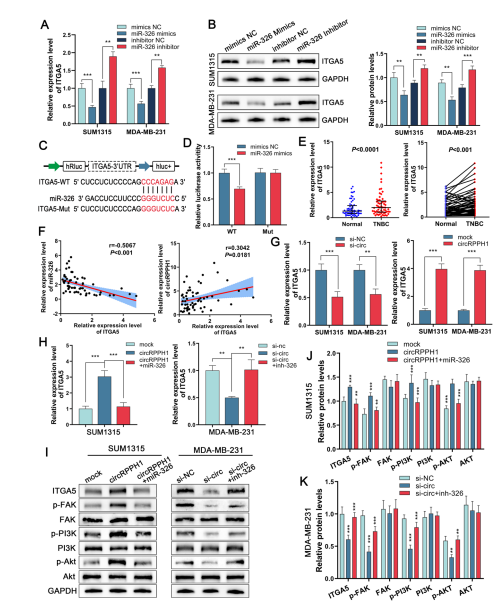
图7. ITGA5是miR-326的直接靶点。circRPPH1可以作为miR-326的分子海绵调节ITGA5的表达,激活FAK/PI3K/Akt通路。
CircRPPH1促进TNBC细胞在体内的生长和转移
作者把构建的TNBC细胞系circRPPH1过表达或敲低稳株注射到裸鼠皮下,结果表明,敲低circRPPH1后,所有裸鼠的肿瘤形成时间延长。接种过表达circRPPH1的细胞系,成瘤率提高。与对照组相比,circRPPH1敲低组的肿瘤大小和重量显著减小,而过表达circRPPH1后结果相反。免疫组化结果表明circRPPH1敲低组的异种移植肿瘤组织中Ki-67和ITGA5水平均显著降低,但在circRPPH1过表达组中Ki-67和ITGA5水平显著上调。通过活体成像和HE染色,结果显示肺转移灶的数量和大小均为在circRPPH1敲除后显著降低,而circRPPH1过表达的影响则相反。Western blotting检测肿瘤组织显示,circRPPH1过表达组ITGA5的表达水平远高于对照组,而敲低circRPPH1组ITGA5的表达结果相反。以上结果表明,circRPPH1在体内诱导ITGA5促进TNBC细胞生长和转移。(图8)
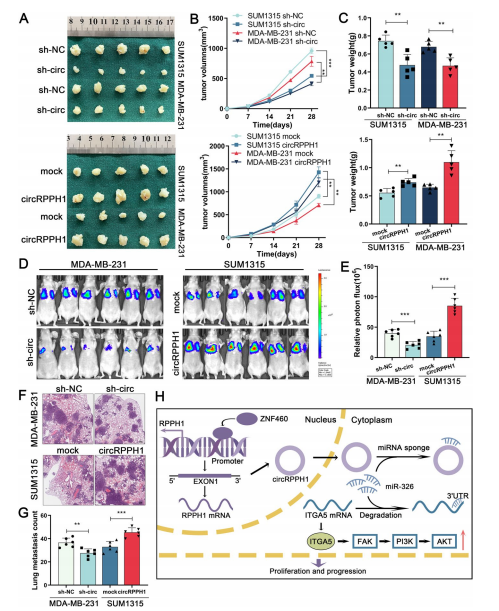
图8. circRPPH1在体内促进TNBC的发生和进展。 图8. circRPPH1在体内促进TNBC的发生和进展。
小结
该研究结合临床数据、体外及体内实验研究了受ZNF460调控的circRPPH1作为miR-326分子海绵,调控整合素α5亚基(ITGA5)的表达,介导FAK/PI3K/AKT通路,从而促进三阴性乳腺癌的发生和发展。该文章阐述了完整的ceRNA机制,为TNBC提供潜在的有效治疗靶点,又再验证了circRNA与癌症的重要关系。看完文献,是否对小伙伴们有什么启发呢?欢迎来找小吉探讨。再一次小声暗(ming)示——该研究中circRNA过表达载体 pCD5-ciR由吉赛生物提供。
然而,过表达不仅限于常见的过表达载体,还可以用体外制备的circRNA达到过表达效果。部分感兴趣的circRNA体内表达量不理想,或难以通过载体实现过表达,而利用体外制备的circRNA进行研究可解决此等难题,打开新思路,且能使人眼前一亮!吉赛生物拥有原创的环化专利技术,可实现RNA高效体外环化,制备的circRNA完整性好、纯度高、翻译表达能力强,可用于细胞转染、动物实验、药效评估等多领域。
此外,研究中涉及的circRNA表达鉴定、载体构建、分子互作、原位杂交、细胞功能验证等大部分技术,吉赛生物都有相关的产品和技术服务哈~~
.png)