肝内胆管癌(ICC)是第二大常见的原发性肝癌,其发病率和死亡率持续上升。多项研究表明,异常表达的环状RNA可能是许多癌症的潜在诊断和治疗靶点,包括ICC。ERK通路包括RAS、RAF、MEK和ERK,它们在近40%的癌症中发生了改变。然而,ERK通路与环状RNA之间的关系尚不清楚,有待进一步研究。丝氨酸-苏氨酸激酶受体相关蛋白(STRAP)是WD-40重复蛋白家族的一个成员,在人类癌症中调控许多通路,包含MEK/ERK通路。由于目前还没有关于STRAP在ICC中的功能的研究,因此探索其在ICC形成的起始过程中的作用至关重要。
2024年2月17日,江苏省人民医院、南京医科大学第一附属医院肝胆中心李相成教授、李长贤副主任医师团队研究发现在Molecular Cancer(IF=37.3)发表文章CircPCNXL2 promotes tumor growth and metastasis by interacting with STRAP to regulate ERK signaling in intrahepatic cholangiocarcinoma。本研究表明circPCNXL2通过与STRAP相互作用激活ERK信号通路,以及调节miR-766-3p/SRSF1轴,在ICC进程中发挥关键作用。这些发现表明,circPCNXL2可能是ICC的一个潜在的生物标志物和治疗靶点。

circPCNXL2鉴定和circPCNXL2在ICC中表达上调
为了评估环状RNA在ICC中的作用,作者分析了来自ICC和邻近组织的RNA-seq数据。结果显示,has_circ_0016956(circPCNXL2)是上调最多的环状RNA之一,通过qRT-PCR也证实其在ICC组织中过表达(图1a-c)。根据circPCNXL2的中位表达量,将76例ICC患者分为低circPCNXL2组和高circPCNXL2组。观察到circPCNXL2的高表达与TNM晚期相关,且高circPCNXL2组的患者总生存率(OS)较差(图1d)。总之,circPCNXL2在ICC的发展和转移中具有潜在的作用。
circPCNXL2在4个ICC细胞系中的表达也较高,所以作者选择了HuCCT1和RBE细胞进行后续研究(图1e)。然后通过Sanger测序和PCR分析验证了circNIPBL的反向剪接结构(图1f)。然后运用背靠背引物经琼脂糖凝胶电泳,结合RNase R耐受性检测实验,表明circPCNXL2的环状结构相对更稳定(图1h-i)。通过FISH和细胞质和核RNA纯化分析,circPCNXL2主要位于细胞质中(图1j-l)。综上所述,circPCNXL2在ICC组织中过表达,主要位于ICC细胞的细胞质中。
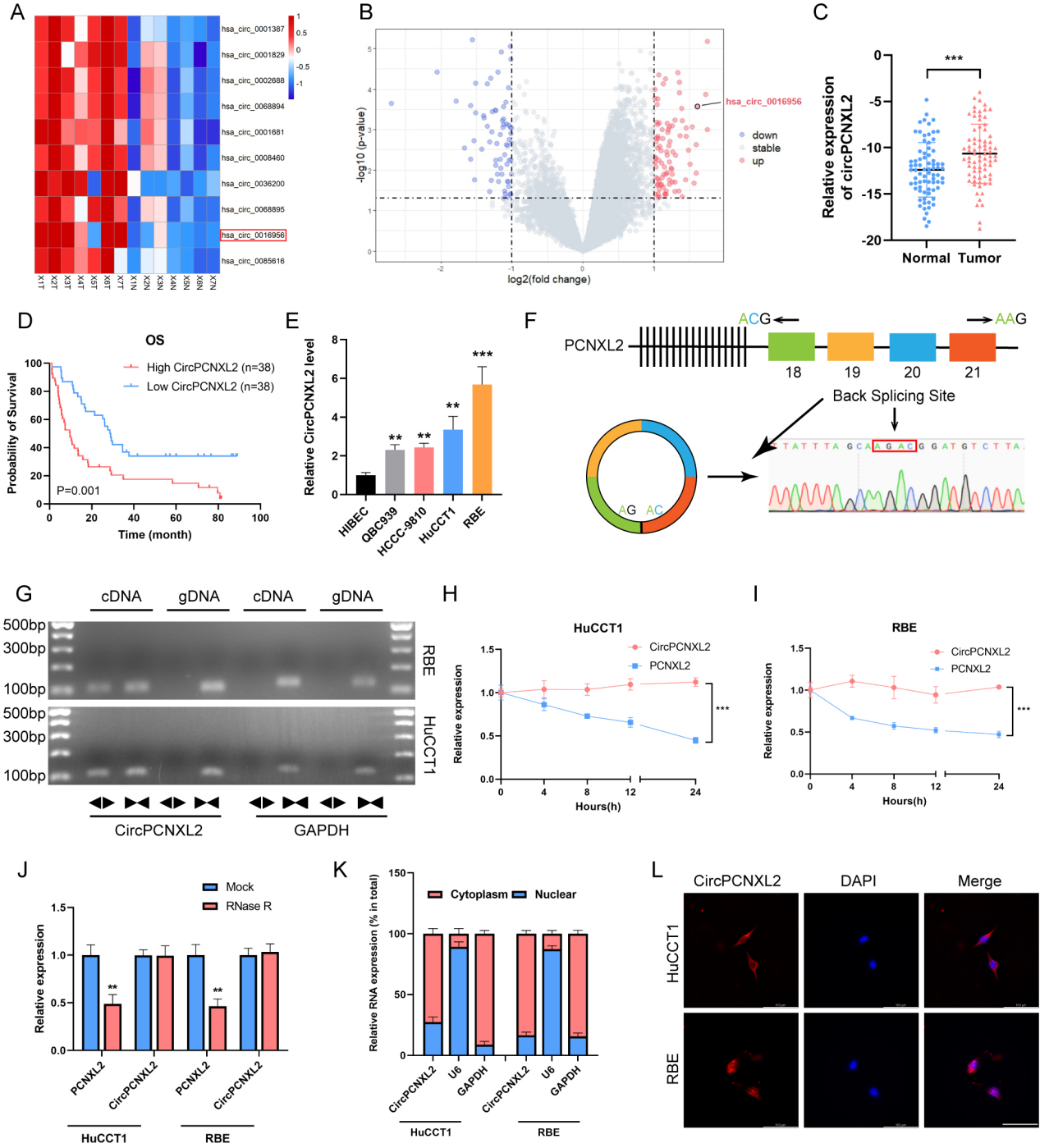
图1 circPCNXL2鉴定和circPCNXL2在ICC中表达上调
CircPCNXL2促进体外ICC的增殖和迁移
为了阐明circPCNXL2在ICC中的生物学功能,作者利用靶向剪接的siRNA敲低circPCNXL2的表达,并构建circPCNXL2过表达质粒(图2a-b)。然后,通过CCK-8法、EdU法和克隆形成法检测circPCNXL2对细胞增殖的影响。结果表明,下调circPCNXL2可抑制HuCCT1和RBE细胞的增殖,circPCNXL2过表达组与之相反(图2c-f)。同样,transwell实验和伤口愈合实验表明,敲低circPCNXL2阻碍了迁移能力,过表达circPCNXL2促进了迁移能力(图2g-j)。综上所述,circPCNXL2在ICC细胞中具有致癌作用。
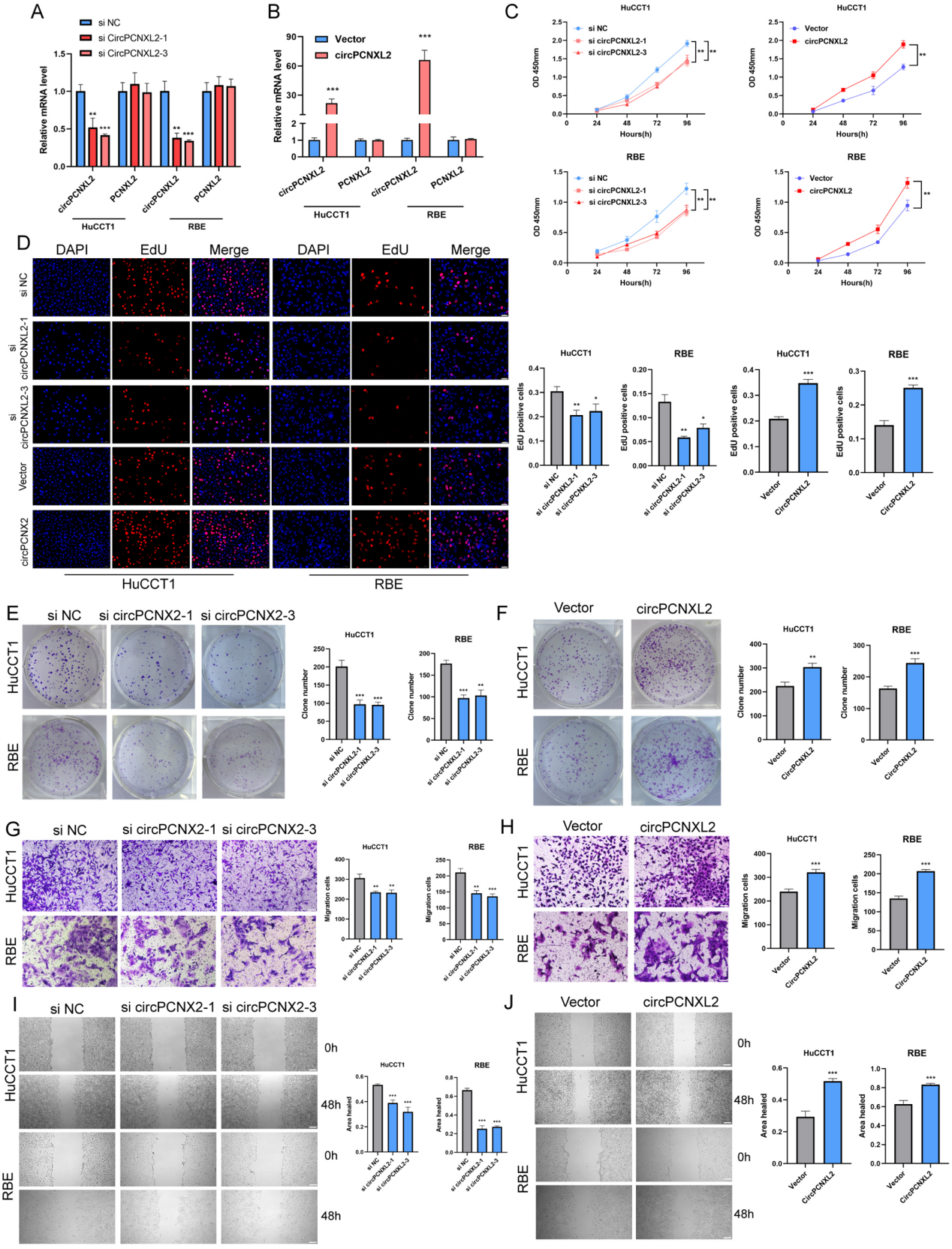
图2 CircPCNXL2促进体外ICC的增殖和迁移
CircPCNXL2在体内促进ICC的肿瘤生长和转移
为了评估circPCNXL2在体内对ICC的影响,作者构建了异种移植模型,与对照组相比circPCNXL2敲低的肿瘤的体积更小,而过表达circPCNXL2组肿瘤生长速度快于对照组(图3a-f)。免疫组化(IHC)染色显示,circPCNXL2基因敲低组的Ki-67水平较弱。相反,circPCNXL2的过表达导致Ki-67染色更强,表明Ki-67与circPCNXL2的表达水平之间存在相关性(图3g-h)。综上所述,circPCNXL2在体内促进了ICC的增殖。
然后,为了检测circPCNXL2在ICC体内的转移特征,作者构建了肝转移模型。结果表明,注射了circPCNXL2敲低的HuCCT1细胞的小鼠肝脏中转移性结节的数量显著减少。并且,circPCNXL2过表达增强了肝脏的扩散能力(图3i-k)。综上所述,circPCNXL2促进了ICC细胞在体内的转移。
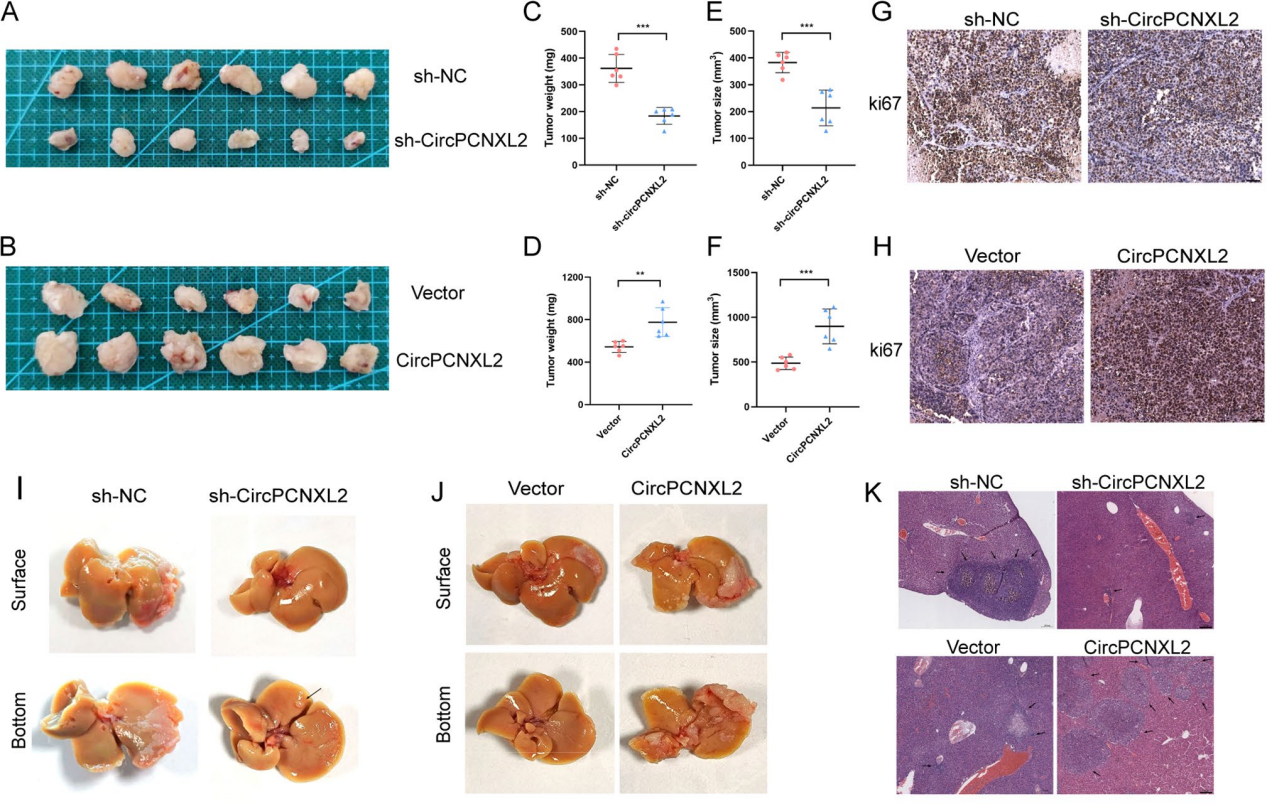
图3 CircPCNXL2在体内促进ICC的肿瘤生长和转移
CircPCNXL2在ICC中调节ERK/MAPK信号通路的激活
为了分析circPCNXL2促进ICC细胞增殖和转移的潜在机制,作者通过RNA-seq在过表达circPCNXL2的RBE细胞中鉴定了278个差异表达基因(图4a)。KEGG通路分析和GO富集分析表明显示,MAPK信号通路最为丰富,且circPCNXL2可能在ICC进展中调控MAPK通路的ERK1和ERK2级联(图4b)。作者由此推测circPCNXL2可能通过MAPK通路促进ICC的生长和转移。通过WB结果证实了这一点,且ERK磷酸化的变化在三个亚群中最为显著,与GO富集的结果一致。因此,作者假设circPCNXL2主要通过ERK/MAPK信号通路促进ICC的肿瘤发生。
为了了解ERK/MAPK通路在circPCNXL2介导的ICC进展中的意义,作者通过ERK抑制剂SCH772984来阻断ERK的磷酸化(图4d-e)。在功能上,EdU试验、CCK8试验、克隆形成试验、transwell试验和伤口愈合试验表明,过表达circPCNXL2可促进增殖和迁移,而SCH772984可以逆转这些现象(图4f-j)。综上所述,circPCNXL2通过激活ERK/MAPK信号通路促进了ICC的生长和迁移。
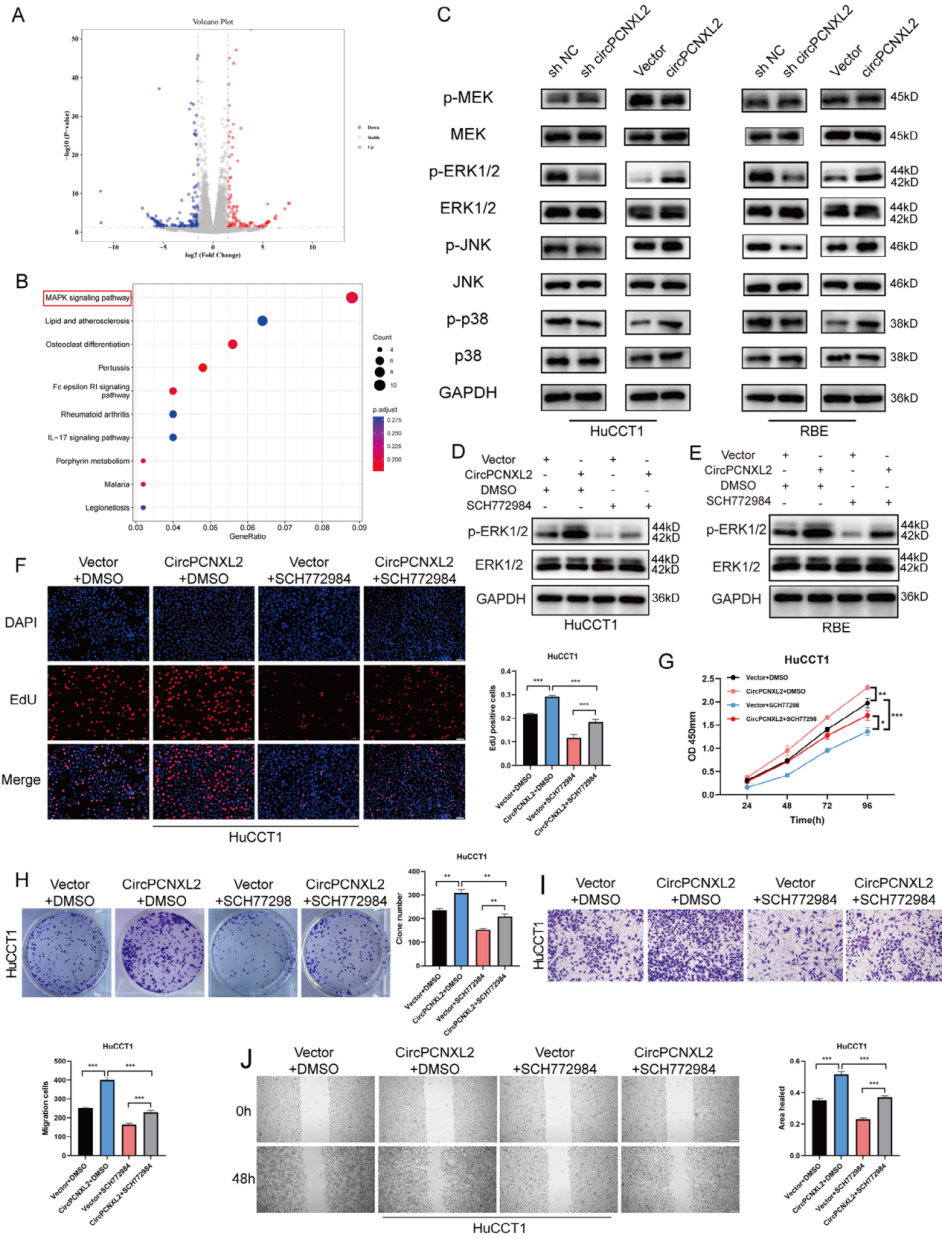 图4 CircPCNXL2在ICC中调节ERK/MAPK信号通路的激活
图4 CircPCNXL2在ICC中调节ERK/MAPK信号通路的激活
CircPCNXL2与STRAP相互作用,介导ERK/MAPK信号通路的激活
为了研究circPCNXL2如何调控ICC中ERK的磷酸化,作者通过RNA pulldown实验,结合银染分析和MS分析,在大约40 KD处观察到一个特定的条带,条带可能能够与circPCNXL2结合(图5a-b)。接下来,RNA pulldown、RIP检测和FISH证实了circPCNXL2和STRAP之间的相互作用(图5c-e)。但是,circPCNXL2的敲低或过表达对STRAP的表达没有产生影响(图5g-h)。由此推测circPCNXL2可能作为促进ERK激活的支架。作者通过IP和Western Blot检测实验表明,STRAP可以与MEK1/2结合(图5i-j)。接着,为了研究circPCNXL2是否对ICC中STRAP和MEK1/2之间的相互作用有影响,作者在circPCNXL2过表达或敲低的HuCCT1和RBE细胞中的STRAP或MEK1/2抗体进行了免疫共沉淀实验。结果表明,circPCNXL2的过表达可以促进STRAP与MEK1/2之间的结合,而不改变其蛋白水平(图5k-l)。同时,结果进一步证实,circPCNXL2也参与了ERK1/2-MEK1/2的相互作用,并促进ERK1/2的磷酸化(图5m-n)。综上所述,在ICC中,circPCNXL2可以与STRAP相互作用,促进STRAP与MEK1/2的关联,并负责MEK1/2磷酸化ERK1/2。
此外,为了分析circPCNXL2与STRAP相互作用的精确结合域,作者设计了一系列flag标记的STRAP缺失突变体用于RIP和RNA pulldown分析。结果显示,第4个和第5个WD-40结构域负责STRAP与circPCNXL2的结合(图5o-q)。
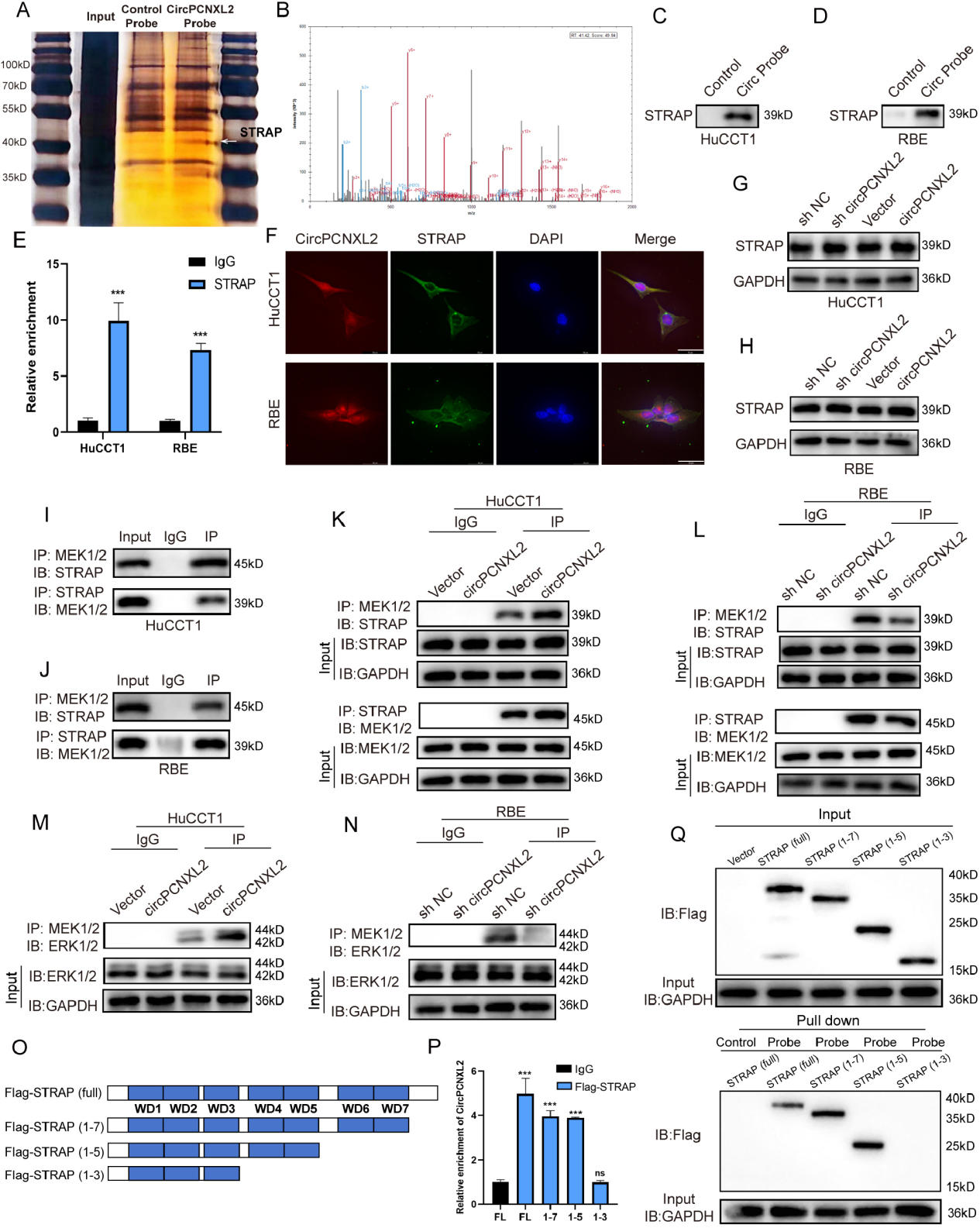 图5 CircPCNXL2与STRAP相互作用, 介导ERK/MAPK信号通路的激活
图5 CircPCNXL2与STRAP相互作用, 介导ERK/MAPK信号通路的激活
CircPCNXL2通过海绵化miR-766-3p上调SRSF1的表达
RIP显示,在HuCCT1和RBE细胞中,AGO2抗体显著富集circPCNXL2,表明circPCNXL2可能在ICC中发挥miRNA抑制作用。作者通过使用生物素标记的circPCNXL2探针进行RNA pulldown分析,与预测的miRNA结合,miR- 766-3p是最富集的miRNA(图6b)。RIP检测结果显示,miR-766-3p被AGO2抗体富集,而不是被IgG抗体富集(图6c)。另外作者也证实,与正常组织相比,miR-766-3p在ICC组织中表达下调,ICC患者的低水平miR-766-3p与不良生存率相关,miR-766-3p在ICC组织中的表达与circPCNXL2水平呈负相关(图6 d-f)。此外,双荧光素酶报告分析结果表明,circPCNXL2在ICC中起着miR-766-3p海绵的作用(图6g)。
为了研究miR-766-3p在ICC生长中的作用,作者在HuCCT1或RBE细胞中转染了miR-766-3p模拟物或抑制剂。结果表明,miR-766-3p模拟物显著抑制了HuCCT1细胞的增殖和迁移,而miR-766-3p抑制剂促进了RBE细胞ICC的进展。(图6h-i)。综上所述,miR-766-3p可以抑制ICC细胞的肿瘤发生。
在作者前期的研究中,miR-766-3p可以通过直接靶向SRSF1的来抑制肾细胞癌的进展。由此推测SRSF1也可能是ICC中miR-766-3p的下游基因。实验发现,转染miR-766-3p模拟物的HuCCT1细胞中SRSF1 mRNA和蛋白水平降低,而转染miR-766-3p抑制剂的RBE细胞中SRSF1细胞和蛋白水平升高(图6j-kh)。qRT-PCR实验发现,与正常组织相比,SRSF1在ICC组织中表达上调(图6l)。SRSF1的高表达是ICC患者的致癌因素之一(图6m)。此外,SRSF1表达与circPCNXL2表达呈正相关,而与miR-766-3p的表达呈负相关(图6n-o)。然后,双荧光素酶报告分析结果证实了SRSF1与miR-766-3p之间的相互作用(图6p)。
为了探讨SRSF1在ICC进展中的作用,作者HuCCT1和RBE细胞中对SRSF1进行过表达和敲除。克隆形成和transwell检测结果表明,过表达SRSF1显著促进了HuCCT1细胞的增殖和迁移。SRSF1敲低的RBE细胞中发现了相反的结果(图6q-r)。此外,SRSF1可以促进HuCCT1和RBE细胞中ERK的磷酸化,这可以通过过表达或下调circPCNXL2来逆转(图6s-t)。综上所述,circPCNXL2可通过miR- 766-3p/SRSF1/ERK通路调节ICC的增殖和迁移。
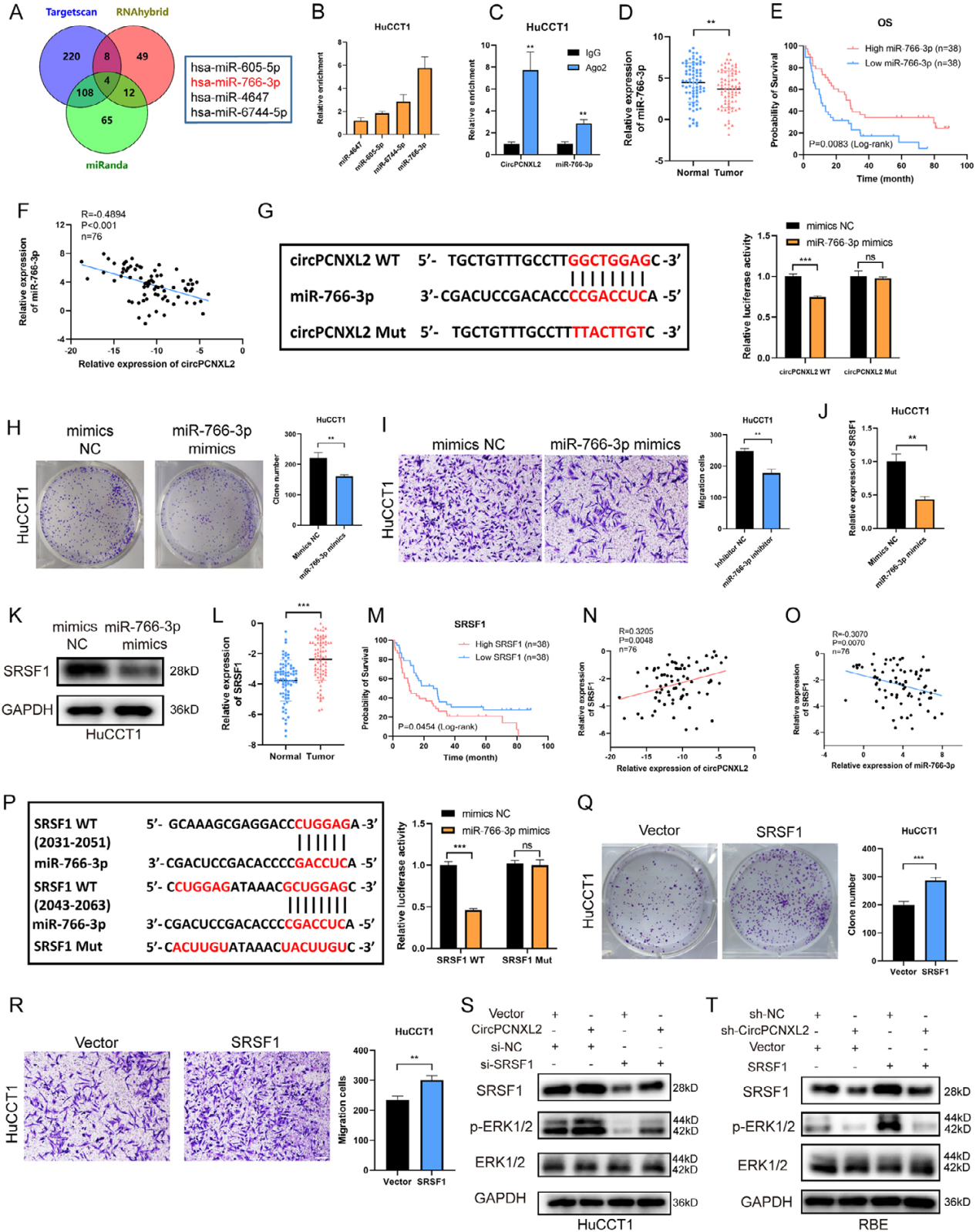 图6 CircPCNXL2通过海绵化miR-766-3p上调SRSF1的表达
图6 CircPCNXL2通过海绵化miR-766-3p上调SRSF1的表达
CircPCNXL2作为一种潜在的治疗靶点,可减轻曲美替尼在体内的抗肿瘤作用
为了研究circPCNXL2对曲美替尼(MEK抑制剂)的影响,作者利用曲美替尼在体内抑制MEK/ERK通路,并利用过表达circPCNXL2的HuCCT1细胞建立皮下异种移植模型和肝转移模型。体内实验包括四组(Vector+DMSO、circicPCNXL2OE+DMSO、Vector+曲美替尼、circcPCNXL2 OE+曲美替尼)。在异种移植模型中,曲美替尼抑制肿瘤生长,而这种抑制作用被过表达circPCNXL2所逆转(图7a-c)。IHC染色显示,曲美替尼组的Ki-67和p-ERK染色最弱(图7d)。circPCNXL2的上调显著降低了曲美替尼在ICC中的抗肿瘤作用。在肝转移模型中也观察到类似的结果。曲美替尼治疗减少了肝转移灶的数量,而过表达circPCNXL2可减弱这种影响(图7e-f)。综上所述,circPCNXL2通过激活ERK磷酸化抑制曲美替尼在ICC的抗肿瘤疗效,这可能是一种有前途的ICC治疗策略。
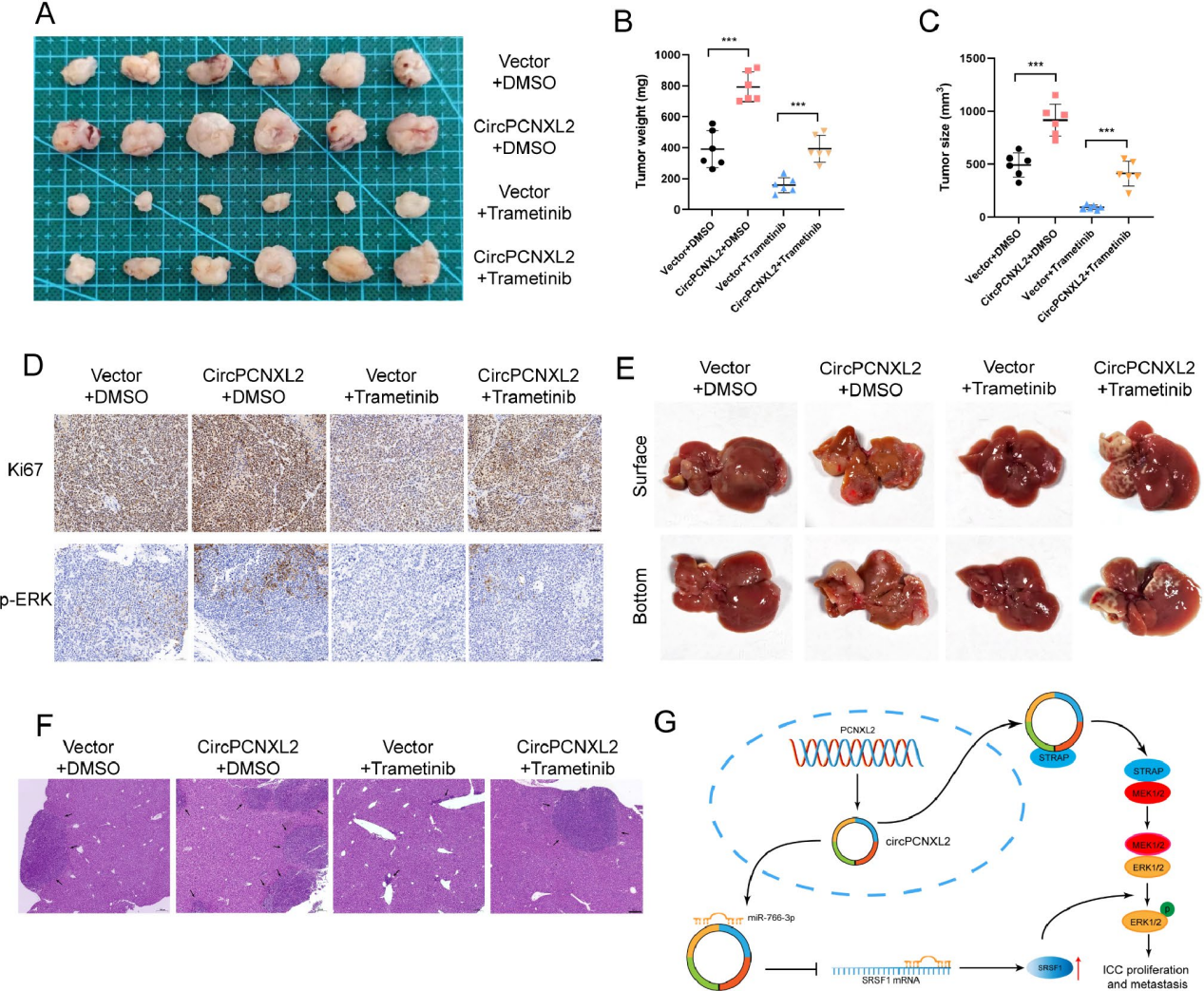 图7 CircPCNXL2作为一个潜在的治疗靶点, 并减轻曲美替尼在体内的抗肿瘤作用
图7 CircPCNXL2作为一个潜在的治疗靶点, 并减轻曲美替尼在体内的抗肿瘤作用
总结
本研究表明circPCNXL2在ICC中上调,并通过与STRAP相互作用促进ERK磷酸化,在ICC发展中发挥肿瘤启动子的作用。此外,circPCNXL2作为miR-766-3p的海绵,导致SRSF1的上调,从而进一步激活ICC中的MEK/ERK通路(图7g)。同时,circPCNXL2可以作为ICC患者的诊断和预后生物标志物。circPCNXL2-STRAP-MEK-ERK轴是研究ICC的一个很有前途的翻译治疗靶点。
原文链接
https://doi.org/10.1186/s12943-024-01950-y
.png)