本期特邀陆军军医大学连继勤教授团队分享解读,感谢对circRNA平台的关注!
胃癌是消化系统最常见的恶性肿瘤之一,其死亡人数位居我国肿瘤相关死亡病例的第三位。由于早期胃癌没有明显症状,大多数胃癌患者首诊时已处于中晚期。癌细胞的浸润及远处转移是中晚期胃癌的重要特征,随着转移程度的增加,胃癌患者术后五年生存率逐步降低,因此转移是造成胃癌患者死亡的重要原因。部分肿瘤细胞脱离细胞外基质后仍能继续存活(获得抗失巢凋亡能力),是造成肿瘤转移的先决条件之一。因此,探究胃癌细胞抗失巢凋亡的分子机制,对预防肿瘤转移以及提高中晚期肿瘤患者治疗效果具有重要的临床意义。
环状RNA(Circular RNA,circRNA)是由线性前体RNA反向剪接生成的闭合环形RNA分子,在细胞浆、细胞核、线粒体中均有分布,以吸附miRNA、调控蛋白复合体组装甚至是翻译为短肽等多种机制参与到各项生命活动过程中。尽管已有多项研究表明circRNA在胃癌进展中发挥重要作用,但circRNA是否可通过调节胃癌细胞失巢凋亡从而介导胃癌转移尚未见报道。我们从介导胃癌细胞失巢凋亡的自噬关键分子ATG4B出发,寻找可能调控胃癌转移的circRNA,并探寻可能的干预措施,为转移性胃癌的临床治疗提供新思路。
2024年3月8日,《Autophagy》(IF=13.3)发表了陆军军医大学连继勤教授团队的研究论文,题为“Lopinavir enhances anoikis by remodeling autophagy in a circRNA-dependent manner”。该研究证实了FDA批准药物洛匹那韦(Lopinavir)能够以circRNA依赖方式促进胃癌细胞失巢凋亡进而抑制转移,率先提出了具有潜在临床应用价值的靶向circRNA的治疗方法。具体而言,circSPECC1通过与ATG4B结合,加速ATG4B相分离并促进ATG4B泛素化降解;而ELAVL1以m6A依赖方式结合并下调circSPECC1,解除了circSPECC1对ATG4B的抑制作用,使胃癌细胞获得抗失巢凋亡能力,进而造成远处转移。FDA批准药物洛匹那韦通过抑制ELAVL1与circSPECC1结合,上调circSPECC1表达,从而抑制胃癌转移。洛匹那韦有望成为转移性胃癌的潜在临床干预手段。

亮点
1. CircSPECC1与ATG4B结合,加速ATG4B相分离。
2. CircSPECC1通过加速ATG4B相分离,促进ATG4B泛素化降解。
3. CircSPECC1通过下调ATG4B抑制自噬,促进胃癌细胞失巢凋亡。
4.胃癌组织中异常高表达的ELAVL1,以m6A依赖方式结合circSPECC1并抑制其表达。
5. FDA批准药物洛匹那韦,通过阻断ELAVL1与circSPECC1结合,上调circSPECC1抑制胃癌细胞转移。
1、CircSPECC1与ATG4B结合,抑制ATG4B表达。
连继勤教授团队通过ATG4B RIP-seq分析,进一步结合RNA pull down及RIP-qPCR验证,发现ATG4B可与circSPECC1、circBPTF以及circASXL1三个circRNA结合(图1A-E)。采用靶向反向剪接位点的siRNA对上述三个circRNA分别进行敲降,结果显示只有circSPECC1可抑制ATG4B表达,同时伴随有自噬水平降低(图1F-L)。ATG4B截短突变结合RIP-qPCR及RNA pull down实验证实,ATG4B与circSPECC1结合依赖其191-305位氨基酸序列(图1M-O)。
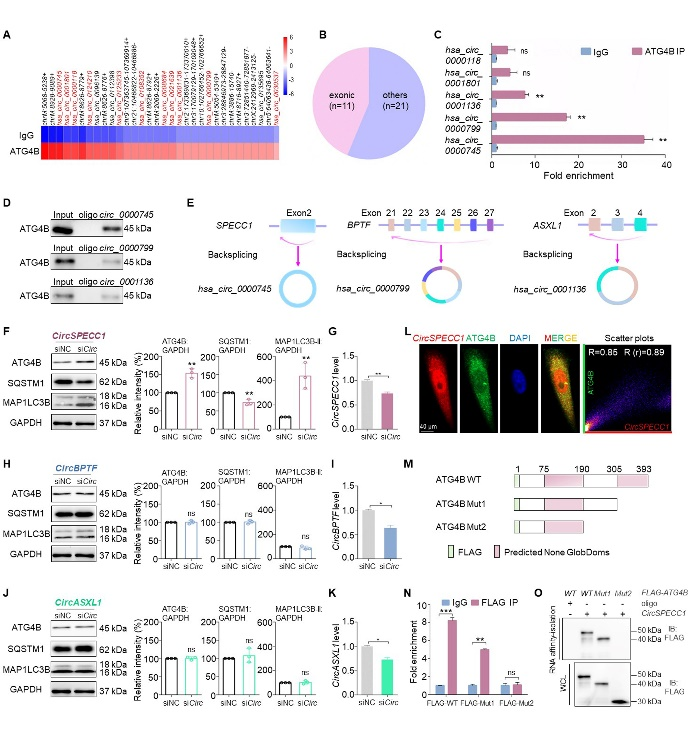 图1. ATG4B与circSPECC1结合并受circSPECC1负调控
图1. ATG4B与circSPECC1结合并受circSPECC1负调控
2、CircSPECC1通过加速ATG4B相分离,促进ATG4B泛素化降解。
研究表明,RNA与蛋白结合,可促进蛋白发生相分离。相分离在维持细胞内各生化反应有序进行、提高生化反应效率方面发挥重要作用。采用IUPred2A对ATG4B氨基酸序列进行分析,发现存在可能的内部无序区(IDRs)。将该区域进行缺失突变后,ATG4B在细胞内聚集的荧光小点变为弥散分布(图2A,B)。时序图像分析及FRAP实验证实,ATG4B形成的荧光斑点具有高度动态性,具备相分离凝聚体的特征,过表达circSPECC1可促进ATG4B发生相分离(图2C,D)。分别检测circSPECC1对ATG4B野生型及无法发生相分离的IDRs缺失突变体的蛋白稳定性影响,发现circSPECC1可缩短ATG4B蛋白半衰期,而对无法发生相分离的缺失突变体无显著影响(图2E-I)。进一步通过免疫共沉淀实验检测ATG4B泛素化水平变化,证实circSPECC1增强了RNF5介导的ATG4B泛素化降解(图2J-O)。
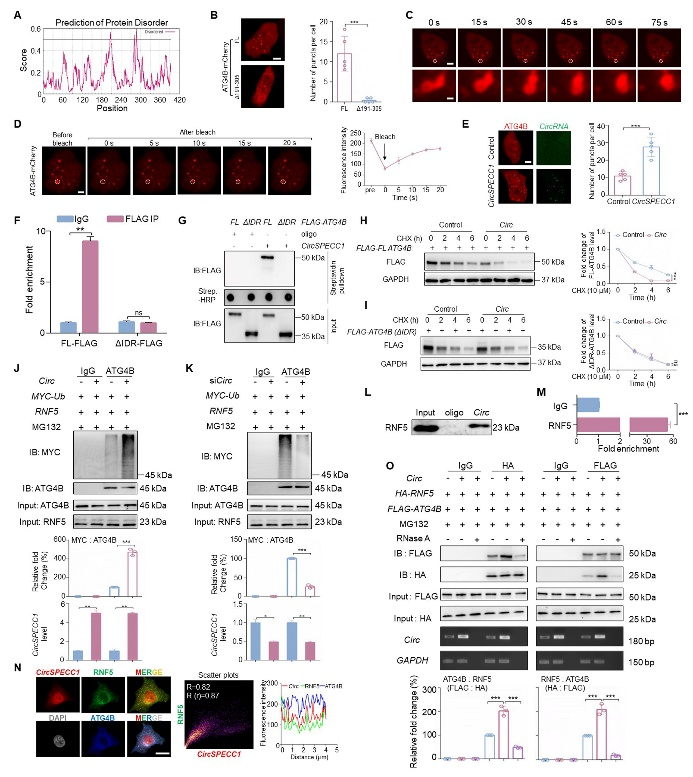 图2. CircSPECC1通过加速ATG4B相分离促进ATG4B泛素化降解
图2. CircSPECC1通过加速ATG4B相分离促进ATG4B泛素化降解
3、在体水平证实circSPECC1对ATG4B具有负调控作用。
与癌旁组织相比,胃癌组织中circSPECC1水平显著降低,ATG4B表达水平明显升高。且在TNM分期为III/IV期、淋巴结转移阳性及具有远处转移的组织中,circSPECC1表达水平显著下调,而ATG4B表达明显增加(图3A-J),表明上述两个分子与胃癌转移密切相关。胃癌组织中相关性分析发现,circSPECC1与ATG4B呈负相关,且二者联合分析对于患者生存期预测具有重要意义(circSPECC1表达越低、同时ATG4B表达越高的患者生存期越短)(图3K-N)。表明胃癌组织中低表达的circSPECC1是造成ATG4B升高进而发生转移的重要原因。
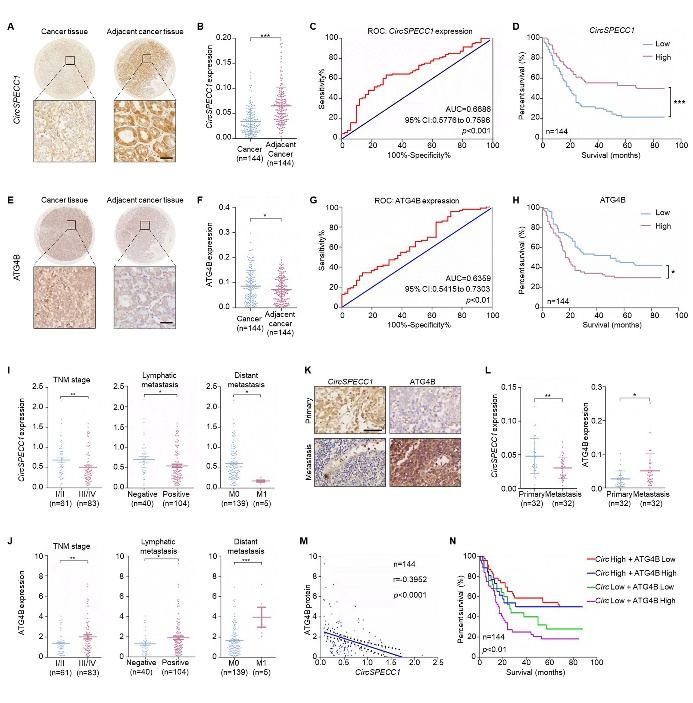 图3. 胃癌组织中circSPECC1表达水平与ATG4B呈负相关
图3. 胃癌组织中circSPECC1表达水平与ATG4B呈负相关
4、ELAVL1以m6A依赖方式与circSPECC1结合,并通过下调circSPECC1促进ATG4B表达。
M6A在维持细胞内circRNA水平的动态平衡过程中发挥重要作用。MeRIP-qPCR实验证实,circSPECC1能够发生m6A修饰(图4A)。生信预测结合RIP-qPCR、RNA pull down及荧光共定位分析发现,阅读蛋白ELAVL1与circSPECC1结合(图4B-E)。定点突变实验证实,ELAVL1识别circSPECC1需以m6A依赖方式进行(图4F-H)。此外,Real-time PCR实验发现ELAVL1对circSPECC1发挥负调控作用,功能回复实验证实ELAVL1通过下调circSPECC1促进ATG4B表达,从而抑制胃癌细胞失巢凋亡(图4I-N)。
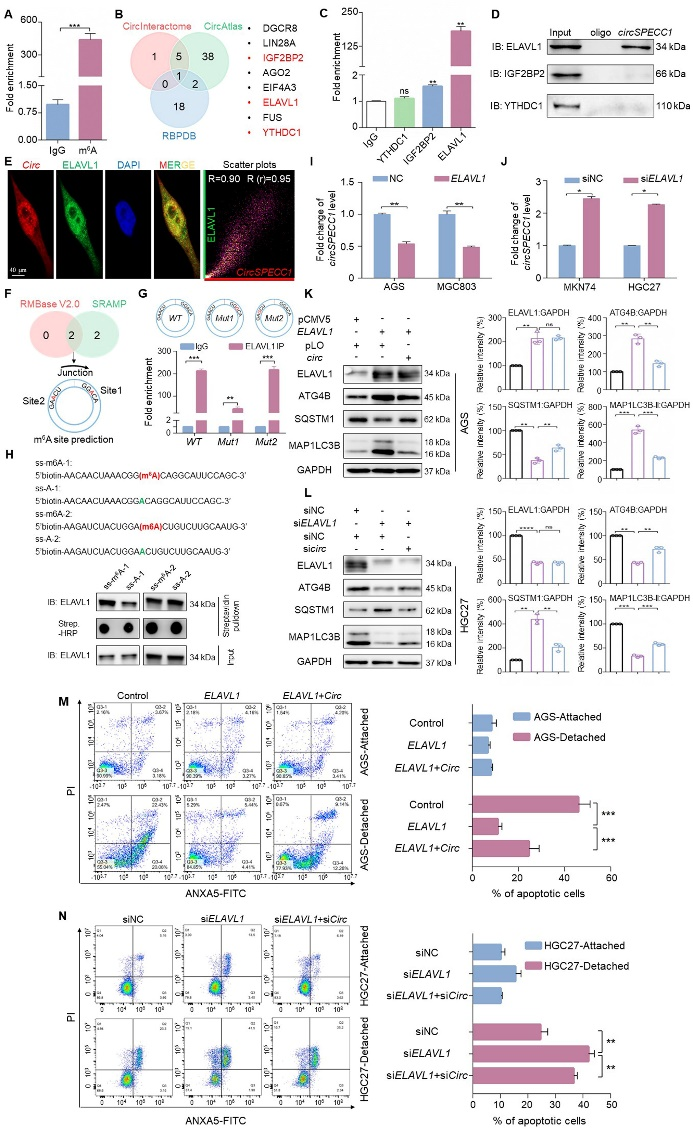
图4. ELAVL1以m6A依赖方式与circSPECC1结合并下调circSPECC1
5、在体水平证实ELAVL1对circSPECC1具有负调控作用。
与癌旁组织相比,胃癌组织中ELAVL1水平显著升高。且在TNM分期为III/IV期、淋巴结转移阳性及具有远处转移的组织中,ELAVL1表达明显增加(图5A-G),表明ELAVL1与胃癌转移密切相关。胃癌组织中相关性分析发现,ELAVL1表达水平与circSPECC1呈明显负相关,与ATG4B呈正相关。两两联合分析对于患者生存期预测具有重要意义(ELAVL1表达越高同时circSPECC1表达越低、ELAVL1及ATG4B同时表达较高的患者生存期越短)(图5H-K)。
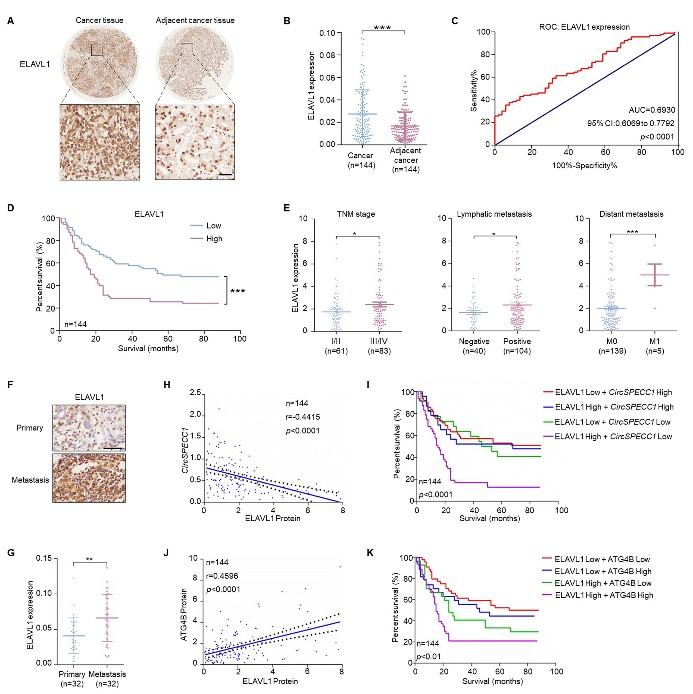 图5. 胃癌组织中ELAVL1表达水平与circSPECC1负相关
图5. 胃癌组织中ELAVL1表达水平与circSPECC1负相关
6、FDA批准药物洛匹那韦可显著抑制ELAVL1与circSPECC1结合。
通过分子对接结合虚拟筛选,发现确实存在小分子化合物可进入到ELAVL1与circSPECC1的结合区域。通过对接时所需自由能高低进行排序,选取了所需自由能最低的60个化合物(图6A-D)。在这60个化合物中,有20个化合物为FDA批准药物。考虑到临床使用的可行性,排除掉上述20个化合物中的兽用抗生素、手术麻醉剂等具有特殊用途的药物,对剩余15个药物进行筛选,发现洛匹那韦可显著抑制悬浮培养状态下胃癌细胞存活(图6E-H)。RIP-qPCR实验进一步证实洛匹那韦可抑制ELAVL1与circSPECC1结合(图6I)。
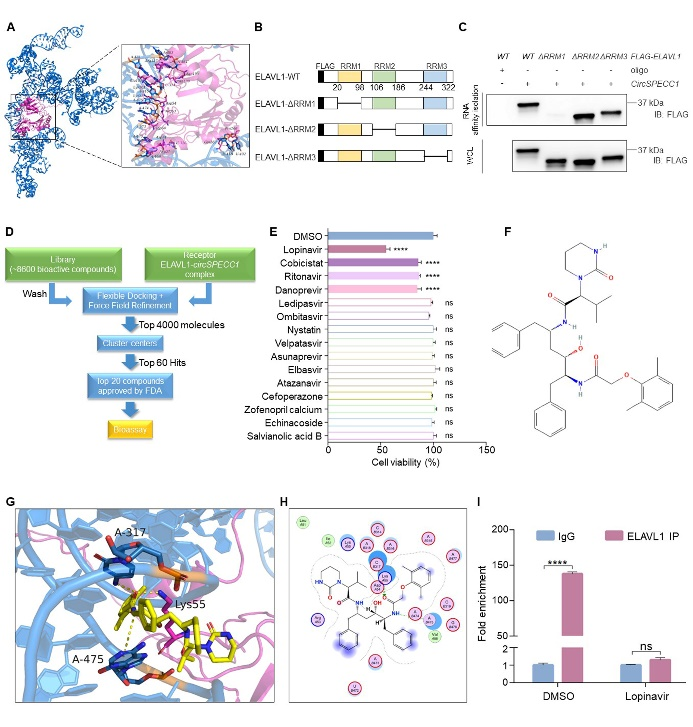 图6. 洛匹那韦可显著抑制ELAVL1与circSPECC1结合
图6. 洛匹那韦可显著抑制ELAVL1与circSPECC1结合
7、洛匹那韦通过上调circSPECC1抑制ATG4B,进而促进胃癌细胞失巢凋亡。
Real-time PCR结合Western blot实验证实,洛匹那韦可促进circSPECC1表达水平升高,同时伴随ATG4B水平降低及自噬水平下降(图7A-D)。功能回复实验发现,沉默circSPECC1可解除洛匹那韦对ATG4B的抑制作用,并减少洛匹那韦所诱导的失巢凋亡(图7E-I)。
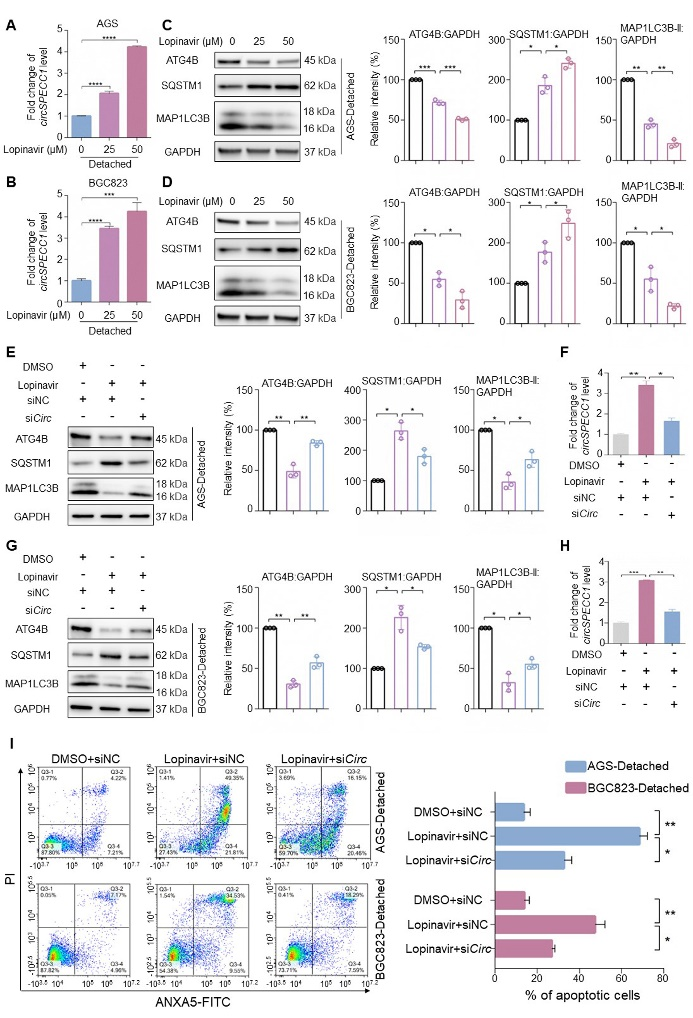 图7. 洛匹那韦通过上调circSPECC1促进胃癌细胞失巢凋亡
图7. 洛匹那韦通过上调circSPECC1促进胃癌细胞失巢凋亡
8、洛匹那韦抑制尾静脉肺转移小鼠模型中胃癌细胞转移。
小动物活体成像显示,与对照组相比,洛匹那韦处理组裸鼠肺部的荧光信号显著降低(图8A,B)。HE染色结果表明,洛匹那韦处理组小鼠肺部转移灶数量明显减少,且转移灶中circSPECC1表达水平升高,ATG4B表达水平降低(图8C-F)。
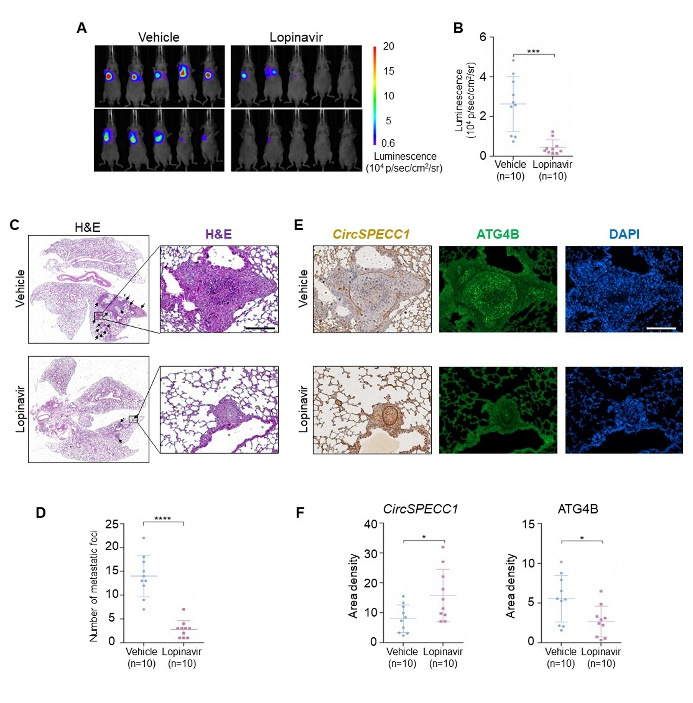 图8. 洛匹那韦可抑制肺转移小鼠模型中胃癌细胞转移
图8. 洛匹那韦可抑制肺转移小鼠模型中胃癌细胞转移
结论
总之,该研究从体外细胞水平,动物体内水平及临床标本水平证实了ELAVL1-circSPECC1-ATG4B通路在胃癌失巢凋亡抵抗以及转移中的作用,并据此提出了新的潜在干预策略,为转移性胃癌的临床预防与治疗提供了新思路。
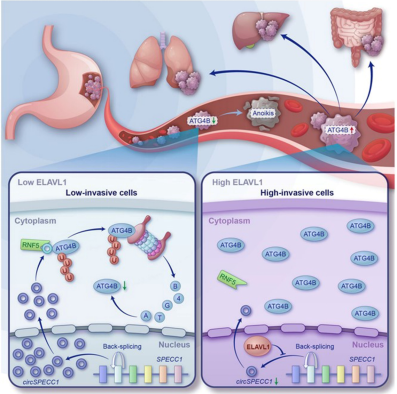 图9. ELAVL1通过抑制circSPECC1上调ATG4B表达促进胃癌细胞失巢凋亡抵抗以及转移
图9. ELAVL1通过抑制circSPECC1上调ATG4B表达促进胃癌细胞失巢凋亡抵抗以及转移
原文链接
https://doi.org/10.1080/15548627.2024.2325304
.png)