肝细胞癌(HCC)已成为世界上最恶性的肿瘤之一,是一种高度致命的癌症。环状RNA (circRNAs)是一种具有闭环结构的非编码RNA,通过作为miRNA的分子海绵或与蛋白质结合来调节生物过程,也参与细胞增殖、分化、凋亡、侵袭等。circRNA可被包裹成外泌体,参与细胞间信号传递,促进多种肿瘤的恶性进展。CD8+T细胞功能障碍是肝细胞癌(HCC)免疫逃逸的主要因素。然而,外泌体来源的环状RNA对CD8+T细胞功能障碍的影响有待进一步探索。
2023年3月,昆明市第一人民医院&昆明医科大学附属医院肝胰胆外科李立教授课题组在Molecular Cancer(IF=41.444)发表文章Exosome-derived circCCAR1 promotes CD8+ T-cell dysfunction and anti-PD1 resistance in hepatocellular carcinoma。作者研究发现,在HCC肿瘤组织和外泌体中存在的环状RNA,通过circCCAR1/miR-127-5p/WTAP反馈环路上调WTAP,促进肿瘤生长和转移。HCC细胞以hnRNPA2B1依赖方式分泌circCCAR1可被活化的CD8+T细胞吸收,通过增强PD1蛋白的稳定性,造成CD8+T细胞的功能障碍。研究还确定了EP300和EIF4A3作为circCCAR1生物合成的促进因子,WTAP介导的m6A修饰作为circCCAR1的稳定剂。文章阐述了外泌体衍生circCCAR1促进肝细胞癌CD8+T细胞功能紊乱和anti-PD1的耐药性机制。

circCCAR1在HCC组织中高表达
首先,作者对HCC患者和健康对照组的血清外泌体进行circRNA微陈列检测其表达谱。选择HCC患者血清中外泌体表达量最高的circCCAR1(hsa_circ_0000240)进行下一步分析。作者通过circBase数据库、RT-PCR和Sanger测序确定了circCCAR1的环化位点。放线菌素D验证circCCAR1稳定性。RNA荧光原位杂交FISH验证其定位细胞质。circCCAR1在HCC临床样本和细胞系中的表达量增加。综上所述,circCCAR1在HCC组织中高表达。
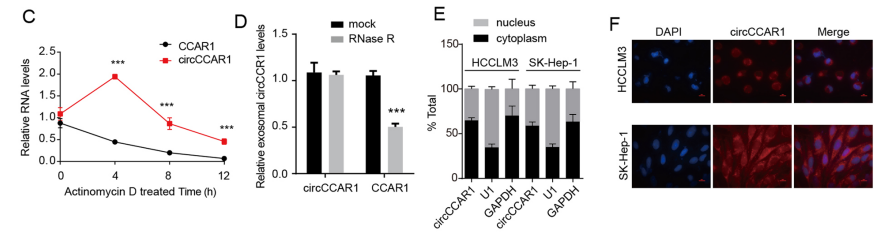
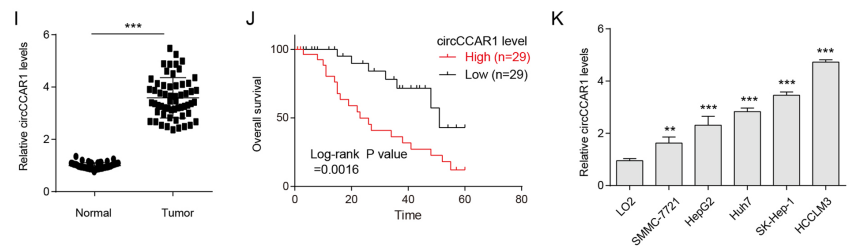
图1 circCCAR1在HCC组织中高表达
作者对circCCAR1在HCC中的可能功能进行研究。circCCAR1过表达促进细胞增殖并增强HCCLM3和SK-Hep-1细胞的集落形成能力。circCCAR1的过表达促进了异种移植肿瘤的生长。这些数据表明,circCCAR1促进了HCC在体外和体内的生长。
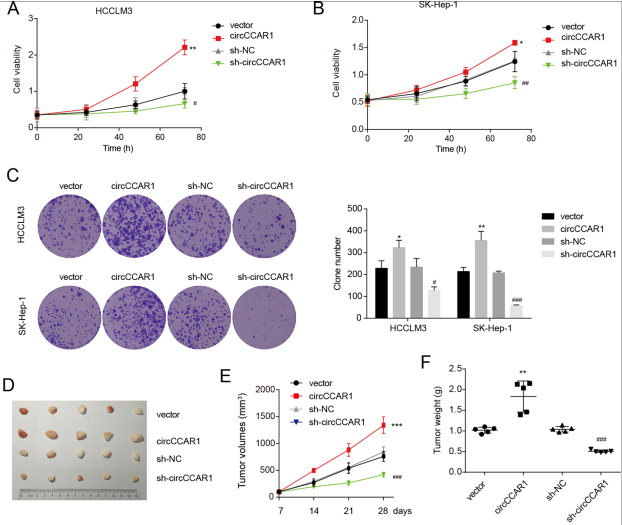
图2 circCCAR1在体内外均促进HCC的生长
转移是癌症的一个标志,HCC的转移严重损害了HCC患者的预后。作者研究发现circCCAR1的过表达可以增加HCC细胞的迁移和侵袭能力,而其缺失则降低了细胞的迁移和侵袭能力。在小鼠模型中,circCCAR1过表达组表现出更多和更严重的转移结节,而其沉默则降低了转移结节数量。总体而言,该研究揭示了circCCAR1在加速HCC细胞侵袭方面的重要性。
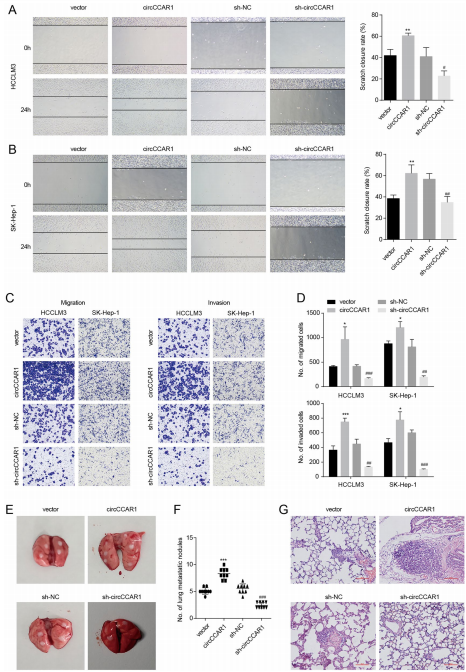
图3 circCCAR1在体内外均能促进HCC的转移
EP300介导的H3K27ac促进HCC中circCCAR1的表达
H3K27ac组蛋白乙酰化在调控HCC的进程中发挥着重要作用,可以控制circCCAR1或CCAR1的表达。组蛋白乙酰转移酶抑制剂减少了CCAR1 mRNA和circCCAR1水平。EP300介导的组蛋白乙酰化激活增加了circCCAR1的表达。结果表明,EP300介导的组蛋白乙酰化激活增加了circCCAR1的表达。
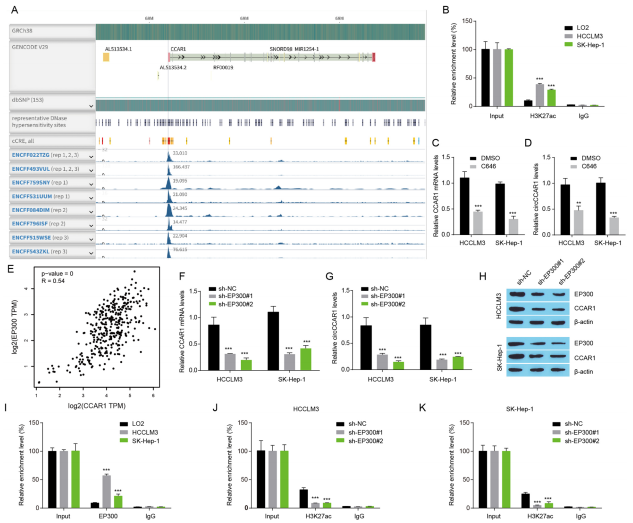
图4 EP300介导的H3K27ac促进HCC中circCCAR1的表达
RBPs与circRNA的相互作用可调节circRNA产生。研究通过Circ Interactome预测发现EIF4A3可结合到circCCAR1的上游、反向剪接连接位点和下游侧翼序列,并证实EIF4A3能与一个上游假定的结合位点、背剪接连接位点和一个下游假定的结合位点结合。MS2 RNA pull-down实验结果表明,EIF4A3与circCCAR1的上游和下游序列结合。EIF4A3过表达可增加HCC细胞中circCCAR1水平,敲低EIF4A3则相反。RIP和生物素标记RNA pull-down实验佐证了EIF4A3与circCCAR1的相互作用。
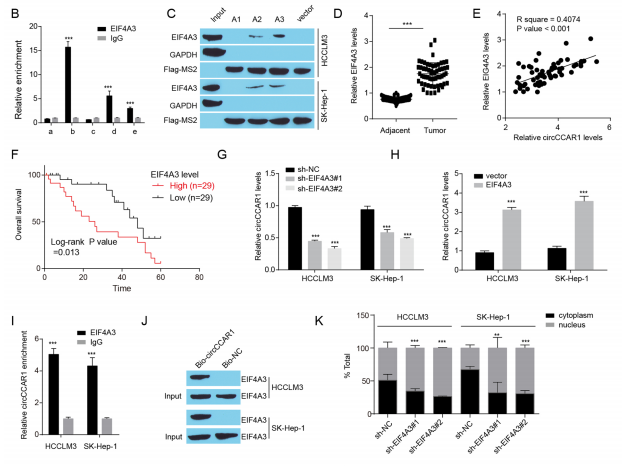
图5 EIF4A3促进circCCAR1的生成
WTAP介导的m6A修饰通过IGF2BP3增强了circCCAR1的稳定性
MeRIP-qPCR验证了circCCAR1中m6A的富集。作者发现用MAO靶向circCCAR1五个不同位点的处理使HCC细胞表现出更低的circCCAR1水平,RIP和生物素标记的RNA pull-down实验也验证WTAP、IGF2BP1、IGF2BP2和IGF2BP3四种蛋白都富集在circCCAR1复合物中。随后,作者探索WTAP-m6A-IGF2BP3轴在HCC中调控circCCAR1失调的潜在机制,发现WTAP敲低显著降低circCCAR1的m6A修饰和IGF2BP3对circCCAR1的结合,表明IGF2BP3对circCCAR1的结合依赖于WTAP介导的m6A修饰。总之,WTAP介导的m6A修饰通过IGF2BP3增强了circCCAR1的稳定性。研究也发现circCCAR1通过靶向miR-127-5p上调WTAP在HCC细胞中的表达。
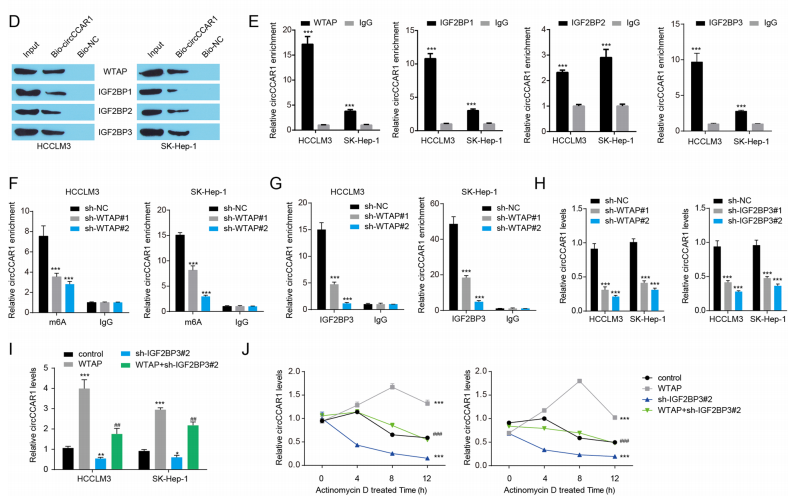
图6 WTAP介导的m6A修饰通过IGF2BP3增强了circCCAR1的稳定性
hnRNPA2B1介导的circCCAR1包装成外泌体
作者发现肝癌患者血清与肝癌患者肿瘤组织中circCCAR1表达水平呈正相关,可作为预后诊断指标。外泌体抑制剂对HCC细胞中circCCAR1的水平没有影响。HCC细胞中circcCCAR1的过表达提高了外泌体circCCAR1的水平,而circCCAR1的敲低降低了外泌体circCCAR1的水平。总之,这些结果表明circCCAR1可以被包装成外泌体。作者进一步探讨了circCCAR1被包裹成外泌体的潜在机制。通过RIP和RNA pulldown实验,circCCAR1可以与hnRNPA2B1结合。此外,circCCAR1在hnRNPA2B1缺失的HCC细胞中表达增强,而外泌体表达减少。总之,circCCAR1可以以hnRNPA2B1依赖的方式被包装成外泌体。
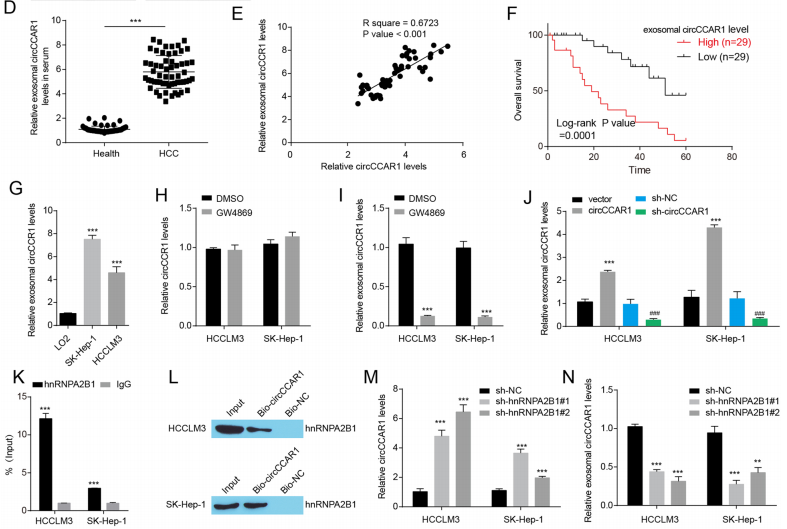
图7 hnRNPA2B1介导的circCCAR1包装成外泌体
外泌体circCCAR1加速抗肿瘤CD8 + T细胞的衰竭
肿瘤细胞分泌的外泌体可以通过调节免疫应答来调节肿瘤的进展,其中CD8+T细胞被认为是最重要的抗肿瘤细胞类型。因此,作者研究了外泌体circCCAR1对CD8+T细胞的影响。研究发现HCC细胞的外泌体被活化的CD8+T细胞短暂吸收。外泌体circCCAR1共培养降低活化CD8+T细胞中穿孔素和颗粒酶B的蛋白水平,抑制活化CD8+T细胞培养上清中IFN-γ和TNF-α的分泌。结果显示,外泌体circCCAR1抑制CD8+T细胞增殖,促进其凋亡,降低其细胞毒性和细胞因子分泌,促进活化CD8+T细胞的功能障碍。
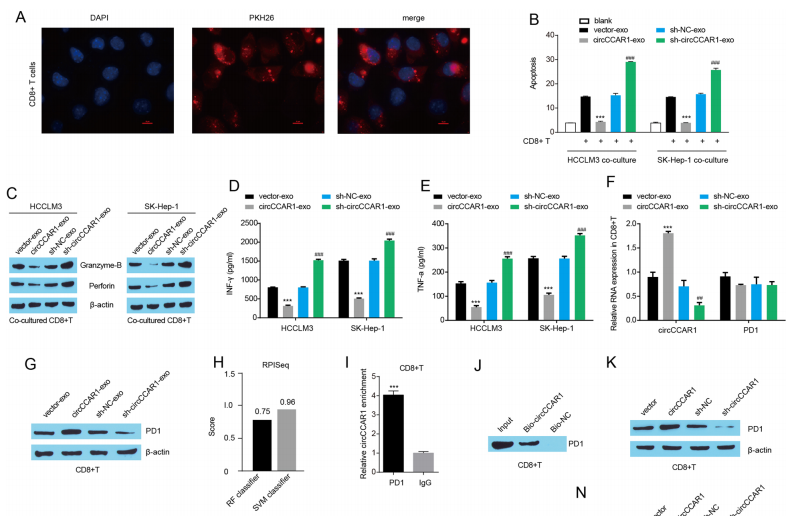
图8 外泌体circCCAR1加速抗肿瘤CD8 + T细胞的衰竭
circCCAR1促进HCC对anti-PD1治疗的耐药性
过表达circCCAR1通过与β-catenin结合促进PD-L1转录,从而抑制CD8+T细胞功能并支持肿瘤生长,而其敲低可增强CD8+T细胞功能并减缓肿瘤进展。此外,circCCAR1也参与了肝癌对anti-PD1治疗的抗性,并且与CD8+T细胞浸润在肝癌组织中呈负相关。
为了探讨circCCAR1在anti-PD1治疗中的作用,我们构建了HuNSG小鼠异种移植模型。研究发现,携带过表达circCCAR1细胞的HuNSG小鼠外周血外泌体circCCAR1增加,CD8+T细胞低于对照组(图9B)。circCCAR1高表达的异种移植小鼠对PD1治疗有耐药性,生存时间更短。综上所述,circCCAR1促进了HCC的anti-PD1治疗耐药性。
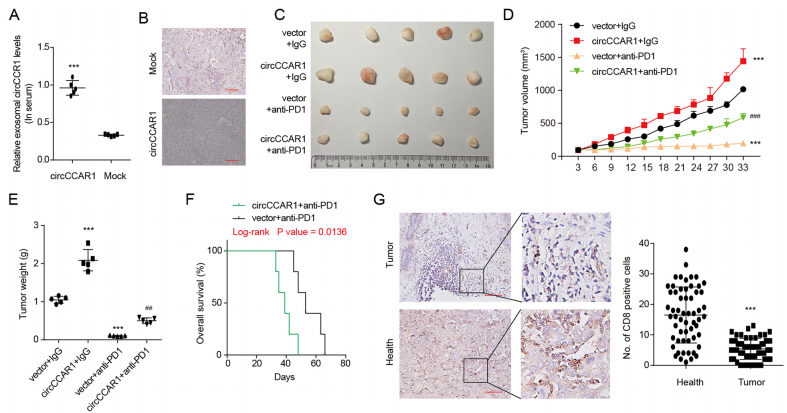
图9 circCCAR1促进HCC对anti-PD1治疗的耐药性
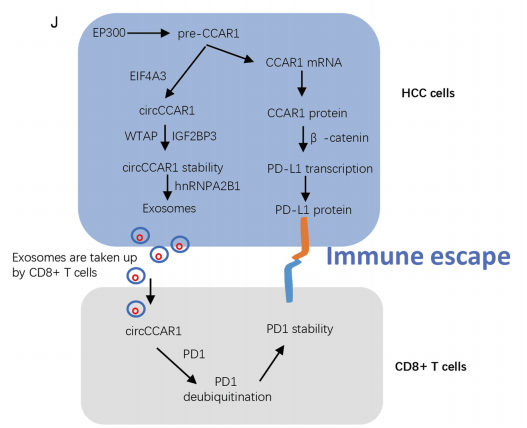
综上所述,circCCAR1和CCAR1在HCC中增强,可作为HCC患者的预后指标。circCCAR1/miR-127-5p/WTAP正反馈回路增强了HCC的生长和转移。HCC细胞分泌的外泌体circCCAR1可被活化的CD8+T细胞吸收,通过增强PD1蛋白的稳定性,促进CD8+T细胞的功能障碍。此外,HCC细胞中CCAR1蛋白表达的增加通过结合β-catenin促进PD-L1的转录,这可能会增强anti-PD1治疗的耐药性。因此,靶向外泌体circCCAR1或CCAR1可能是一种新的策略,以最大限度地提高HCC患者的免疫治疗效率。
图10 circCCAR1介导的HCC免疫抑制模型
原文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01759-1
转载请联系邮箱授权:circRNA@163.com











.png)