检索式:(circRNA[Title/Abstract]) OR circular RNA[Title/Abstract]
杂志:Signal Transduct Target Ther
影响因子:38.104
通讯作者:袁琼(西南医科大学心血管医学研究所)
背景:
在这项研究中,作者发现了一种保守的环状RNA(circRNA)DICAR,它在糖尿病小鼠心脏中被下调。DICAR对糖尿病心肌病(DCM)具有抑制作用,因为DICAR缺乏(DICAR+/-)小鼠发生自发性心脏功能障碍、心肌细胞肥大和心肌纤维化,而DICAR过表达的DICARTg小鼠DCM减轻。在细胞水平上,作者发现DICAR的过表达抑制了糖尿病心肌细胞焦亡,但DICAR敲低增强了糖尿病心肌的焦下垂。在分子水平上,研究团队发现DICAR-VCP-Med12降解可能是DICAR介导效应的潜在分子机制。合成的DICAR结部分(DICAR-JP)表现出与整个DICAR类似的效果。此外,糖尿病患者循环血细胞和血浆中DICAR的表达低于健康对照组,这与糖尿病患者心脏中DICAR的表达降低一致。DICAR和合成的DICAR-JP可以是DCM的候选药物。
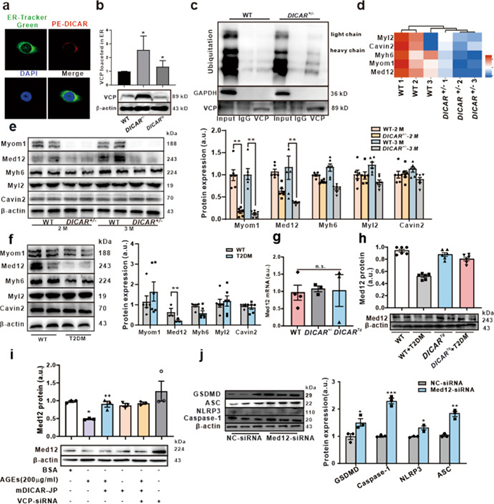
VCP通过Ub蛋白系统介导Med12蛋白降解
杂志:Sci Total Environ
影响因子:10.753
通讯作者:黄丽华(包头医学院公共卫生学院)
背景:
氧化钕纳米颗粒(NPs-Nd2O3)越来越多地用于工业和生物医药,会对健康造成不良影响,如肺部疾病。然而,目前尚不清楚控制这些不良后果的潜在分子机制。在本研究中,将人支气管上皮细胞系(16HBE)暴露于浓度增加的NPs-Nd2O3,并通过气管内滴注NPs-Nd2O3对Sprague-Dawley大鼠进行治疗。作者发现,暴露于NPs-Nd2O3会导致16HBE细胞和大鼠肺组织中的DNA损伤和环状RNA(circRNA)circ_002363水平下调。研究团队还观察到,从事NPs-Nd2O3生产的工人血清中的circ_002363水平随着工作时间的推移而降低,这表明circ_00236可能是肺损伤的潜在生物标志物。功能实验表明,circ_002363显著抑制NPs-Nd2O3诱导的DNA损伤。RNA下拉和蛋白质印迹分析发现,circ_002363与蛋白质PARP1/Ku70/Ku80/Rad50相互作用,它们是非同源末端连接(NHEJ)DNA修复的关键参与者。作者还发现circ_002363的形成受到RNA结合蛋白乳腺癌扩增序列2(BCAS2)的调控。在NPs-Nd2O3暴露的16HBE细胞中,BCAS2蛋白通过与circ_002363的宿主基因Pre-DNA2相互作用影响circ_00236 3的表达。总之,该项研究发现首先表明,由BCAS2调节的circ_002363通过NHEJ途径作为DNA损伤的调节器。这些结果增强了我们对控制环状RNA作用的调控机制的理解,并突出了遗传和表观遗传学在暴露于环境化学品后疾病发展中的关系。
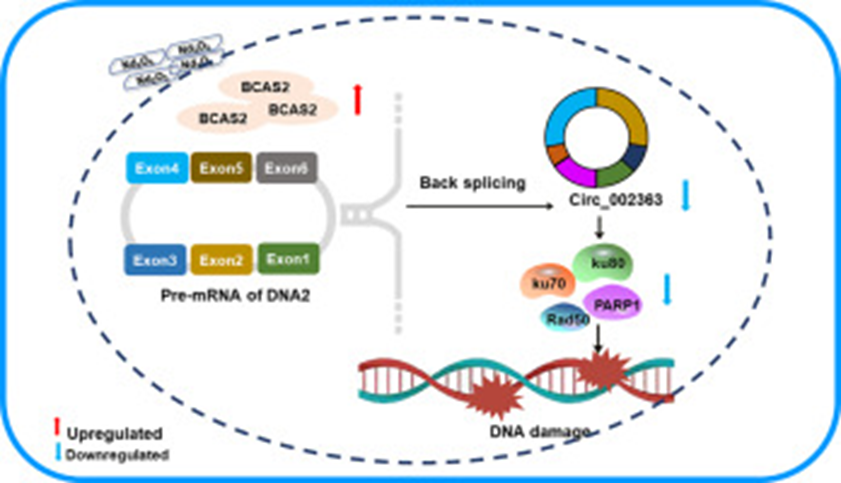 Circ_002363的调控模式图
Circ_002363的调控模式图
杂志:Elife
影响因子:8.713
通讯作者:周恒星(山东大学齐鲁医院)
背景:
脑缺血-再灌注损伤(IRI)是许多神经系统疾病中一个显著的病理过程,在此过程中,神经元经历氧-葡萄糖剥夺/复氧(OGD/R)。N1甲基腺苷(m1A)是一种RNA修饰,可影响基因表达和RNA稳定性。m1A修饰在神经元中的景观和潜在功能仍不清楚。作者研究了正常和OGD/R处理的小鼠神经元中RNA(mRNA、lncRNA和circRNA)m1A的修饰,以及m1A对不同RNA的影响。作者研究了初级神经元中的m1A景观,鉴定了m1A修饰的RNA,并发现OGD/R增加了m1A RNA的数量。m1A修饰也可能影响非编码RNA的调节机制,例如lncRNA RNA结合蛋白(RBPs)相互作用和circRNA翻译。研究团队发现,m1A修饰介导circRNA/lncRNA–miRNA mRNA竞争内源性RNA(ceRNA)机制,mRNA的3’非翻译区(3’UTR)修饰可以阻碍miRNA mRNA的结合。确定了三种修饰模式,不同模式的基因具有潜在的m1A调节特异性的内在机制。对正常和OGD/R神经元中m1A景观的系统分析为理解RNA修饰奠定了关键基础,并为治疗和开发OGD/R病理相关疾病的药物提供了新的视角和理论基础。
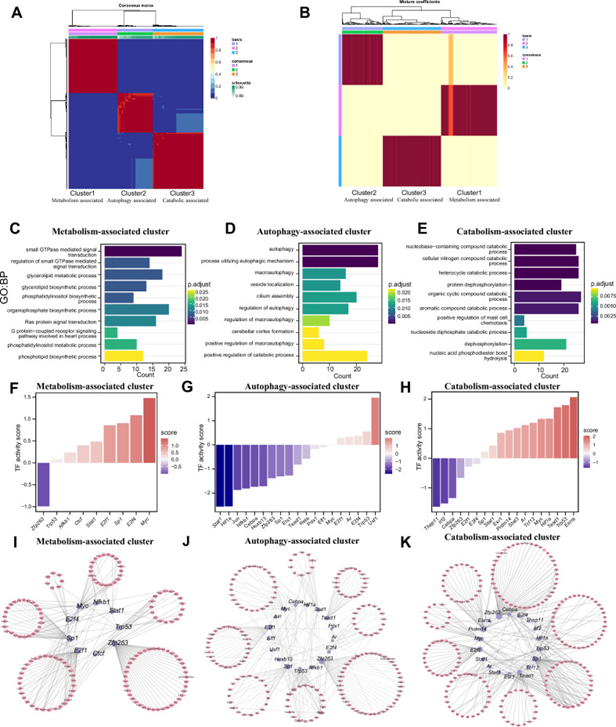
转载请联系邮箱授权:circRNA@163.com
.png)