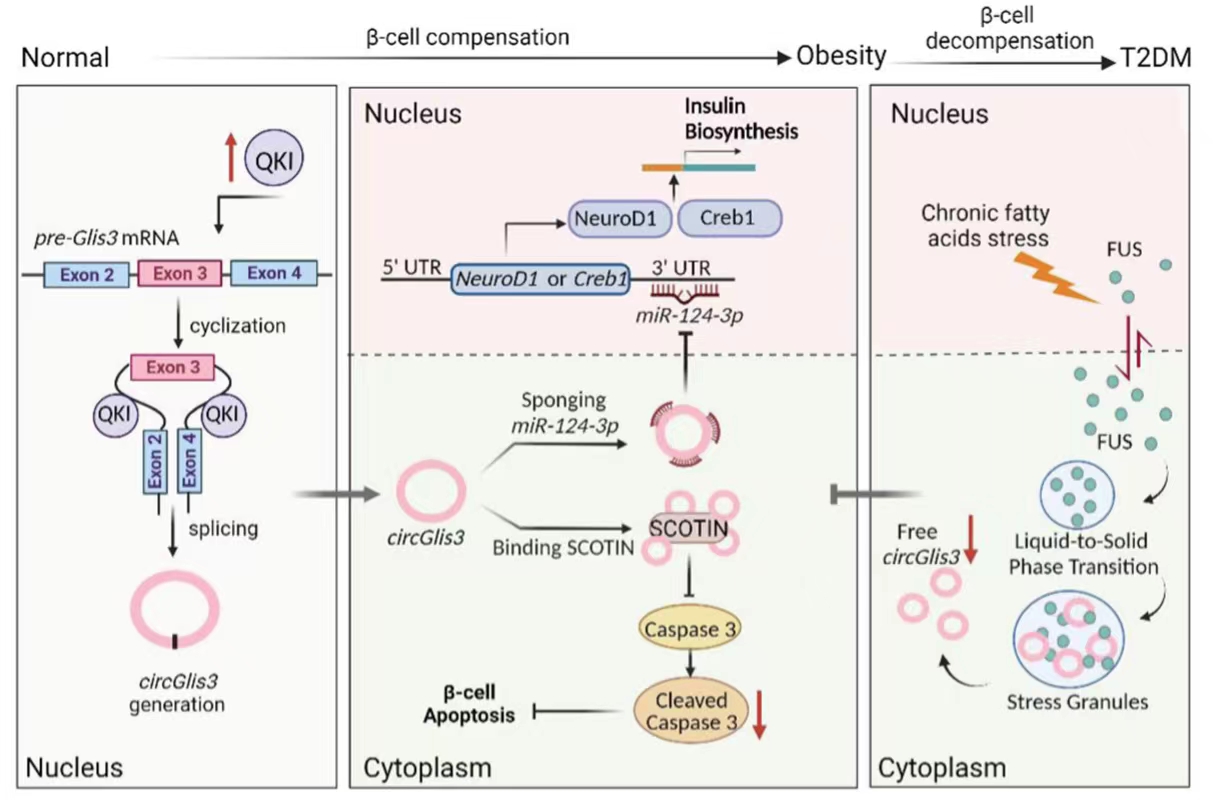
circRNA作为一种新型的非编码RNA分子,参与了多种疾病的进展过程。先前研究表明胰岛中有数千种胰岛特异性circRNA,也有部分研究为了解circRNA在胰岛β细胞中的功能提供了重要基础[3],但目前尚不清楚这些circRNA如何导致肥胖介导的β细胞功能障碍和凋亡。circGlis3是一种富含在胰岛中的circRNA,在遗传和饮食肥胖小鼠模型的胰岛中上调,而这种表达增加会导致胰岛素分泌增强、β细胞凋亡减轻。因此,探究circRNA在胰岛中的具体机制,可以为预防糖尿病提供新思路和新策略。

1.circGlis3在肥胖雄性小鼠的胰岛中表达升高
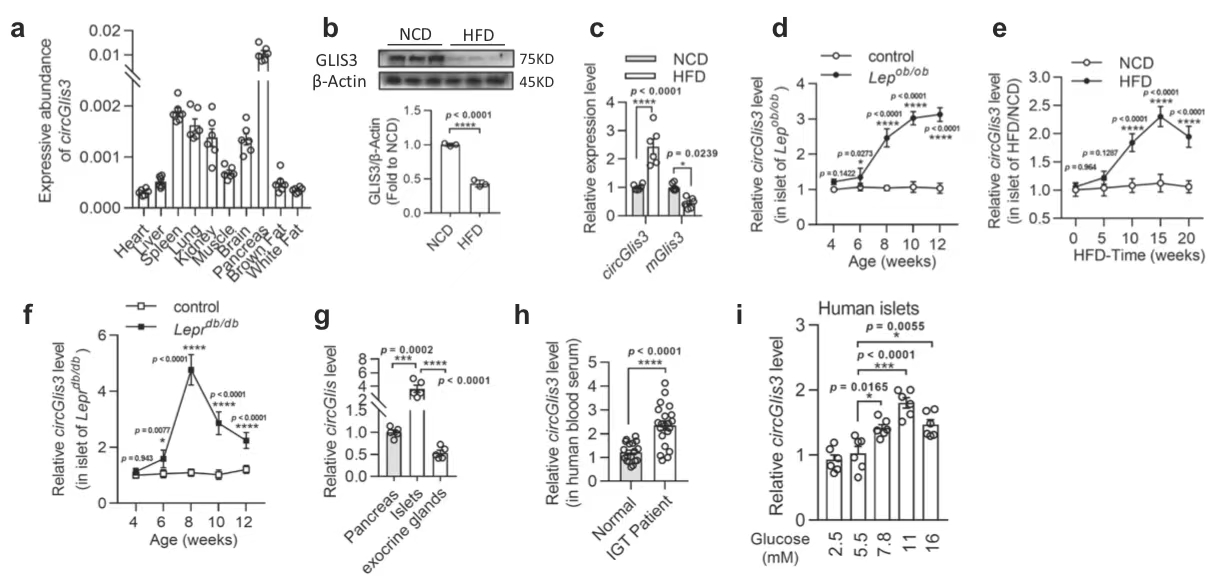
图1. circGlis3在肥胖中上调并与肥胖相关
2.剪接因子QKI调节circGlis3的形成
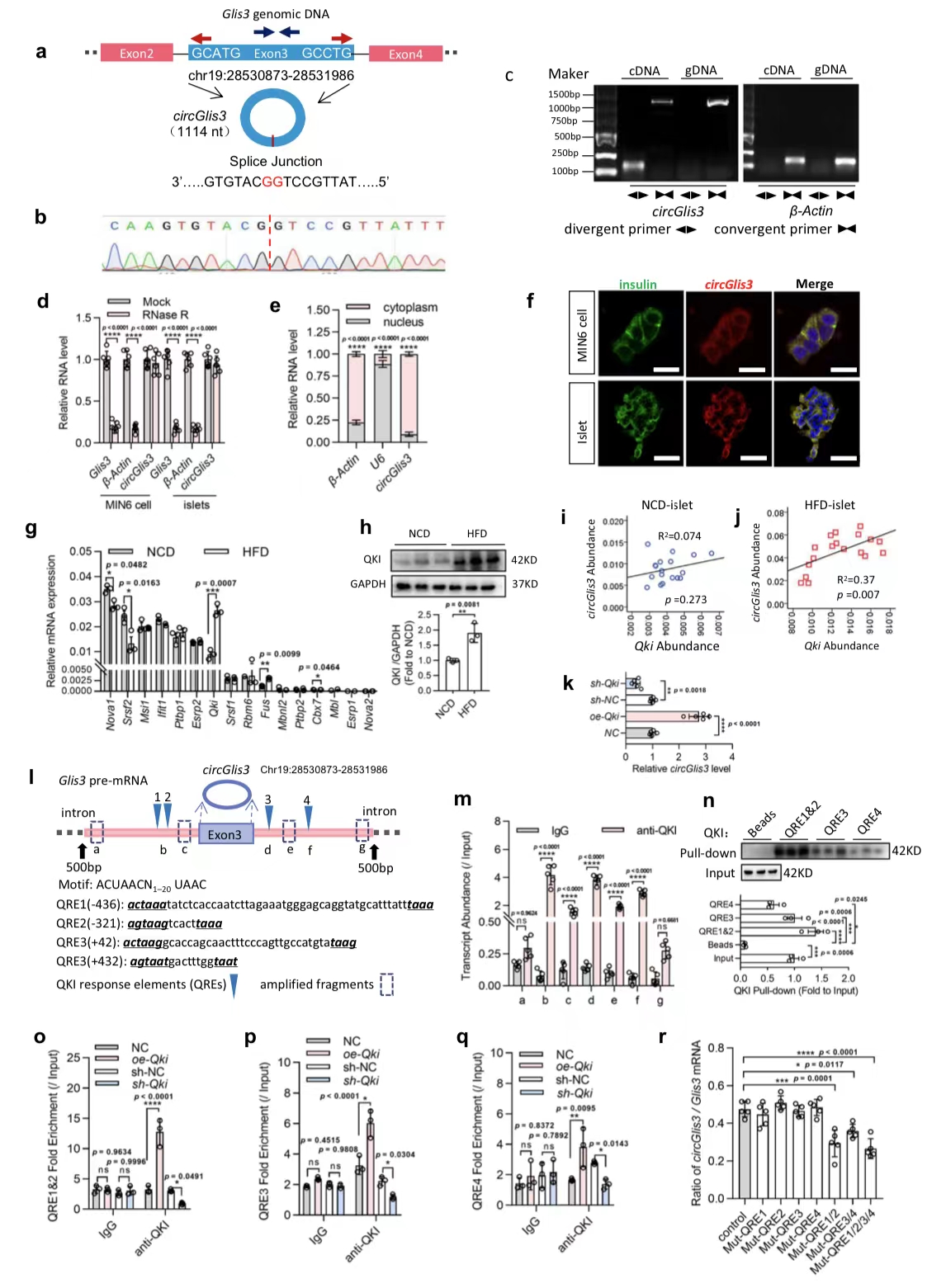
图2. 鉴定和剪接因子QKI调节circGlis3的形成
3. circGlis3的上调促进胰岛素转录并减轻体外β细胞凋亡
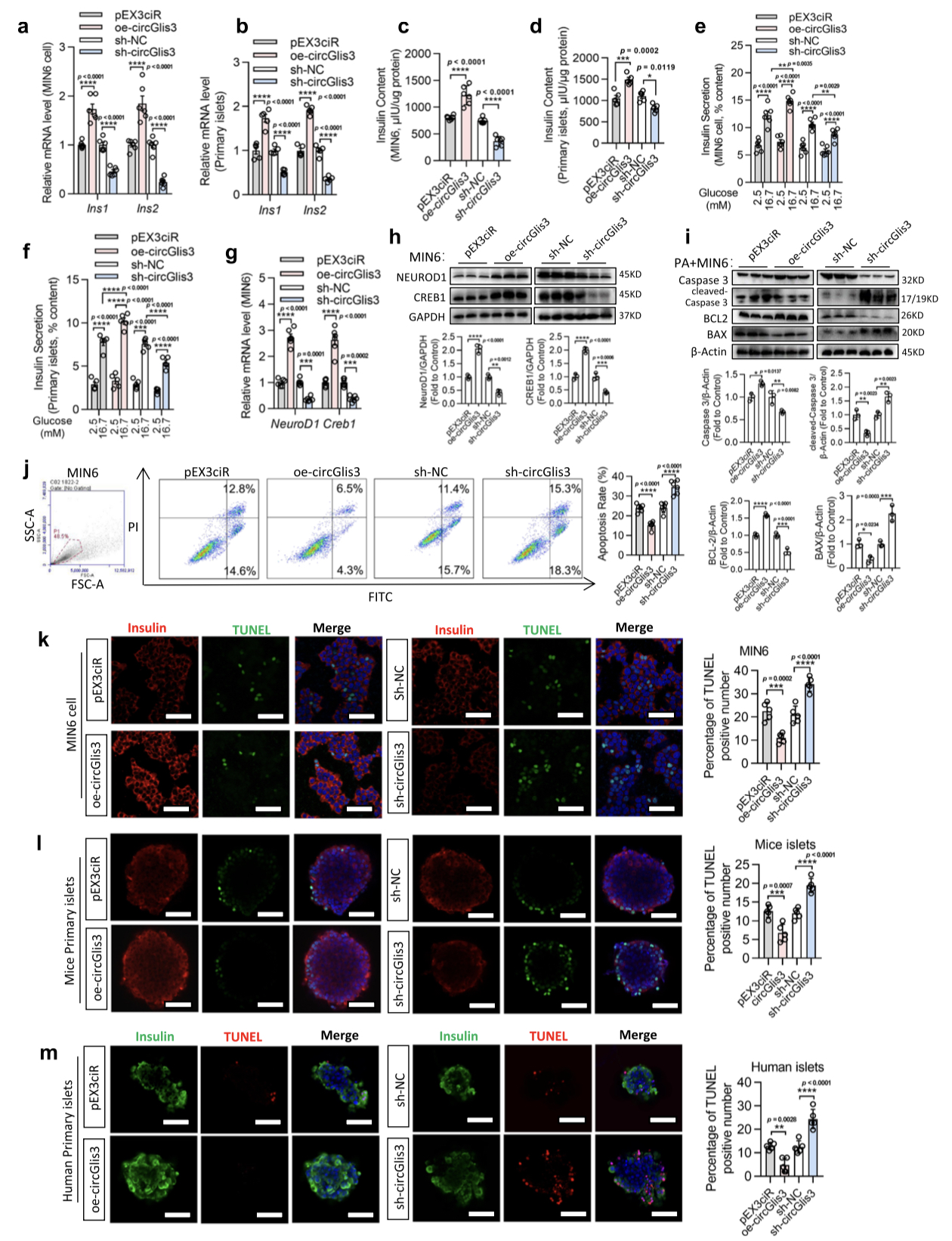
图3. circGlis3的上调促进胰岛素转录和分泌,并抑制体外β细胞凋亡
4.circGlis3的过表达对体内β细胞功能障碍和凋亡的保护作用
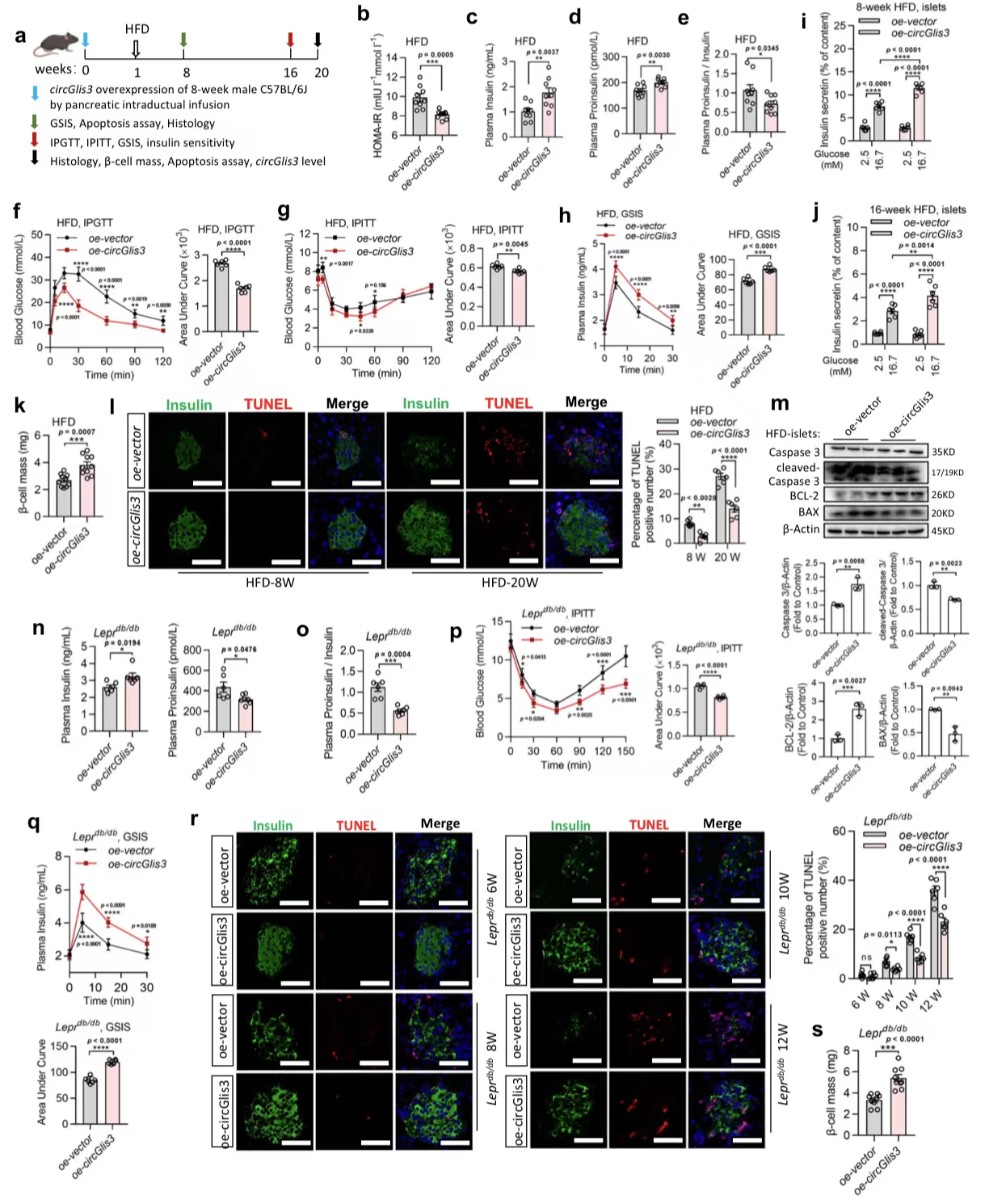
图4. circGlis3的过表达对体内β细胞功能障碍和凋亡的保护作用
5.circGlis3通过吸收miR-124-3p调节胰岛素转录
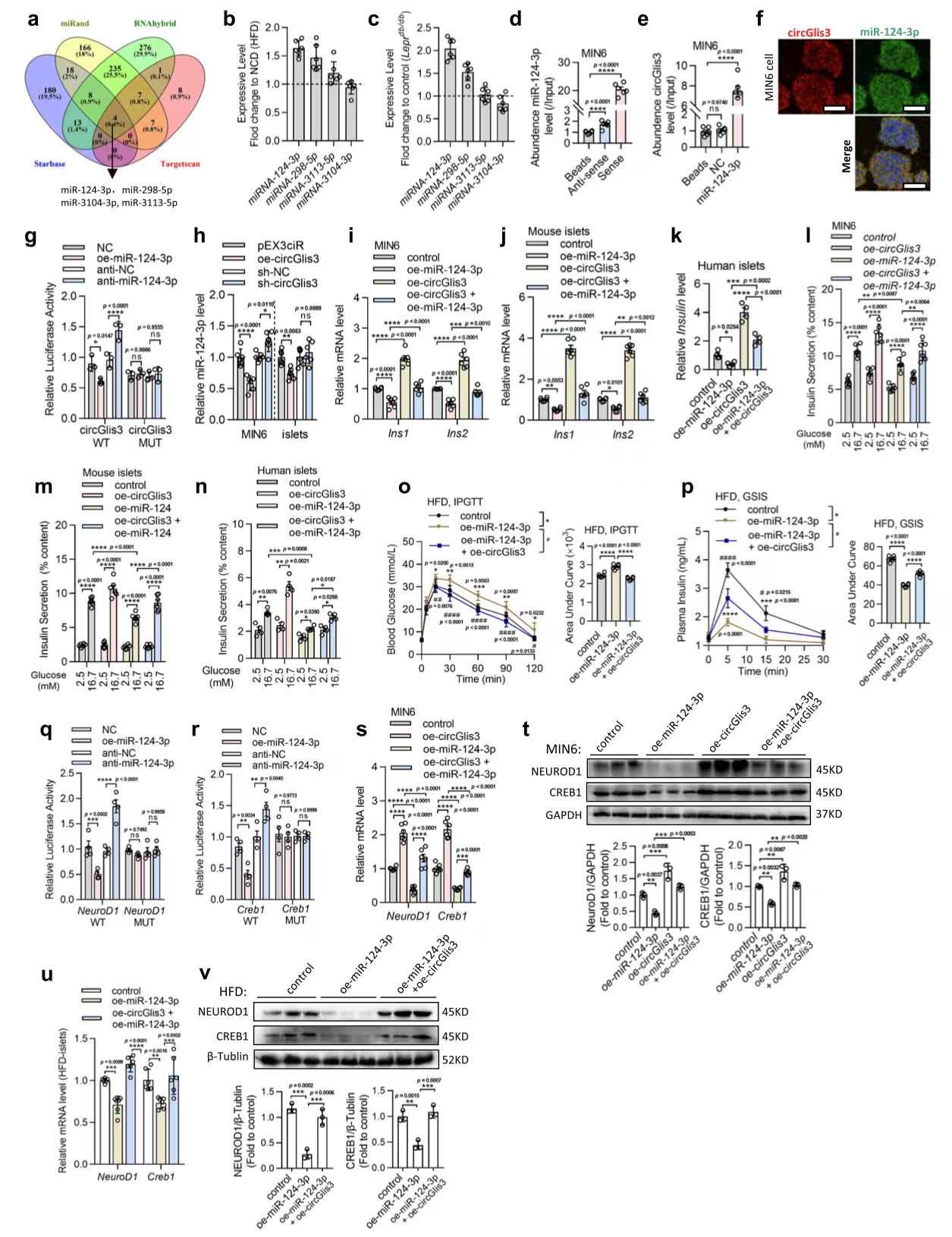
图5. circGlis3通过靶向和吸收miR-124-3p调节胰岛素转录
6.circGlis3与SCOTIN相互作用防止β细胞凋亡
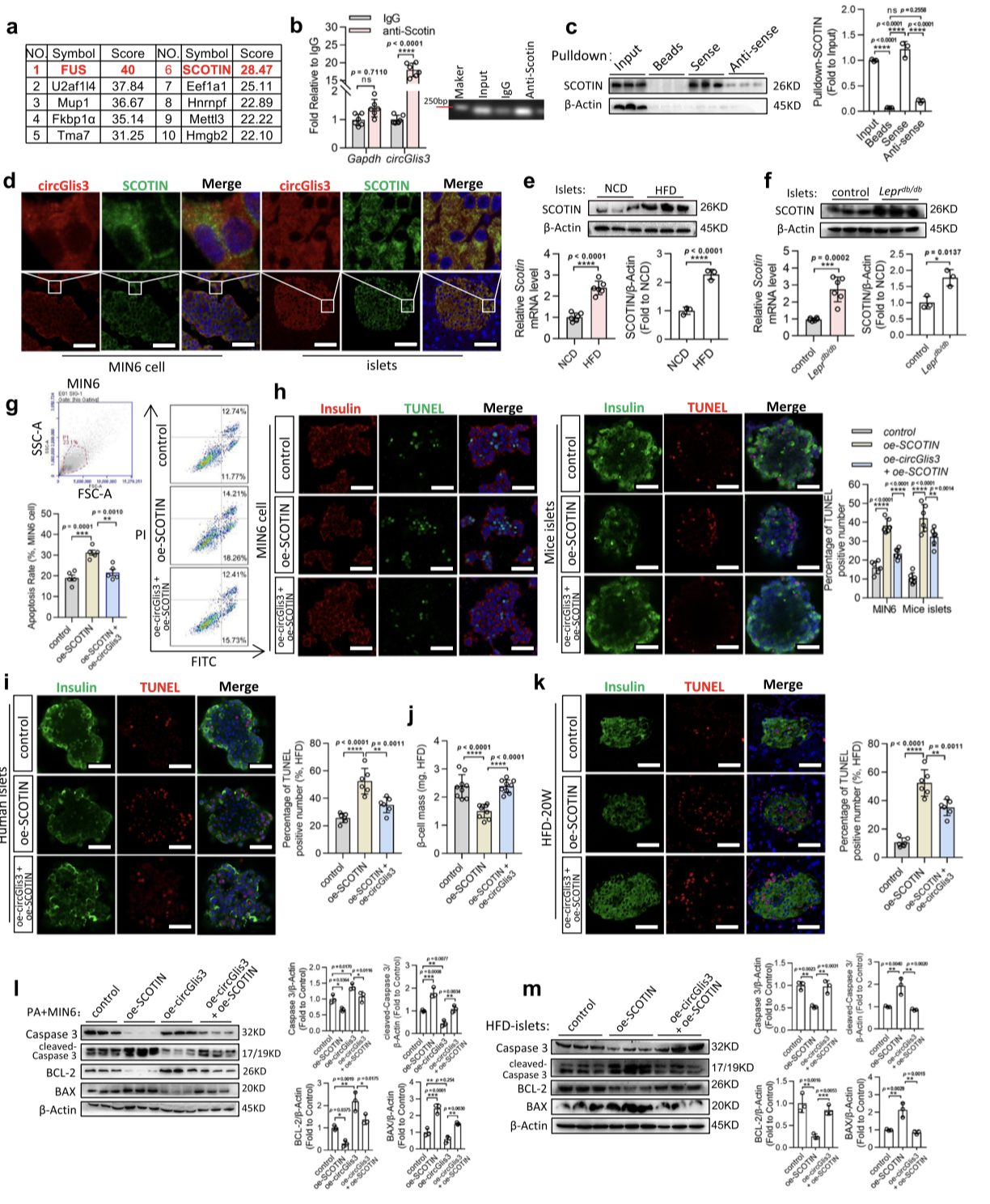
图6. circGlis3通过直接结合SCOTIN防止β细胞凋亡
7.FUS隔离circGlis3以减少其在糖尿病中的丰度
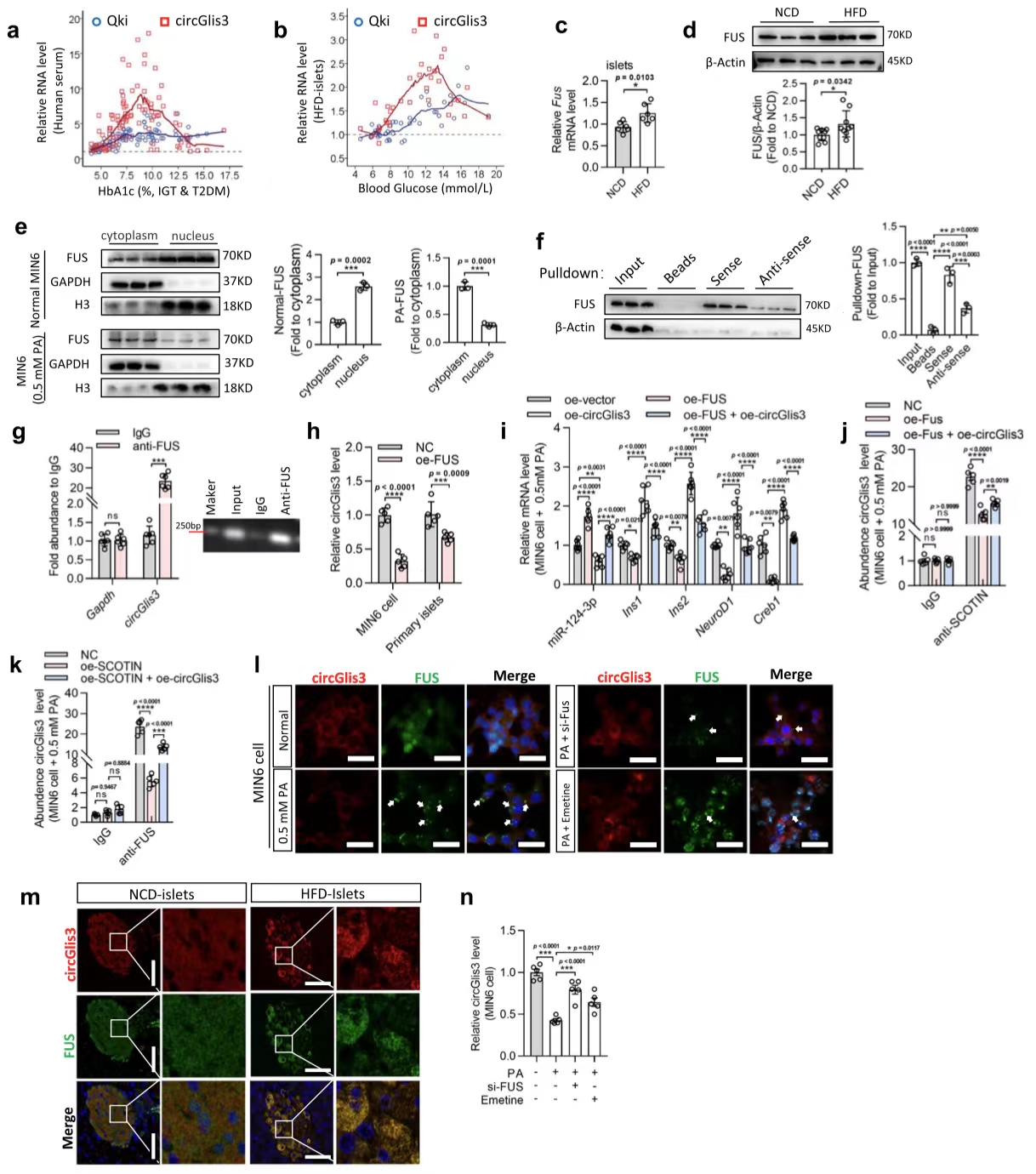
图7. FUS通过组装胞质SG来隔离circGlis3以降低其在糖尿病中的丰度
https://doi.org/10.1038/s41467-023-35998-z
参考文献:
1. Bennett, J. E. et al. NCD Countdown 2030: worldwide trends in non-communicable disease mortality and progress towards Sustainable Development Goal target 3.4. The Lancet 392, 1072–1088 (2018).
2. Butler, A. E., Janson, J., Soeller, W. C. & Butler, P. C. Increased -Cell Apoptosis Prevents Adaptive Increase in -Cell Mass in Mouse Model of Type 2 Diabetes. 52, (2003).
3. Stoll, L. et al. Circular RNAs as novel regulators of β-cell functions in normal and disease conditions. Mol. Metab. 9, 69–83 (2018).
转载请联系邮箱授权:circRNA@163.com
.png)